钙化斑块特征预测经皮冠状动脉介入治疗术中旋磨
尹卫华,李响楠,田 涛,吕 滨*
(1.国家心血管病中心 北京协和医学院 中国医学科学院阜外医院放射影像科,2.心内科,北京 100037)
复杂而严重的钙化病变对于成功实施经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是严峻挑战,增加发生冠状动脉夹层、穿孔及无复流等手术风险[1],使支架不能完全覆盖血管内膜,支架与内膜之间的缝隙易造成支架内血栓形成及再狭窄[2]。2011年美国心脏协会PCI指南[3]中指出,血管内膜存在严重钙化、且球囊导管不能通过及不能充分扩张血管腔时,可预先通过旋磨处理病变。
冠状动脉造影能准确评估冠状动脉病变的解剖位置及狭窄程度,但很难精确判断钙化分布及严重程度。血管内超声(intravascular ultrasound, IVUS)为腔内成像技术,对于指导术中旋磨有显著优势。冠状动脉CT血管成像(coronary CT angiography, CCTA)不仅能无创评估冠状动脉斑块性质、斑块累及长度,也能评估病变处钙化积分、短轴位上钙化形状及钙化重构指数。Agatston积分往往用来评估钙化斑块的负荷,同时能预测PCI的复杂性及相关并发症。研究[4]表明,病变处钙化积分是旋磨的独立预测因子,但其中缺乏IVUS对旋磨的贡献价值以及CT钙化斑块重构指数对旋磨的影响。本研究通过CT、冠状动脉造影及IVUS分析钙化斑块特征,预测术中是否需要旋磨。
1 资料与方法
1.1 一般资料 回顾性分析2016年12月—2018年12月有症状疑诊冠心病入院患者。纳入标准:接受CCTA、冠状动脉造影及IVUS,均显示冠状动脉存在不同程度钙化斑块,各检查时间间隔小于3个月。排除标准:有冠状动脉再血管化治疗史,冠状动脉造影或IVUS证实急性或亚急性血栓形成、自发冠状动脉夹层或冠状动脉扩张症及冠状动脉瘤、左心功能不全。
1.2 CCTA 采用Siemens SOMATOM Definition Flash CT机,准直器宽度为2×64×0.6 mm,机架旋转时间280 ms,连接心电门控,行前瞻性心电门控扫描。先行足-头方向冠状动脉平扫,范围自主动脉根部至心脏膈面。分别测量每例患者、每支血管及每处病变的Agatston钙化积分,病变处钙化积分定义为靶病变面积×密度系数[5],密度系数分别为1:130~199 HU,2:200~299 HU,3:300~399 HU,4:≥400 HU。
采用Bolus tracking自动跟踪技术,将ROI置于升主动脉,三期相注射对比剂,待CT值上升至100 HU后延迟6 s开始扫描。重建层厚0.75 mm,层间距0.5 mm,视野200 mm。滤波反投影法重建采用中等平滑卷积核(B26f),迭代重建(SAFIRE)采用I26f卷积核;血管钙化严重时,以B46f或I46f进行重建。迭代降低噪声强度3级[6]。严重钙化斑块定义为造影显示冠状动脉狭窄处血管壁出现明显高密度影,对比剂注射前心脏搏动间隙仍可见明显阴影,或CCTA短轴显示钙化为满月型、环形或钙化范围>270°,或IVUS显示血管壁强回声伴后方声影,范围>270°的斑块[7]。后处理重建中测量钙化病变累及长度,在短轴位上测量钙化弧度范围:1级<90°,2级90°~179°,3级180°~270°,4级为>270°。于病变处对应钙化最重位置评价钙化角度及范围。钙化重构指数为短轴位上钙化程度最重处管腔直径除以病变近心端的参考管腔直径[8]。由放射科医师在不知晓造影及IVUS结果的前提下盲法阅CT片,完成上述测量。
1.3 冠状动脉造影、IVUS及PCI 经桡动脉或股动脉入径行冠状动脉造影,按照标的Judkins法投照,获取5个以上左冠状动脉及2个以上右冠状动脉投影。病变处存在分叉或严重扭曲定义为“复杂病变”[4]。测量病变长度、管腔狭窄率和SYNTAX积分。
选用常规导丝行IVUS,评估及测量靶血管钙化,包括钙化位置(表浅型、深层型及混合型),角度范围(4个分级同CCTA,图1)及钙化病变处对应的最小管腔面积。心内科医师在不知晓CCTA结果的情况下盲法阅读造影及IVUS图像,完成上述测量。
采用冠状动脉内旋磨系统,直径1.25~1.75 mm旋磨头,待其进入靶血管后,以(14~19)×104rot/min速度旋磨,每次<30 s,结束后低转速退出旋磨头。复查冠状动脉造影,根据旋磨后血管狭窄程度改善情况决定是否行球囊后扩张及PCI。手术成功定义:成功完成旋磨并植入支架,局部残余狭窄<30%;且术后未见冠状动脉夹层、血栓、穿孔或前向TIMI血流Ⅲ级[9]。
1.4 统计学分析 采用SPSS 23.0统计分析软件。以±s表示连续变量,分类变量以百分比或频数表示。采用单样本柯尔莫戈夫-斯米诺夫检验变量是否为正态分布,符合正态分布时,组间比较采用非配对t检验;不符合正态分布则采用独立样本非参数检验;分类变量比较采用χ2检验;将两组差异有统计学意义的单因素变量纳入Logistic回归分析模型。绘制ROC曲线,评价相关危险因素的诊断效能,并通过AUC寻找对应的最佳界值,以MedCalc 12.5软件计算AUC及其95%CI。以IVUS为“金标准”,计算钙化弧度分级的敏感度、特异度及准确率。P<0.05为差异有统计学意义。
2 结果
对157例患者(224个靶血管病变)成功实施PCI,133例(196个靶血管病变)术中未旋磨(非旋磨组),24例(28个靶血管病变)术中进行旋磨(旋磨组)。对4个靶血管病变在旋磨前施行了预扩。旋磨组患者年龄大于非旋磨组(P<0.05),2组间性别、用药情况及危险因素差异均无统计学意义(P均>0.05),见表1。旋磨组SYNTAX积分高于非旋磨组(P<0.05)。2组间复杂病变差异无统计学意义(P均>0.05)。CCTA结果表明旋磨组血管、病变水平钙化积分更高,靶病变钙化体积更大(P均<0.01)。2组间CCTA平扫和增强、造影及IVUS特征参数比较见表2~4。

表1 2组患者一般资料比较

图1 患者男,72岁,CT短轴及IVUS图像上钙化斑块累及弧度范围 A.1级CT短轴图; B.2级CT短轴图; C.3级CT短轴图; D.4级CT短轴图; E.1级IVUS图; F.2级IVUS图; G.3级IVUS图; H.4级IVUS图

表2 2组CCTA平扫及增强特征值比较
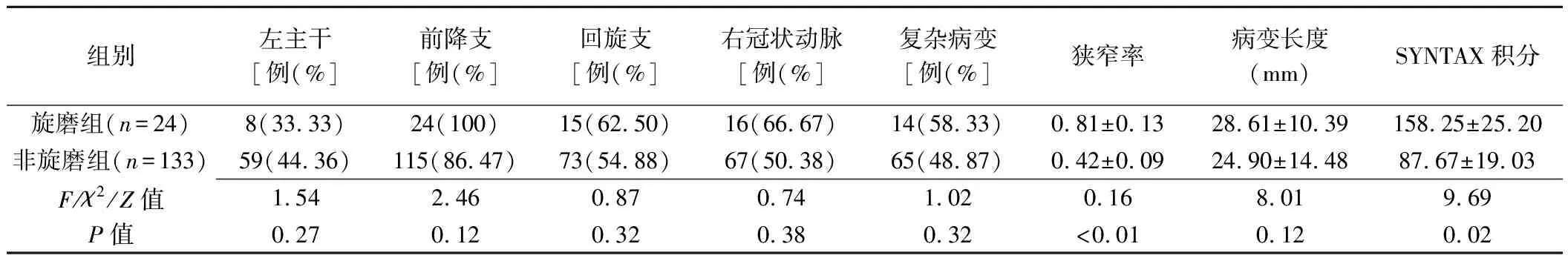
表3 2组冠状动脉造影特征值比较

表4 2组IVUS特征值比较
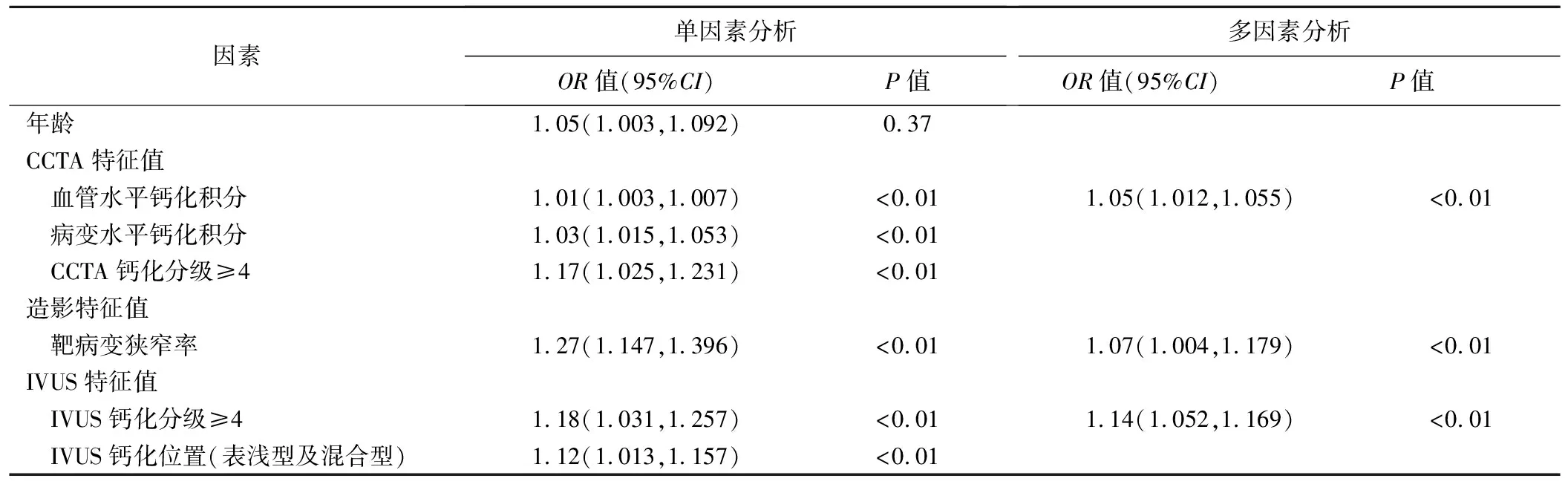
表5 临床资料、CCTA、造影及IVUS特征预测旋磨的Logistic回归分析
病变处钙化积分、管腔狭窄率、CCTA钙化弧度≥270°、IVUS钙化弧度≥270°、IVUS评价钙化位置为表浅型及混合型预示需要旋磨(P均<0.01),见表5。校正患者年龄、性别、管腔狭窄率及钙化位置、SYNTAX积分等因素后,发现CCTA病变处钙化积分及钙化弧度分级为4系钙化病变旋磨的独立预测因子,通过靶病变钙化积分预测旋磨的AUC为0.926,见图2。以病变处钙化积分=313为截断值,其预测旋磨的敏感度及特异度分别为95.84%及82.67%,见图3。CCTA钙化弧度范围4级预测旋磨的敏感度及特异度分别为93.44%及90.52%。
以IVUS为金标准,CCTA诊断钙化斑块弧度大于270°(即分级为4的钙化斑块)的敏感度、特异度和准确率分别为84.61%、95.68%和94.90%。
3 讨论
本研究通过校正患者年龄、性别、管腔狭窄率及钙化位置、SYNTAX积分等混杂因素,发现病变处钙化积分及钙化弧度分级4级是PCI术中旋磨的独立预测因子。钙化积分可反映冠状动脉钙化严重程度,钙化积分越高,斑块负荷越重。有研究[10]认为根据病变处或每支血管Agatston钙化积分诊断管腔狭窄优于患者水平Agatston钙化积分或钙化体积。SILVERMAN等[11]在一项无症状多种族人群队列研究中发现,病变处钙化积分>400能预测患者未来需接受再血管化治疗,且在8.5年的随访中发现更多患者接受了冠状动脉搭桥术,表明病变处钙化斑块负荷越重,PCI成功开通率越低。
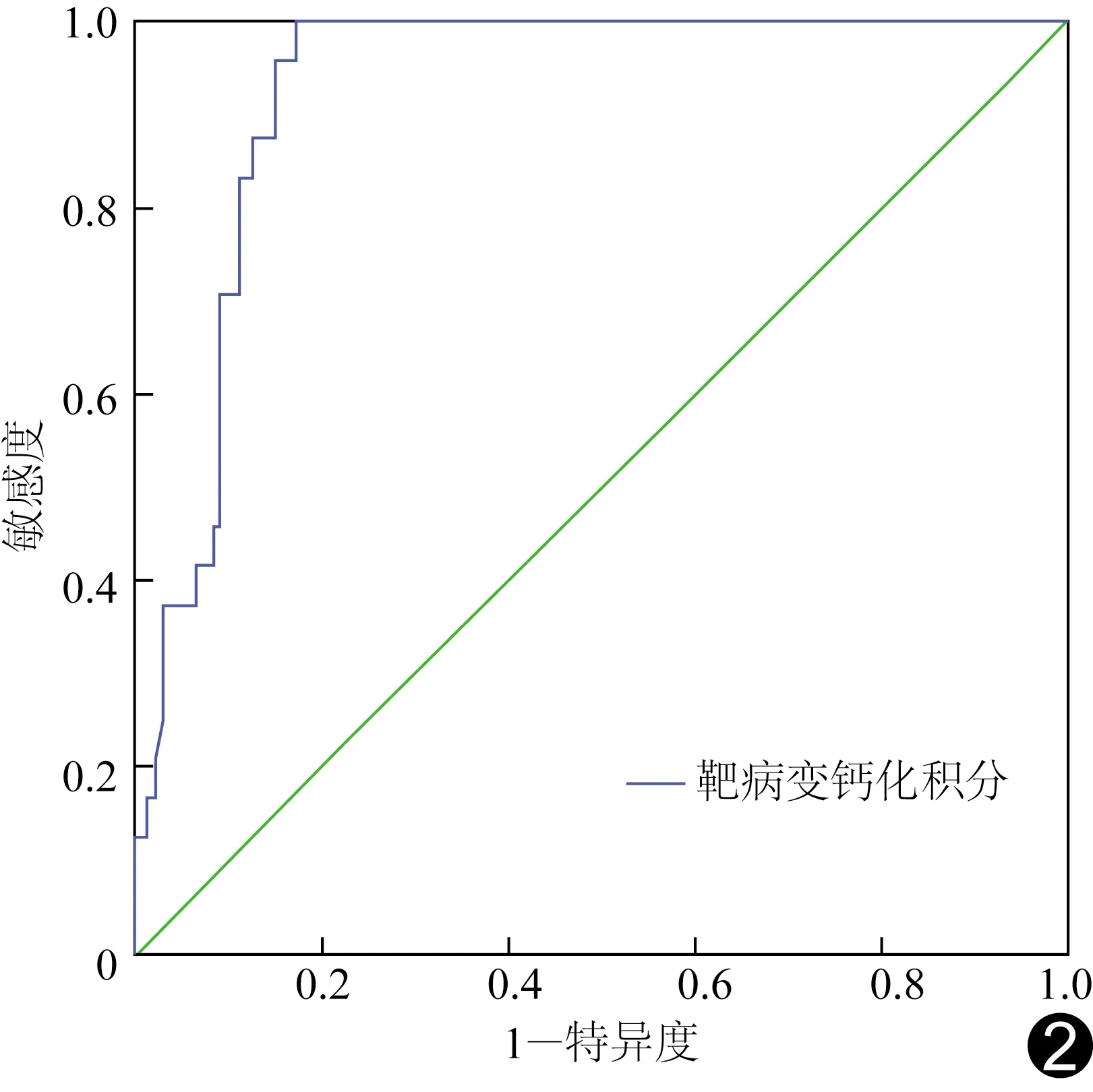
图2 靶病变钙化积分预测冠状动脉钙化斑块是否旋磨的ROC曲线

图3 患者男,65岁,不稳定心绞痛,分别接受CCTA、造影及IVUS检查,CT平扫靶病变钙化积分为430分 A.CCTA多平面重组(MPR)图像显示前降支弥漫性钙化斑块; B.ICA左前斜位显示前降支近段节段性管腔重度狭窄(箭); C、D.CCTA短轴及IVUS图像均显示前降支近段管壁环形钙化,累及角度范围约360°,即刻对前降支近段行冠状动脉旋磨术,并成功植入支架
对介入医生而言,PCI术前识别严重钙化斑块及潜在的球囊无法扩开的病变十分重要。严重钙化可导致PCI失败,支架膨胀不良,支架内再狭窄及冠状动脉夹层、血栓发生率增加。旋磨可用于治疗严重钙化病变,根据“选择性切割”及“差异切割”原理,选择性去除部分钙化或纤维化斑块,除扩大管腔内径外,还能改善血管顺应性,使球囊易于通过病变并扩张,使PCI成功。
多因素Logistic回归模型显示,通过定量测量钙化积分、对钙化弧度进行分级,CCTA可以预测术中是否需要对钙化病变进行旋磨,病变处钙化积分为313时,其预测旋磨的敏感度为95.84%,特异度为82.67%。WANG等[12]发现,利用IVUS指导PCI术中钙化斑块旋磨成功率高,术后并发症少。CERCI等[13]报道,以钙化斑块弧度范围≥270°诊断有意义狭窄的敏感度及特异度分别为86%及84%。本研究发现CCTA显示钙化弧度≥270°预测旋磨的敏感度及特异度分别为93.44%及90.52%;以IVUS为金标准,CT评估病变钙化分级的诊断效能较高,敏感度、特异度及准确率分别为84.61%、95.68%及94.90%;发生误判时,原因可能是晕状伪影及容积效应的影响导致高估钙化斑块面积及管腔狭窄程度而低估管腔内直径[14];钙化重构指数受窗宽、窗位的影响,重复性与一致性均欠佳。IVUS可清晰显示钙化在血管壁内的分布,但CT 具有无创、价格更低、检查预约时间更短等优势。
本研究的局限性:样本量较小,且为单中心回顾性研究;缺乏对远期支架内血栓、再狭窄发生率及远期终点事件的随访。
综上所述,依据CT所示病变处钙化积分及短轴位上钙化弧度范围能准确预测钙化病变术中旋磨,为术前评估及术中指导提供帮助。

