溶胶-凝胶包埋法提高丙酮酸氧化酶稳定性
刘冰,姚兵莉,张梦君,杨晔,周逸纯,张建国
(上海理工大学 医疗器械与食品学院,食品科学与工程研究所,上海,200093)
丙酮酸氧化酶(pyrvate oxidase,POD)是一种主要用于食品、生物发酵制品检测的重要用酶。食品和生物发酵系统中的丙酮酸、无机磷酸、尿素、丙酮酸激酶、3-巯基丙酮酸硫转移酶、丙氨酸氨基转移酶等物质都可以利用POD检测[1]。POD最早发现于大肠杆菌中,之后又在植物乳杆菌、绿色气球菌、变形杆菌、人细胞等多种生物中被发现。不同来源的POD具有不同的生理功能。根据POD所需的辅基或辅酶因子不同,POD可分为二类。一类是转移2个电子到氧分子中,产生过H2O2。如来自德氏乳杆菌的POD、绿色气球菌的POD[2]。另一类是不以氧分子为直接受体,不产生过氧化氢。如来自大肠杆菌的POD。由于第一类POD可以产生H2O2,所以常与过氧化氢酶联合用于物质的检测。KEHR等首先制备基于POD的电化学生物传感器测定丙酮酸含量[3]。MIZUTZNI等制备的多离子络合物膜固定POD传感器展现了高灵敏度的优点[4]。目前,POD可以快速测定发酵液中丙酮酸含量[5]。POD试剂盒测定丙酮酸激酶具有时间短,准确性高,误差小等优点[6]。但是,来自野生型绿色气球菌的POD产量较低,为120 U/L[7]。近年来,采用基因工程技术分别将POD的产量陆续提高到670[8]、1 078[9]、3 307[10]、 4 106.9[11]、17 194.9[12]、 21 243.3 U/L[13]。由于pH和温度对POD性质的影响较大,所以提高POD稳定性将更有利于POD应用。由于POD是一个四聚体,所以保持POD的四聚体结构将有利于提高POD稳定性。近年来,溶胶-凝胶包埋法(sol-gel encapsulation)已成为环境友好,高效固定化生物催化剂的方法[14-15]。它将酶分子相对固定在一个有限空间内,避免酶结构大幅度改变而丧失活力[16]。而且,溶胶-凝胶包埋法可以制备纳米级别的固定化酶,有利于高效发挥催化作用[17]。溶胶-凝胶包埋法已经成功用于多种单亚基的酶分子稳定性研究中。例如,HONG等利用溶胶-凝胶包埋法对脂肪酶和胰凝乳蛋白酶的单个酶分子进行包埋而显著提高稳定性[17]。这种包埋方法也被称为金属有机框架固定化酶。DU等优化溶胶-凝胶包埋法的工艺,显著提高了过氧化氢酶的稳定性[18]。本研究利用溶胶-凝胶包埋法将POD的4个亚基限制在SiO2的网络结构内,提高POD稳定性。本研究的结果将为制备稳定性好的多亚基酶分子提供思路,也为POD的应用提供帮助。
1 材料与方法
1.1 实验材料
丙酮酸氧化酶,来自重组大肠杆菌pET28a-pod[19]。四甲氧基硅烷(tetramethyloxysilane,TMOS)、二辛基琥珀酸钠(aeroslol-OT,AOT)、二辛基丙烷(decyl maltose neopentyl glycol,BTP)、正己烷,国药集团化学试剂有限公司。
BTP缓冲液(100 mmol/L):称取2.824 g BTP、0.222 g CaCl2,加入10 mL异丙醇和70 mL去离子水,混合均匀,用20 mmol/L HCl调pH至6.0,定容至100 mL,备用。
AOT溶液(40 mmol/L):称取0.9 g AOT,加入50 mL正己烷,混合均匀,备用。
工作液1:取1 mL 4-氨基安替比林溶液、2 mL 1.0 mol/L KH2PO4-NaOH溶液(pH 6.0)、100 μL黄素腺嘌呤二核苷酸二钠溶液、200 μL焦磷酸硫胺素溶液、1 mL辣根过氧化物酶溶液、1.7 mL水混合,混合均匀后,于4oC保存,备用。
工作液2:取2 mL苯酚溶液、2 mL MgCl2溶液混合,混合均匀后,于4oC保存,备用。
1.2 溶胶-凝胶法包埋POD的过程
溶胶-凝胶法包埋POD是通过“离子配对”的形式实现的。POD以离子对的形式溶于含有阴离子型表面活性剂(AOT)的有机溶剂中, TMOS水解产生的SiO2在POD周围形成硅胶网络,再利用反胶束萃取技术将包埋后的POD萃取出来。具体操作步骤如下:(1)取9 mL POD溶液与1 mL BTP缓冲液混合均匀;(2)取8 mL混合液于50 mL离心管,加入2 mL AOT溶液,在20℃、200 r/min的摇床中振荡10 min;(3) 取出加入1 μL TMOS溶液混合均匀,4℃静置5 h;(4)加入2.5 mL 1.0 mol/L KH2PO4-NaOH缓冲液(pH 6.0),振荡10 min;于离心机中在4℃,8 000×g条件下离心10 min,溶液出现分层现象,弃有机相,将水相在4℃保存24 h。
1.3 TMOS浓度的优化
在上述步骤3中分别采用不同浓度TMOS溶液(0.336、0.672、3.36、6.72、33.6和67.2 mmol/L)。其他步骤如上述所示,测定加入不同浓度TMOS后POD相对剩余活力。以未包埋POD的初始活力为100%。
1.4 TMOS吸附时间的优化
以TMOS最佳浓度包埋POD后,于4℃分别静置2、5、8、12、16 h。其他步骤如1.2所述,测定POD相对剩余活力。以未包埋POD的初始活力为100%。
1.5 TMOS包埋时间的优化
根据TMOS的最佳浓度和吸附时间,将1.2中步骤4的水相分别在4℃中保存0、24、48、72、96 h。其他步骤如1.2所述,测定POD相对剩余活力。以未包埋POD的初始活力为100%。
1.6 AOT浓度的优化
AOT作为一种弱阴离子表面活性剂,在正己烷中形成反胶束。当其浓度超过临界值时形成反胶束;但当其浓度过高时形成聚集体,增加了萃取的难度,也不易测定溶液中POD活力,故最后优化AOT的浓度。
根据确定的TMOS最佳浓度、最佳吸附和包埋时间,在上述步骤(2)中分别加入不同浓度的AOT溶液,分别为0.5、1、2、5、10和 20 mmol/L。其他步骤如上述所示,测定POD的相对剩余活力。以未包埋POD的初始活力为100%。
1.7 正交实验优化溶胶-凝胶法包埋POD
根据TMOS最佳浓度、最佳吸附时间、最佳包埋时间和AOT溶液最佳浓度进行4因素3水平的正交实验。TMOS最佳浓度、最佳吸附时间和最佳吸附时间的中间水平分别为0.672 mmol/L、5 h、24 h。AOT溶液最佳浓度的中间水平为5 mmol/L。以未包埋POD的初始活力为100%。
1.8 POD活力的测定
取100 μL POD,加入600 μL工作液1、300 μL工作液2、100 μL 1 mol/L 丙酮酸钠溶液,在37oC条件下水浴10 min后,取200 μL反应液测定OD510。POD的活力定义为37oC、pH 6.8条件下,每分钟消耗底物产生1 μmol 的H2O2所需要的酶量。
1.9 POD稳定性测定
分别取2 mL POD与8 mL KH2PO4-NaOH缓冲液(pH 6.0)混合均匀,在 30oC保温3 h后测定相对活力。
1.10 溶胶-凝胶包埋法制备的POD热稳定性
取2 mL包埋后的POD与8 mL KH2PO4-NaOH缓冲液(pH 6.0)混合均匀,分别在20,25,30和37℃保温1~5 h,每隔1 h测1次相对活力,以刚包埋后的POD的活力定为100%。
2 结果与分析
2.1 TMOS浓度对POD活力和稳定性的影响
图1为TMOS浓度对POD相对剩余活力和稳定性的影响。随着TMOS浓度的增加,POD的相对剩余活力总体呈下降趋势(图1-a),说明高浓度TMOS对POD产生抑制作用。当TMOS浓度为0.336~0.672 mmol/L时,POD的相对剩余活力较高,分别为71.27%、76.87%。当TMOS浓度高于3.36 mmol/L时,POD相对剩余活力降到10%~20%。TMOS浓度对剩余POD活力的影响具有显著性(P<0.01)。当TMOS浓度为0.672 mmol/L时,POD的相对剩余活力具有最高值。所以,TMOS的最佳浓度为0.672 mmol/L。图1-b表示加入不同浓度TMOS对POD稳定性的影响。随着TMOS浓度增加,POD的稳定性总体呈先下降,后上升趋势。在TMOS浓度为0.336~3.36 mmol/L时,POD的相对活力分别为39.51%、38.92%和23.36%,处于20%~40%。当TMOS浓度为6.72~67.2 mmol/L时,POD的相对活力分别为86.05%、113.97%和113.75%。TMOS浓度对剩余POD的相对活力的影响具有显著性(P<0.01)综上结果可知,较高浓度TMOS能使POD更加稳定。
2.2 TMOS吸附时间对POD活力和稳定性的影响
图2为TMOS吸附时间对POD活力和稳定性的影响。TMOS的吸附时间对POD相对剩余活力的影响不显著,呈钟形趋势(图2-a)。当吸附时间从2 h增加到5 h时,POD的相对剩余活力由54.21%增加到65.59%。随着吸附时间继续增加,POD的相对剩余活力缓慢下降。当TMOS吸附时间为5 h,POD的相对剩余活力有最佳值。所以,TMOS的最佳吸附时间为5 h。
TMOS的吸附时间对POD稳定性的影响也不显著(图2-b)。在吸附时间为2~16 h,POD的相对活力在30%~40%,呈现先下降后升高的趋势。

a-相对剩余活力;b-稳定性
2.3 TMOS的包埋时间对POD活力和稳定性的影响
图3为TMOS的包埋时间对POD活力和稳定性的影响。图3-a显示包埋24 h的相对剩余活力为83.31%,这可能由于POD亚基之间的连接在包埋的过程中受到破坏。包埋48 h以上,POD的相对剩余活力逐渐下降,包埋120 h后POD剩余48.23%的活力。当TMOS的包埋时间为24 h时,POD的相对剩余活力获得最高。所以,TMOS的最佳包埋时间为24 h。图3-b表明了TMOS的包埋时间对POD在30℃保温3 h稳定性的影响。TMOS的包埋时间时间越长,POD的稳定性越高。在包埋时间为0~120 h时,POD的相对活力仍然在30%~40%。综上,TMOS的包埋时间与POD相对剩余活力成反比,与POD的稳定性成正比。
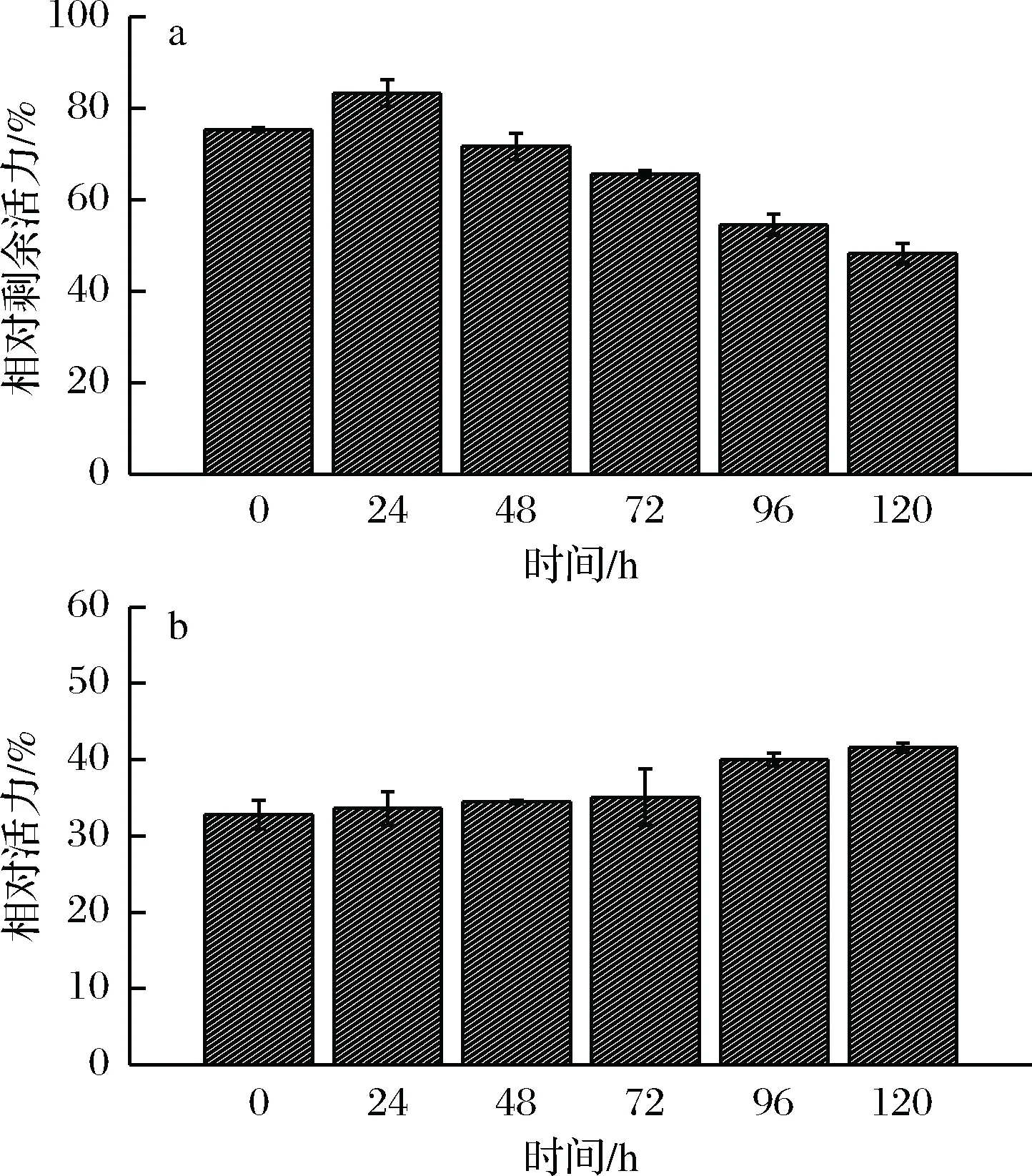
a-相对剩余活力;b-稳定性
2.4 AOT浓度对POD活力和稳定性的影响
AOT浓度对于POD相对剩余活力的影响呈现钟形趋势(图4-a)。POD在AOT浓度为0.5~5 mmol/L时相对剩余活力逐渐升高。当AOT浓度继续升高,POD的相对剩余活力缓慢降低。当AOT浓度为5 mmol/L时,POD的相对剩余活力获得最佳值96.95%,所以,AOT的最适浓度为5 mmol/L。
AOT的浓度对POD稳定性的影响也呈现钟形趋势(图4-b)。当AOT的浓度为0.5~5 mmol/L时,POD的相对活力逐渐升高,达到最佳值33.75%。而当AOT浓度高于5 mmol/L时,POD的相对活力逐渐下降。

a-相对剩余活力;b-稳定性
2.5 正交实验优化溶胶-凝胶法包埋POD
单因素实验表明POD在0.672 mmol/L TMOS、5 h吸附、24 h 包埋、5 mmol/L AOT的条件下具有较佳的活力。采用正交实验的结果见表1。结果表明,TMOS浓度对POD相对剩余活力的影响最大,其次为TMOS包埋时间、吸附时间、AOT浓度。当采用TMOS浓度为0.672 mmol/L、2 h吸附、24 h 包埋、5 mmol/L AOT时, POD有最佳的剩余活力90.81%,比对照提高了14%。

表1 包埋条件对POD的相对剩余活力影响的正交试验结果
2.6 溶胶-凝胶包埋法的POD热稳定性
图5-a~图5-d分别表示SiO2包埋后POD在20、25、30和37℃保温5 h的相对活力。包埋后POD的活力在20、25和30℃远远高于对照。图5-a显示,随着时间的增加,对照组的POD活力逐渐下降,在20℃保温5 h后的活力为43.92%;而包埋后POD在20℃保温5 h的活力依然为100%,为对照组POD活力的2.28倍。图5-b表明在25℃条件下对照组的POD活力在5 h后剩余19.67%;而包埋后POD的活力在1~4 h保持90%以上,5 h后为62.12%,为对照组POD活力的3.16倍。图5-c表明在30℃条件下对照组和包埋POD的活力都剧烈下降,之后呈现缓慢下降趋势,5 h后分别剩余3.79%和66.40%活力。图5-d表明对照组和包埋POD的活力在37℃条件下都不稳定,保温1 h后活力分别为0.79%和6.67%,5 h后活力分别为0.38%和0.88%。以上结果表明,包埋POD的热稳定性在20~30℃时比对照组显著提高,在37℃条件下提高不明显,这对POD的应用具有重要的意义。
3 结论
尽管POD为四聚体结构,但经过溶胶-凝胶包埋法的SiO2网络包埋,加强了亚基之间的连接,提高POD的稳定性。本研究首先通过单因素实验确定最佳的条件为0.672 mmol/L TMOS、TMOS吸附5 h、TMOS包埋24 h和5 mmol/L AOT。结果表明,高浓度TMOS使POD更加稳定,抑制POD活力, TMOS的吸附时间对POD活力和包埋后POD稳定性的影响都不显著,TMOS包埋时间越长,POD相对剩余活力越低,稳定性越好,AOT浓度对POD相对剩余活力的影响不显著。正交实验确定最佳包埋条件,即浓度为0.672 mmol/L TMOS、5 h的TMOS吸附、24 h的TMOS包埋和5.0 mmol/L AOT。包埋后POD的相对剩余活力比对照高14%,且包埋后POD的热稳定性在20~30℃也显著提高。因此,溶胶-凝胶包埋法是一种有效地提高POD稳定性的方法。溶胶-凝胶包埋法可以提高POD等多亚基酶的稳定性。但是,溶胶-凝胶包埋法的步骤还较为繁琐,操作要求也较高,操作过程中不仅要考虑溶胶-凝胶包埋步骤中对酶活力的损失,还要考虑包埋后酶的稳定性。本研究结果表明溶胶-凝胶包埋法对POD活力的损失还较为严重,所以避免POD活力的损失将是一个研究的方向。
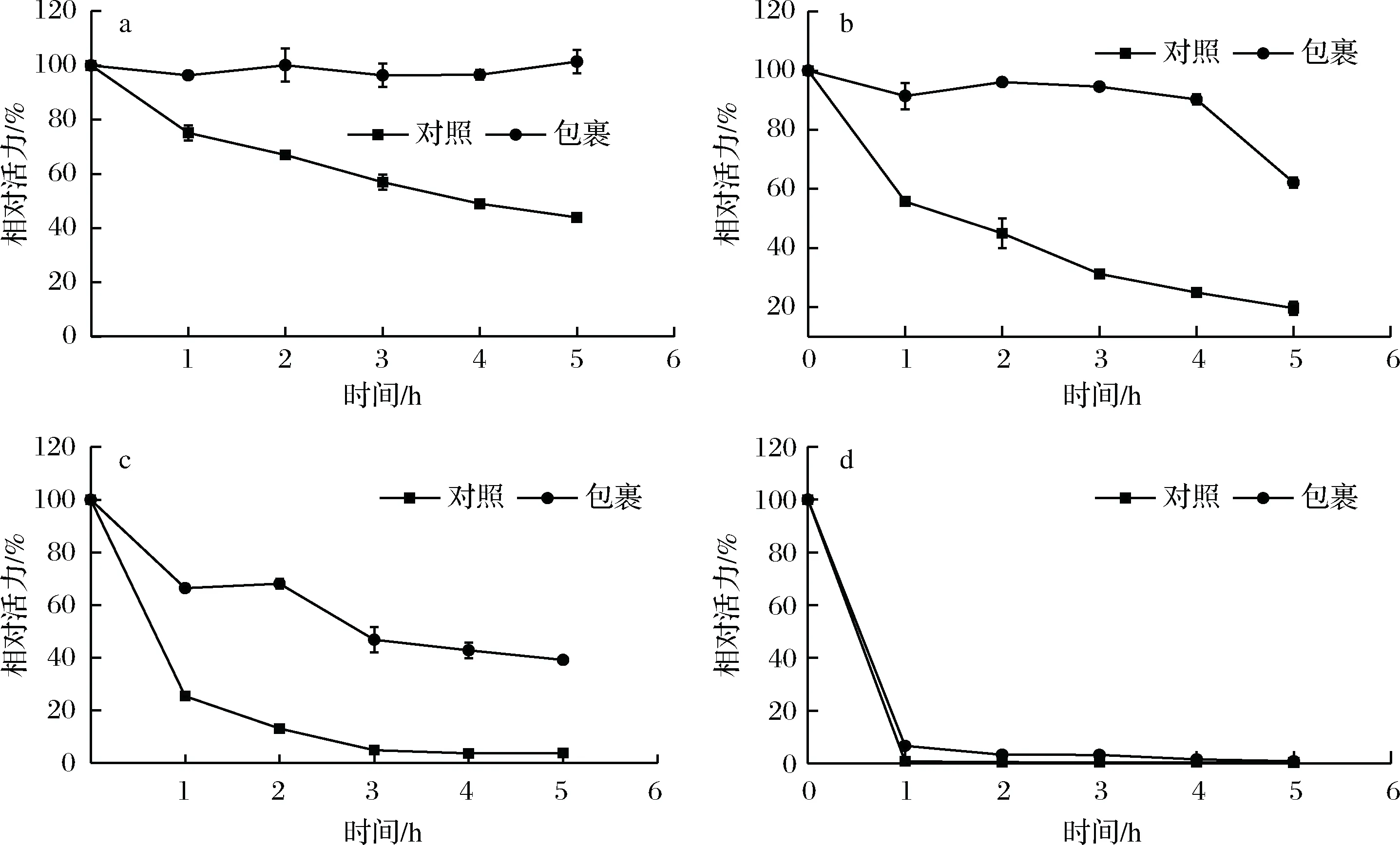
a-20℃;b-25℃;c-30℃;d-37℃

