阿帕替尼联合TACE治疗肝细胞肝癌合并门静脉癌栓的临床疗效*
王瑞亭, 袁国盛
南方医科大学南方医院 1感染管理科, 2感染内科肝脏肿瘤中心(广东广州 510515)
我国肝细胞肝癌(hepatocellular carcinoma, HCC)的发病率和病死率在恶性肿瘤中居前3位,华南尤其突出,较多年份窜升至恶性肿瘤的第2位甚至首位[1-2]。其5年总体生存率仅有11%左右,严重威胁人民生命健康。对于中晚期HCC患者,由于肿瘤的快速增殖、肝内转移和扩散等,往往错失了手术治疗的最佳时机而不能获得理想的治疗结局,尤其对于合并门静脉癌栓(portal vein tumor thrombus, PVTT)的患者[3]。此外,若得不到有效的治疗,PVTT患者的中位生存期仅有2~4个月[4]。研究表明,经肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是目前临床上治疗PVTT患者最为有效的非手术治疗方式,被推荐为中晚期HCC患者的优选治疗方案[5-6]。然而,TACE在阻断肿瘤组织血供的同时,也增加了肿瘤血管再生及形成侧支循环的风险,导致其治疗效果并不十分理想[7]。因此,有必要探索一种新的联合方案,在TACE术后减少血管再生,以期达到更好的控制肿瘤复发的效果。阿帕替尼是近年来由我国自主研发的一种小分子酪氨酸激酶抑制剂,可高度抑制血管内皮生长因子-2(vascular endothelial growth factor-2, VEGF-2)活性,从而抑制血管生成,延缓肿瘤复发,并于2014年获得国家食品药品监管局(CFDA)批准上市,应用于胃腺癌的三线治疗[8]。在治疗肝癌的Ⅱ期临床研究中[9],阿帕替尼已被证实可有效改善肝癌患者的临床预后(应答率约为5%),但目前仍然缺乏阿帕替尼应用于治疗PVTT患者的临床数据。因此,本研究拟通过比较阿帕替尼联合TACE与单纯TACE治疗HCC合并PVTT患者的临床疗效及安全性,为PVTT患者的临床治疗提供新的依据及思路。
1 资料与方法
1.1 一般资料 回顾性收集2015年6月至2017年6月期间就诊于南方医科大学南方医院合并PVTT的HCC患者的临床资料,并根据治疗方式分成两组:阿帕替尼联合TACE组与TACE组。所有患者肝癌的诊断及分期均参照2001年中国抗癌协会肝癌专业委员会修订的《原发性肝癌的临床诊断与分期标准》[10]及原发性肝癌诊疗规范(2017年版)[11]。根据既往报道,PVTT分为3种类型:(1)A型为门静脉主干的PVTT;(2)B型为一级门静脉分支(右侧或左侧门静脉)的PVTT;(3)C型为二级及以下门静脉分支的PVTT。
本研究最终纳入统计分析的病例共73例,其中阿帕替尼联合TACE组共32例,男19例(59.4%)、女13例(40.6%);TACE组共41例,男28例(68.3%)、女13例(31.7%)。两组患者各项基线指标比较差异均无统计学意义(P>0.05),具有可比性,见表1。
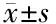
项目阿帕替尼联合TACE组(n=32)TACE组(n=41)P值性别[例(%)]0.430 男19(59.4)28(68.3) 女13(40.6)13(31.7)年龄(岁)50.0±12.350.0±12.80.820ECOG评分[例(%)]0.116 0分67(78.8)90(87.4) 1~2分18(21.2)13(12.6)Child-Pugh分级[例(%)]0.422 A级28(87.5)33(80.5) B级4(12.5)8(19.5)ALT(U/L)43.2±24.443.2±42.80.061AST(U/L)47.9±37.743.5±33.90.212PLT(×109·L-1)168.8±78.7174.5±63.00.605PT(s)12.7±1.012.9±1.40.068总胆红素(mmol/L)20.7±10.518.1±8.20.064白蛋白(g/L)37.3±4.836.8±3.90.169AFP[例(%)]0.191 ≥400 ng/mL22(68.8)22(53.7) <400 ng/mL10(31.2)19(46.3)PVTT位置[例(%)]0.773 C型5(15.6)6(14.6) B型20(62.5)23(56.1) A型7(21.9)12(29.3)HBV DNA阳性[例(%)]0.213 是19(59.4)30(73.2) 否13(40.6)11(26.8)肿瘤数量[例(%)]0.086 单发4(12.5)12(29.3) 多发28(87.5)29(70.7)肿瘤最大径[例(%)]0.114 <7 cm5(15.6)13(31.7) ≥7 cm27(84.4)28(68.3)
1.2 病例入选与排除标准
1.2.1 入组标准 依据巴塞罗那临床肝癌分期体系[12]分期为中晚期(B/C期);Child-Pugh分级为A级或者B级;ECOG评分不超过2分;根据mRECIST评价标准[13]影像学上至少可见到一个可测量病灶,用于实体瘤评价;影像学证实PVTT;患者均同意并签署知情同意书。
1.2.2 排除标准 曾经接受过射频消融术或肝移植;曾接受过索拉非尼治疗、全身化疗;存在严重的基础性疾病,如心脏病、严重肾功能不全、感染者等;难以控制的高血压;30 d内有大手术或消化道出血者;妊娠;Child-Pugh分级C级。
1.3 治疗方法
1.3.1 TACE手术方法 经股动脉穿刺插管成功后,注入碘海醇造影,明确肿瘤血供、性质、数目、大小等;经导管依次洛铂[海南长安国际制药有限公司]50 mg、盐酸表柔比星[辉瑞制药(无锡)有限公司]30 mg 及碘化油(Laboratorie Guerbet)3种药物的混合剂通过导管注入到供养动脉内,同时采用Embosphere微粒球对给予病灶肿瘤供养的动脉血管进行栓塞。术后常规给予止吐、抑酸、护肝等对症治疗。
1.3.2 阿帕替尼治疗方案 患者在结束TACE术后的第3~5天开始口服甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司)。首次服用剂量为400 mg/次,1次/d,于饭后30 min温水送服;起始剂量连续服用1周后若患者无任何不良反应则相应加大剂量至500 mg/次,1次/d;如患者服药后产生严重不良反应,应将服用剂量减至250 mg/次,1次/d。再次进行TACE治疗前4 d停止用药,术后第3~5 d重新开始服药。
1.4 观测指标及疗效评估 (1)所有患者均于TACE治疗后1个月行上腹部增强CT,根据mRECIST标准对肿瘤的控制情况进行疗效评价:①完全缓解(complete response,CR),所有靶病灶均无动脉期增强;②部分缓解(partial response,PR),靶病灶增强扫描动脉期的直径总和缩小不低于30%;③疾病进展(progressive disease,PD),动脉增强期,靶病灶直径比原始水平至少增大20%,或有新生病灶;④疾病稳定(stable disease,SD),靶病灶的缩小直径既未达到PR标准,增大程度亦未达到PD标准。客观缓解率=(完全缓解人数+部分缓解人数)/总患者数×100%。(2)生存期定义为患者自治疗开始至末次随访或死亡的时间。

2 结果
2.1 治疗后两组患者的不良反应 两组患者在TACE后出现不同程度的栓塞后综合征,但差异无统计学意义(P>0.05)。阿帕替尼相关并发症如手足皮肤反应、高血压、蛋白尿、腹泻的发生率,两组比较差异有统计学意义(P<0.05)。两组并发症给予对症处理后均缓解。见表2。
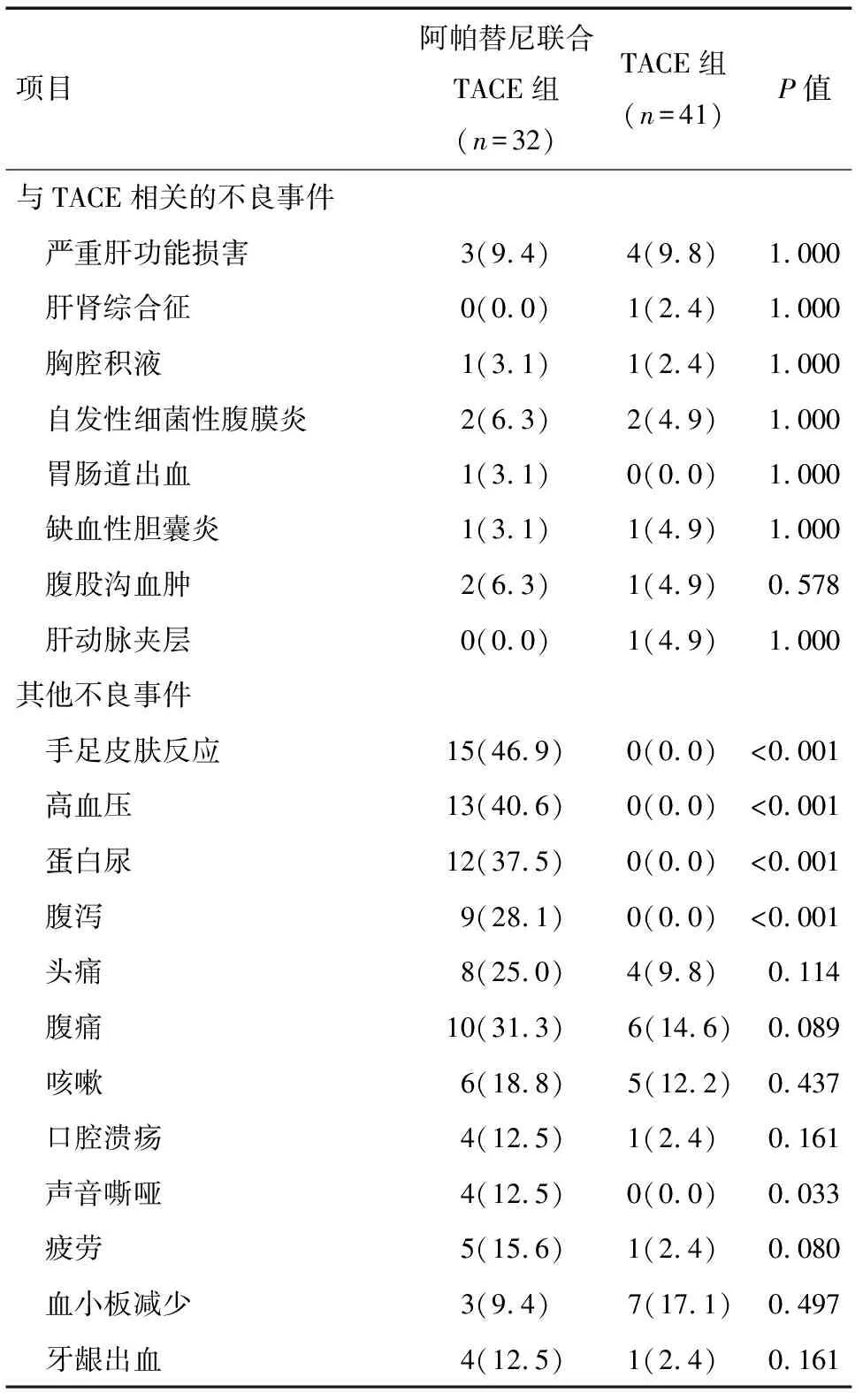
表2 两组患者随访过程中的不良事件分析 例(%)
2.2 两组患者肿瘤控制情况的比较分析 阿帕替尼联合TACE组的总客观缓解率显著高于TACE组(71.9%vs. 41.5%),差异有统计学意义(P=0.038)。亚组分析结果显示,阿帕替尼联合TACE组中B型和C型PVTT患者的客观缓解率分别为75.0%和80.0%,均显著高于TACE组的43.4%及50.0%(P<0.05);而两组A型PVTT患者的客观缓解率比较则差异无统计学意义(P=0.181)。见表3。
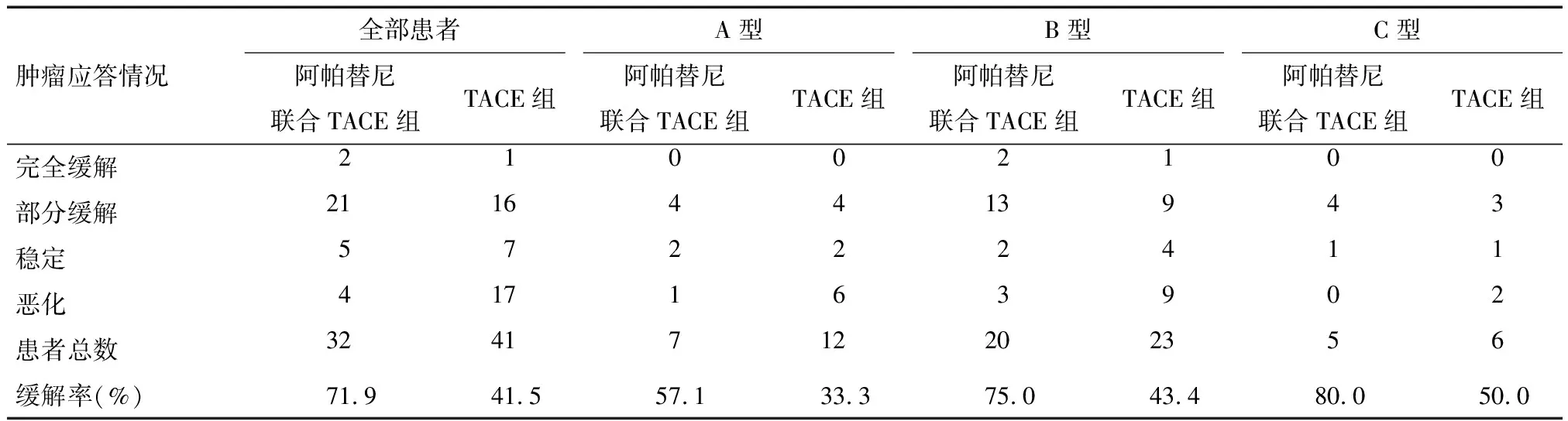
表3 两组患者按不同门静脉癌栓分类后的mRESIST评价结果 例
2.3 两组患者中位生存期的计算及生存曲线比较 所有患者的中位生存时间为10.56个月;其中阿帕替尼联合TACE治疗组的中位生存时间为13.69个月,95%置信区间(10.57个月,16.80个月);TACE治疗组的中位生存时间为7.94个月,95%置信区间(6.47个月,9.41个月),两组间的比较差异有统计学意义(2=10.077,P=0.002)。
亚组分析结果显示,阿帕替尼联合TACE组中B型和C型PVTT患者的中位生存时间分别为13.06个月和25.00个月,均显著高于TACE组(分别为8.36个月和9.34个月,均P<0.05)。而两组A型PVTT患者的中位生存时间分别为6.23个月和6.06个月,差异无统计学意义(2=0.796,P=0.372)。见表4、图1。
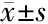
项目全部患者Type AType BType C阿帕替尼联合TACE组TACE组阿帕替尼联合TACE组TACE组阿帕替尼联合TACE组TACE组阿帕替尼联合TACE组TACE组中位生存时间(月)13.697.946.236.0613.068.3625.009.3495%CI10.57~16.806.47~9.415.08~7.394.06~8.059.94~16.186.66~10.0725.00~25.003.96~14.72Chi-square10.0770.7965.5705.310P值0.0020.3720.0180.021
3 讨论
肝脏是“沉默”的器官,临床中发现的肝癌患者大多没有明显的早期临床症状,确诊时早已发展到中晚期,因而丧失了手术治疗的最佳时机,给患者家庭带来十分严重的影响[14]。HCC极易侵犯门静脉,往往伴发PVTT,后者不仅与肝内转移以及复发有着密切的关系,而且还导致肝硬化患者出现门静脉高压,进而出现一系列的上消化道出血、腹腔积液等顽固疾症,严重者可引发肝功能衰竭。如果得不到有效的治疗,患者的中位生存期仅有2~4个月[4]。然而,目前对于PVTT的治疗,尚无统一的最佳治疗方案。研究表明对HCC合并PVTT行TACE可在一定程度提高患者的生存率,然而,效果有限[3-4, 15-16]。本研究通过回顾性收集2015年6月至2017年6月期间就诊于南方医科大学南方医院合并PVTT的HCC患者的临床资料,比较了阿帕替尼联合TACE方案与单纯TACE方案治疗不同类型PVTT患者的临床疗效及安全性。
国内外多项研究证实,TACE术后诱发的肿瘤内部缺血、缺氧致使VEGF表达升高,有助于提高新生血管生成及其稳定性,与肿瘤复发转移关系密切[4, 16-18]。阿帕替尼通过高度竞争性抑制VEGFR-2的ATP结合位点,抑制肿瘤血管生成。无论在体内还是体外实验阿帕替尼均显示了出色的抑癌作用[19-21]。本研究的一项重要发现是,对于无法手术切除的HCC合并PVTT患者,与单纯TACE治疗比较,阿帕替尼联合TACE方案可有效提高肿瘤应答率,并延长患者的中位生存时间,且B型与C型PVTT患者疗效更佳。与我们的结果基本一致,Lu等[22]的报道同样提示阿帕替尼联合TACE方案可有效提高抗肿瘤效果,可为中晚期肝癌患者提供新的治疗选择。该方案可提高疗效的可能原因是两者联合可能起协同作用。阿帕替尼是一种新型小分子抗血管生成制剂,是VEGFR-2的抑制剂,可高度选择性地结合VEGFR-2,竞争性抑制VEGF与VEGFR-2结合,抑制肿瘤血管生成,从而抑制肿瘤细胞增殖,达到抗肿瘤作用。
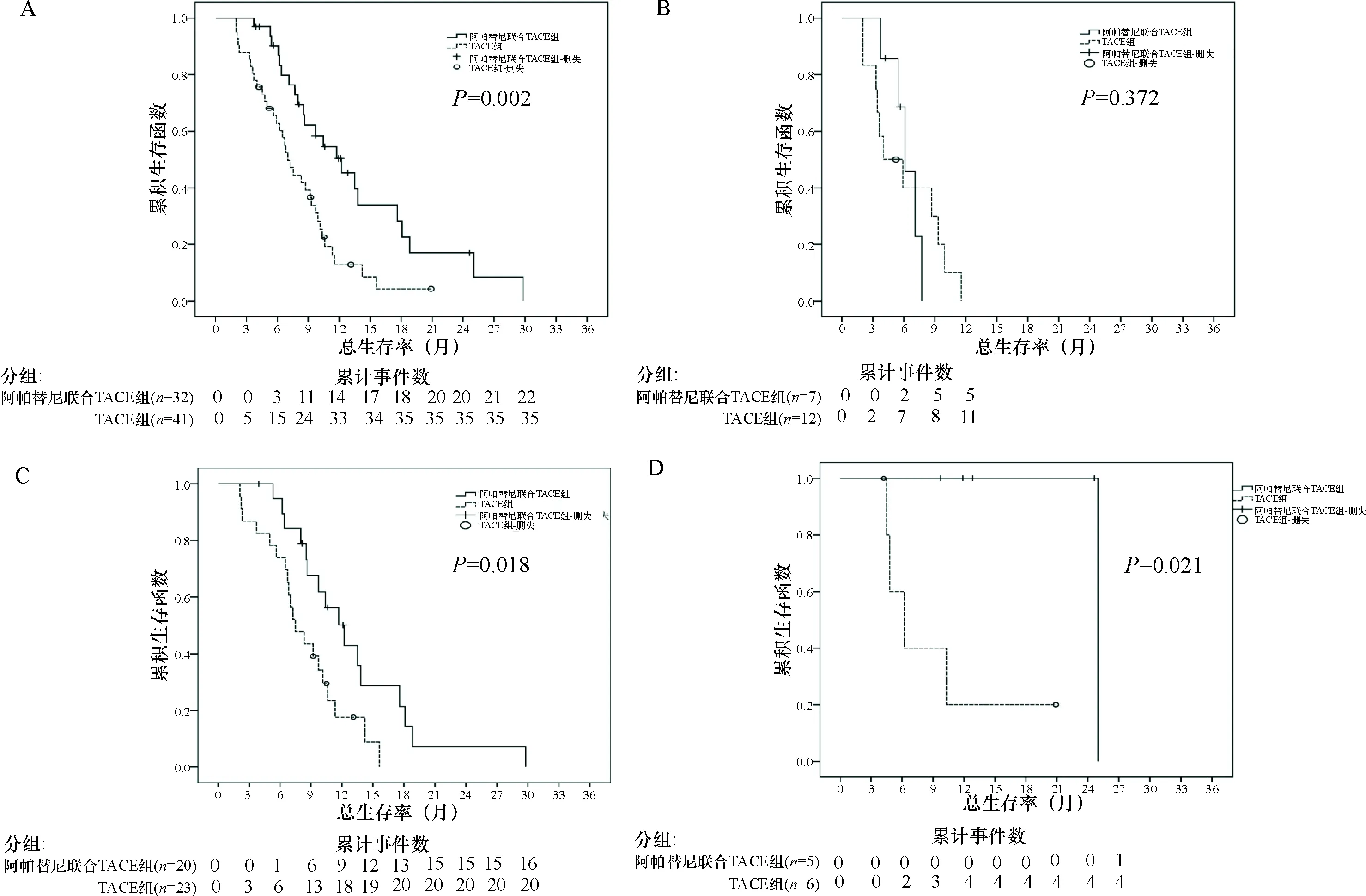
注:A:所有患者间的比较;B:A型PVTT,即门静脉主干癌栓患者;C:B型PVTT,即一级门静脉分支癌栓患者;D:C型PVTT,即二级及以下门静脉分支癌栓患者
图1两组生存曲线比较
TACE术后由于坏死物质吸收及栓塞中使用化疗药物等可导致肾功能损害、肝肾综合征、出血等不良事件的发生。本研究联合治疗组与单纯TACE组中与TACE相关的不良事件发生率相近,主要为肝功能损害、自发性细菌性腹膜炎和腹股沟血肿。与既往报道一致[23-24],本研究中阿帕替尼不良事件发生率前3位为手足皮肤反应、高血压及蛋白尿,且通过给予对症处理后均缓解。
综上所述,对HCC合并PVTT,尤其是未累及门静脉主干(B型及C型)的患者应用阿帕替尼联合TACE治疗,可有效延长生存期,且安全性较高,值得临床进一步推广和应用。

