人参皂苷Rg1、Rb1抗转基因斑马鱼模型的Aβ血管损害作用*
刘南海, 黄晓峰, 符雪涛, 王振凤, 薛寿儒△, 杨凯
1赣南医学院第二附属医院神经内科(江西赣州 341600); 赣南医学院 2护理学院, 4研究生院, 5药学院(江西赣州 341000); 3苏州大学附属第一医院神经内科(江苏苏州 215000)
β-淀粉样蛋白(Aβ)是一种导致阿尔茨海默病(AD)和老年斑的重要组成成分之一,主要在大脑内富集,会引起神经元纤维缠结以及由凋亡引起的区域性神经细胞死亡[1]。同时对脑血管造成较大的损伤[2]。AD发病机制“Aβ瀑布理论”认为“Aβ在脑组织中的沉积是脑神经元变性及痴呆的起始事件”,Aβ在脑组织中沉积减少,或防治Aβ对脑神经元及血管的损害,则可以起到延缓及减轻AD发生与进展的作用。包括基因学在内的诸多方面的证据有力佐证该理论,并得到了大多数学者专家的认可[3]。人参皂苷是一种名贵药材,其有效成分包括:人参皂苷Ra1、Ra2、Ra3、Rb1、Rb2等[4]。人参皂苷具有较好的抗氧化、抗细胞凋亡、提高免疫力、减少细胞肿胀等作用[5]。有学者发现了人参皂苷可以有效减轻肾、脑等脏器缺血再灌注损伤,同时能有效地保护神经系统[6-7]。本课题组的前期研究中也观察到人参果皂苷对神经的保护作用[8]。王永生等[9]发现了人参皂苷Rg1对1-甲基-4-苯基-1,2,3,6四氢吡啶MPTP诱导的急性帕金森病小鼠中脑黑质的神经保护作用。有研究表明,人参皂苷Rg1通过增强缺氧诱导因子-1(HIF-1)和血管内皮生长因子(VEGF)的表达,促进血管新生,减少心肌纤维化,保护心脏,可能涉及PI3K/Akt信号通路和抑制p38MAPK信号通路[[10]。但人参皂苷Rg1、Rb1对Aβ诱导的血管损伤是否有保护作用,最终起到延缓AD的发生与进展,尚未知晓。斑马鱼是脊椎动物,有独立的组织器官,其器官与人器官在结构、生理、分子水平等方面惊人地相似。斑马鱼容易大规模饲养,雌鱼每周产卵1次,每次有几百个。Flk-GFP转基因斑马鱼是一种在血管内皮细胞表面表达GFP的转基因整体模型,可以在多孔板中观察斑马鱼胚胎的血管生成发育过程,从而能直接地研究血管形成过程和形状的调控。2016年1月至2019年6月,本研究以转基因斑马鱼为模型,探讨人参皂苷Rg1、Rb1抗Aβ血管损害作用,以期了解人参皂苷Rg1、Rb1对Aβ血管损害保护作用机制,从而为AD的防治探索新的路径。
1 材料与方法
1.1 实验动物 实验斑马鱼血管荧光转基因斑马鱼(Flk-1)由美国哈佛大学医学院提供。
1.2 试剂与仪器 人参皂苷Rg1、Rb1(货号:GD-GSJ125-585;纯度>98%)购自上海古朵生物科技有限公司;胱甘肽过氧化物酶(GSH-Px)、活性氧(ROS)试剂盒子购自上海恒远生物科技有限公司;超氧化物歧化酶(SOD)试剂盒子购自上海抚生科研有限公司;Aβ、蛋白酶购自美国Sigma公司;Smad2、Smad3抗体均购自Cell Signaling Technology公司;VEGF抗体购自Santa Cruz 公司;转化生长因子-β1(TGF-β1)试剂盒购自武汉默沙克生物科技公司;光学显微镜购自东莞市同创仪器有限公司。
1.3 方法
1.3.1 建立模型 参考斑马鱼饲养手册[11]将健康成熟的斑马鱼按雌雄1∶2的比例放入交配鱼缸中,次日搜集雄鱼雌鱼交配产下的受精胚胎,选取健康的胚胎,使用1 mg/mL的蛋白酶水解去卵膜,取1 g Aβ溶解到20 mL蒸馏水中,使用胚胎水稀释成25 g/L后灭菌,使用受精20 h的斑马鱼胚胎将配置好的Aβ溶液加入到培养基中每孔20 μL,放在28.5℃的孵箱中继续培养48 h。
1.3.2 分组及药物干预 配置20 mg/L的人参皂苷Rg1和人参皂苷Rb1溶液,将孵育出的人参皂苷Rg1组和人参皂苷Rb1组斑马鱼放入该药物溶液中处理8 d,对照组和模型组不使用人参皂苷药物。
1.3.3 检测项目
1.3.3.1 血管长度和血管面积测量 使用20×20倍数显微镜对斑马鱼肠下血管进行拍照,使用Image-pro-plus 6.0对血管面积以像素为剂量单位进行定量分析。使用NIH Image图像处理软件对斑马鱼血管长度进行测量。
1.3.3.2 SOD、GSH-Px检测 建立模型并使用药物干预完成后24 h,腹主动脉取血分离血清,保存在-20℃条件下待测,按照试剂盒说明书检测SOD、GSH-Px含量。
1.3.3.3 Western blot检测蛋白表达水平 处死斑马鱼,灌注固定后取动脉血管组织样本,使用10%SDS-聚丙烯酰胺凝胶电泳提取总蛋白,半干法将蛋白转移到PVDF膜,置于5%脱脂奶粉室温封闭2 h后加入各需要检测蛋白的一抗、二抗,孵育2 h,以β-actin为内参蛋白,采用显色液显色后行吸光度分析,计算各蛋白相对表达量。
1.4 统计学方法 采用 SPSS 22.0统计软件,作图软件采用GraphPda Prism5,方差分析使用单因素方差分析,使用单因素方差分析时,以P<0.05为差异有统计学意义。
2 结果
2.1 各组血管长度和血管面积比较 与对照组比较,模型组斑马鱼血管长度显著缩短(P<0.05);与模型组相比,人参皂苷Rg1组和人参皂苷Rb1组斑马鱼血管长度均显著增加(P<0.05)。与对照组比较,模型组斑马鱼血管面积显著减少(P<0.05);与模型组相比,人参皂苷Rg1组和人参皂苷Rb1组斑马鱼血管面积显著增加(P<0.05),见表1、图1。
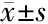

项目n血管长度(μm)血管面积(像素)对照组151 120.32±70.64 16 086.01±4 520.32 模型组15850.11±45.21∗12 045.32±2 514.88∗人参皂苷Rg1组151 025.74±25.16△15 002.21±3 689.64△人参皂苷Rb1组151 075.25±29.88△15 302.23±3 583.18△F值6.5410.239P值<0.0010.869
注:*与对照组比较P<0.05;△与模型组比较P<0.05

注:A:斑马鱼血管长度;B:斑马鱼血管面积;*与对照组比较P<0.05;△与模型组比较P<0.05
2.2 各组ROS、SOD、GSH-Px水平比较 与对照组比较,模型组斑马鱼SOD和GSH-Px水平显著降低(P<0.05),ROS水平显著升高(P<0.05);与模型组比较,人参皂苷Rg1组和人参皂苷Rb1组斑马鱼ROS水平显著降低,SOD和GSH-Px水平显著升高(P<0.05),见表2、图2。
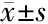

项目nROS(U/mL)SOD(U/mL)GSH-Px(U/mL)对照组151.90±0.122.25±0.15142.20±10.11模型组155.75±0.57∗0.90±0.10∗57.50±7.54∗人参皂苷Rg1组153.75±0.49△1.90±0.11△132.21±8.21△人参皂苷Rb1组153.81±0.27△1.55±0.35△123.12±7.52△F值227.352119.09327.280P值<0.001<0.001<0.001
注:*与对照组比较P<0.05;△与模型组比较P<0.05

注:A:各组SOD水平比较;B:各组ROS水平比较;C:各组GSH-Px水平比较;*与对照组比较P<0.05;△与模型组比较P<0.05
图2各组ROS、SOD、GSH-Px水平比较
2.3 各组相关蛋白比较 与对照组比较,模型组斑马鱼VEGF蛋白表达水平显著降低(P<0.05),TGF-β1、Smad2、Smad3蛋白表达水平显著升高(P<0.05);与模型组比较,人参皂苷Rg1组和人参皂苷Rb1组斑马鱼VEGF蛋白表达水平显著升高(P<0.05),TGF-β1、Smad2、Smad3蛋白表达水平显著降低(P<0.05),见表3、图3。
3 讨论
AD是一种进行性记忆受损及认知功能障碍为主要特征的神经系统慢性退行性疾病,病变损伤与认知功能关系密切的脑区,最常见部位包括颞叶内侧,尤其是海马部位、顶叶和额叶。有不少学者利用质子磁共振波谱技术对AD及认知功能障碍进行早期诊断[12],但是AD发病机制方面的研究尚未取得突破性进展,AD的防治仍是亟待解决的重大课题。近些年来,许多研究者在AD动物模型及AD患者中发现脑血管功能障碍与AD发病的密切关系,认为脑内血管功能的异常导致Aβ清除能力降低并加重神经元的功能损害,进而导致AD的发病与病情的进展[13-14]。
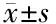

项目nVEGFTGF-β1Smad2Smad3对照组151.69±0.150.47±0.160.55±0.220.76±0.25模型组150.38±0.18∗1.69±0.18∗1.59±0.25∗1.57±0.19∗人参皂苷Rg1组151.37±0.16△1.22±0.17△1.04±0.26△1.33±0.21△人参皂苷Rb1组151.49±0.18△0.98±0.18△0.86±0.25△1.24±0.18△F值285.277 307.811 142.316 103.504P值<0.001<0.001<0.001<0.001
注:*与对照组比较P<0.05;△与模型组比较P<0.05

注:*与对照组比较P<0.05;△与模型组比较P<0.05
人参皂苷Rg1、Rb1是从人参根茎中提取的水溶性成分。向玥等[15]研究表明,人参皂苷Rg1、Rb1对氧化物的产生具有抑制作用,可以有效缓解氧化应激损伤。同时邱咏园等[16]研究证明,人参皂苷Rg1、Rb1制氧自由基的产生和清除氧自由基。Aβ在血管内会发生化学反应使得血管局部产生单态氧,进而损伤血管内皮,活化白细胞和血小板进而活化纤维蛋白原,形成血栓并破坏血管甚至导致血管的硬化和破裂[17-18]。ROS 的大量堆积是导致氧化应激损伤的重要机制之一[19-20]。有研究表明,在健康的细胞内氧自由基的产生和清除是平衡的,但是在氧化应激情况下,会产生大量的ROS并破坏线粒体膜和细胞膜的完整性,使上皮细胞膜的通透性增加,导致细胞内酶SOD、GPX等酶的大量释放[21]。因此,ROS 损伤被认为是引起细胞氧化损伤的主要机制。抗氧化体系主要包括酶系和非酶系两大类,酶体系中,最主要的是SOD,其含量多少可以直接反应氧化应激的程度[22]。本研究中发现,相比对照组,模型组斑马鱼SOD和GSH-Px水平显著降低,ROS水平显著升高。说明模型组斑马鱼血管内皮氧化应激较为严重,其血管损伤严重。使用人参皂苷Rg1和Rb1处理后,斑马鱼ROS水平显著降低,SOD和GSH-Px水平显著升高说明斑马鱼血管内氧化应激得到了显著的抑制。这可能是因为人参皂苷Rg1和Rb1中存在抗氧化物质,这种抗氧化物质可以降低提升氧化酶活力,提高了斑马鱼机体的抗氧化能力,并抑降低细胞膜的通透性,抑制细胞内酶SOD、GPX等酶的大量释放到细胞外导致血管内皮的损伤。陈洪娜等[23]研究表明,抑制血管内的氧化应激及炎症反应可以有效降低血管的损伤,与本研究得出的结论相一致。
TGF-β1家族可以通过调控细胞的增殖、凋亡及炎症反应缓解血管损伤,同时TGF-β1活化能够促进多种疾病的产生和发展,其中包括血管疾病及多种器官的渐进性纤维化等[24]。Smads家族是TGF-β1家族的下游基因,目前发现的Smads家族蛋白有9种,Smad1~9,其中Smad2和Smad3可以被其上游的TGF-β1家激活,刺激血管平滑肌细胞的增殖、迁移及纤连蛋白的合成[25]。本研究发现,相比对照组,模型组斑马鱼VEGF蛋白表达水平显著降低,TGF-β1、Smad2、Smad3蛋白表达水平显著升高,说明斑马鱼血管的增殖受到了Aβ的抑制,导致其增殖及发育的不完全。同时研究中也发现,相比对照组,模型组斑马鱼血管长度显著降低,也证明了Aβ可以抑制血管的生长及发育,并导致其萎缩。使用人参皂苷Rg1和人参皂苷Rb1处理后斑马鱼VEGF蛋白表达水平显著升高,TGF-β1、Smad2、Smad3蛋白表达水平显著降低。说明血管的生长受到了显著的促进。这可能是因为TGF-β1/Smads信号通路蛋白主要表达于新生内膜处,通过该通路对血管内膜的增殖有一定的促进作用,并使得血管平滑肌增殖,防止Aβ导致的血管萎缩及发育不良。研究表明,人参皂苷Rg1和人参皂苷Rb1可以通过调节TGF-β1/Smads信号通路达到调节血管内平滑肌的增殖的作用。
综上所述,人参皂苷Rg1和人参皂苷Rb1可以减轻Aβ导致的损伤,有效保护血管,其作用机制可能与降低氧化应激和调节TGF-β1/Smads信号通路促进血管内平滑肌的增殖和血管的发育有关。加之人参皂苷Rg1和人参皂苷Rb1具有较好的神经保护作用,故有可能成为防治AD发病与进展一条新的途径。本研究涉及到的模型样本数量较少,在后期的研究中将进一步增加研究的样本数量并增加人参皂苷中国不同的有效成分,设置更多浓度梯度进行对比。

