糖尿病肾病患者血清Klotho蛋白水平与血管病变的相关性
丁浩, 危志强, 蔡小琴, 李海涛, 章旭, 曹娟
蚌埠医学院附属泰兴市人民医院肾内科(江苏泰兴 225400)
糖尿病肾病(diabetic kidney disease,DKD)已成为慢性肾脏病(chronic kidney disease,CKD)及终末期肾功能衰竭(end stage renal disease,ESRD)患者的重要病因[1]。血管内皮功能紊乱是DKD患者的常见并发症,以大血管和微血管病变为特征,影响多个器官,导致DKD患者的心血管发病率和病死率升高[2]。冠心病(coronary heart disease,CHD)、脑血管意外(cerebrovascular accident,CVA)及外周动脉闭塞性疾病(peripheral artery occlusive disease,PAOD)等大血管病变和视网膜病变、神经病变等微血管病变均可导致不良预后[1]。因此,对血管病变的早期干预、发现血管病变的早期生物标志物,具有十分重要的意义。Klotho蛋白是由人类Klotho基因编码的跨膜蛋白,主要在肾脏和大脑中表达,参与机体的衰老及对胰岛素敏感性调控,在一氧化氮生成和高磷血症的调控中起重要作用[3]。既往的研究表明,小鼠Klotho蛋白缺乏可导致多种疾病,包括动脉粥样硬化、血管钙化、中风、骨质疏松症、异位钙化、皮肤萎缩、慢性血管疾病、寿命缩短以及不育[3-5]。最近的研究表明,高水平的Klotho蛋白可降低代谢综合征、肾脏疾病和心血管疾病的风险[6-7]。然而, Klotho蛋白与DKD患者血管病变的相关性尚不清楚,因此,本研究通过检测DKD患者血清Klotho蛋白水平,探讨血清Klotho蛋白水平与血管病变的相关性,为减少DKD患者心血管事件提供新的治疗方法。
1 资料与方法
1.1 一般资料 经医院伦理委员会批准。选取2013年1月至2014年6月间在我院肾内科住院,临床诊断为DKD的患者,共124例,跟踪随访5年,在随访期间,由于死亡(10例)或失访(6例),共108例患者成功完成本研究。其中,男64例,女44例,年龄(56.2±10.1)岁。排除标准:(1)年龄<18周岁或>70周岁;(2)血压控制欠佳、妊娠、肝硬化的患者;(3)入组前近3个月内有感染;(4)其他严重疾病:如恶性肿瘤、严重营养不良、精神疾病等。
1.2 研究方法
1.2.1 收集入组患者的临床资料 收集患者年龄、性别、身高、体重、糖尿病史、高血压病史、吸烟史、既往血管病变史、收缩压、舒张压、用药情况等。跟踪随访5年,记录每年相关临床资料、实验室检查及血管病变评估结果。
1.2.2 实验室检查 收集空腹静脉血及中段晨尿标本, 检测血红蛋白(Hb)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、三酰甘油(TG)、血尿素氮(BUN)、血肌酐(Scr)、血糖(BG)、糖化血红蛋白(HbA1C)、胰岛素、C肽、超敏C反应蛋白(hs-CRP)及尿蛋白/肌酐比值(UACR),并计算肾小球滤过率(eGFR)、稳态模型胰岛素抵抗指数(HOMA-IR)。采用酶联免疫吸附法测定血清Klotho蛋白水平,根据Klotho蛋白数值将所有患者分为低Klotho蛋白组和高Klotho蛋白组。
1.3 血管病变评估 大血管病变以动脉粥样硬化为主要表现,主要侵犯冠状动脉、脑动脉、肢体动脉等,引起冠心病、脑血管病、肢体动脉硬化等疾病,本研究中以CHD、CVA、PAOD作为大血管病变进行评估;微血管病变的典型改变是微循环障碍和微血管基底膜增厚,主要表现在视网膜、肾、神经等组织,本研究中以视网膜病变、神经病变作为微血管病变进行评估。
1.4 相关定义及诊断
1.4.1 CHD 有临床表现和心电图检查或实验室检查确诊的心肌梗死、典型心绞痛和(或)冠状血管造影证实的冠状动脉疾病、曾接受经冠状动脉血管旁路移植术或经皮腔内血管成形术引起的急性冠脉综合征[8]。
1.4.2 CVA 根据临床症状或头颅CT、MRI等证实的缺血性或出血性脑血管疾患和短暂性局部脑缺血发作[9]。
1.4.3 PAOD 周围动脉硬化导致动脉狭窄,甚至发生闭塞,使远端组织出现相应缺血痉挛或坏死,临床表现为间歇性跛行、静息痛及坏疽等,本研究采用多普勒超声测量并计算踝臂指数(ABI)评估PAOD,ABI=足背或胫后动脉收缩压高者/最高肱动脉收缩压, PAOD被定义为ABI≤0.9或>1.3[10]。
1.4.4 视网膜病变及神经病变诊断 根据眼底检查的结果诊断视网膜病变[11]。根据神经测试的结果诊断出神经病变,包括针刺痛觉、温度觉、音叉振动觉、10-g单丝压力觉及踝反射[12]。
上述多普勒超声、眼底检查和神经测试至少每年进行1次,以评估PAOD、视网膜病变和神经病变;当有临床表现或依据时,进行CHD和CVA的相关检查。
2 结果
2.1 入组患者基线临床资料和实验室检查结果 根据血清Klotho蛋白中位数(610 pg/mL)将入组患者分为两组。高Klotho蛋白组患者的年龄、糖尿病史、视网膜病变比例、神经病变比例、TC、HDL-C、LDL-C、BUN、UACR、他汀类药物使用率显著高于低Klotho蛋白组患者,而男性比例、吸烟比例显著低于低Klotho蛋白组患者,差异有统计学意义(P<0.05,P<0.01)。见表1。
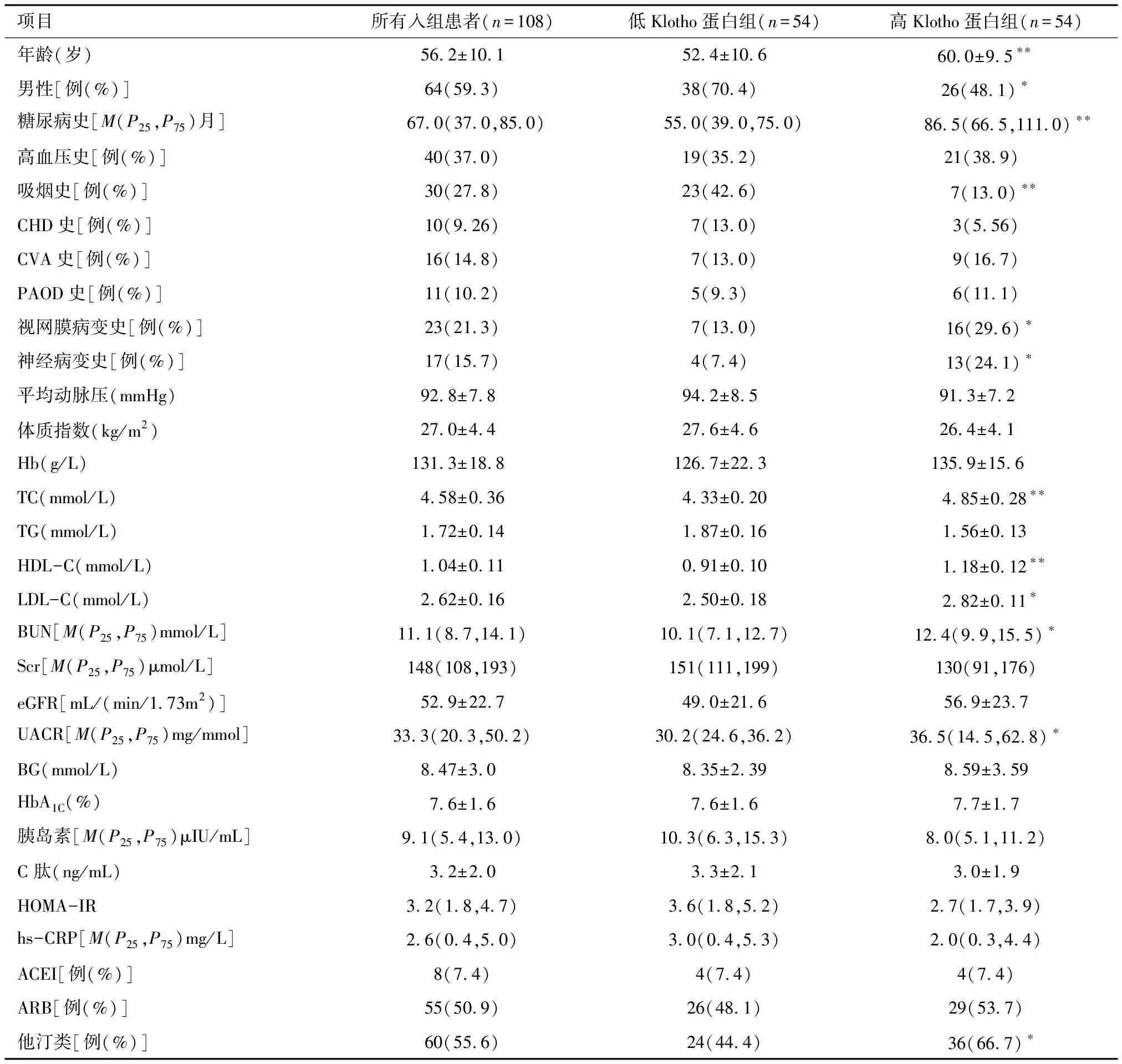
项目所有入组患者(n=108)低Klotho蛋白组(n=54)高Klotho蛋白组(n=54)年龄(岁)56.2±10.152.4±10.660.0±9.5∗∗男性[例(%)]64(59.3)38(70.4) 26(48.1)∗糖尿病史[M(P25,P75)月] 67.0(37.0,85.0) 55.0(39.0,75.0) 86.5(66.5,111.0)∗∗高血压史[例(%)]40(37.0)19(35.2) 21(38.9) 吸烟史[例(%)]30(27.8)23(42.6) 7(13.0)∗∗CHD史[例(%)]10(9.26)7(13.0)3(5.56)CVA史[例(%)]16(14.8)7(13.0)9(16.7)PAOD史[例(%)]11(10.2)5(9.3) 6(11.1)视网膜病变史[例(%)]23(21.3)7(13.0)16(29.6)∗神经病变史[例(%)]17(15.7)4(7.4) 13(24.1)∗平均动脉压(mmHg)92.8±7.8 94.2±8.5 91.3±7.2 体质指数(kg/m2)27.0±4.427.6±4.626.4±4.1Hb(g/L)131.3±18.8126.7±22.3135.9±15.6TC(mmol/L)4.58±0.364.33±0.20 4.85±0.28∗∗TG(mmol/L)1.72±0.141.87±0.161.56±0.13HDL-C(mmol/L)1.04±0.110.91±0.101.18±0.12∗∗LDL-C(mmol/L)2.62±0.162.50±0.182.82±0.11∗BUN[M(P25,P75)mmol/L]11.1(8.7,14.1)10.1(7.1,12.7)12.4(9.9,15.5)∗Scr[M(P25,P75)μmol/L]148(108,193)151(111,199)130(91,176)eGFR[mL/(min/1.73m2)]52.9±22.749.0±21.656.9±23.7UACR[M(P25,P75)mg/mmol]33.3(20.3,50.2)30.2(24.6,36.2)36.5(14.5,62.8)∗BG(mmol/L)8.47±3.0 8.35±2.398.59±3.59HbA1C(%)7.6±1.67.6±1.67.7±1.7胰岛素[M(P25,P75)μIU/mL]9.1(5.4,13.0)10.3(6.3,15.3)8.0(5.1,11.2)C肽(ng/mL)3.2±2.03.3±2.13.0±1.9HOMA-IR3.2(1.8,4.7)3.6(1.8,5.2)2.7(1.7,3.9)hs-CRP[M(P25,P75)mg/L]2.6(0.4,5.0)3.0(0.4,5.3)2.0(0.3,4.4)ACEI[例(%)]8(7.4)4(7.4)4(7.4)ARB[例(%)]55(50.9)26(48.1)29(53.7)他汀类[例(%)]60(55.6)24(44.4)36(66.7)∗
注:与低Klotho蛋白组比较 *P<0.05, **P<0.01
2.2 随访结果 在5年的随访期间,分别有10、13、5、5、29例患者出现CHD、CVA、PAOD、视网膜病变、神经病变的新发或病变进展。低Klotho蛋白组患者CHD、CVA的发生率显著高于高Klotho蛋白组患者,差异有统计学意义(P<0.05,P<0.01),见表2。低Klotho蛋白组患者的大血管病变发生率及1个靶器官损害发生率也显着高于高Klotho蛋白组患者,差异有统计学意义(P<0.01),见表3。
2.3 基线Klotho蛋白水平与血管病变的相关性 Spearman秩相关分析显示,Klotho蛋白水平与CHD(r=-0.232,P<0.01)和CVA(r=-0.223,P<0.01)呈负相关,与PAOD、视网膜病变和神经病变无相关性。见表4。
2.4 大血管病变的危险因素分析 单变量分析显示,低Klotho蛋白水平是发生大血管病变、CHD、CVA和PAOD的危险因素(表5)。进一步的多变量logistic回归分析显示,Klotho蛋白水平是大血管病变、CHD和CVA的预测因子(表6)。
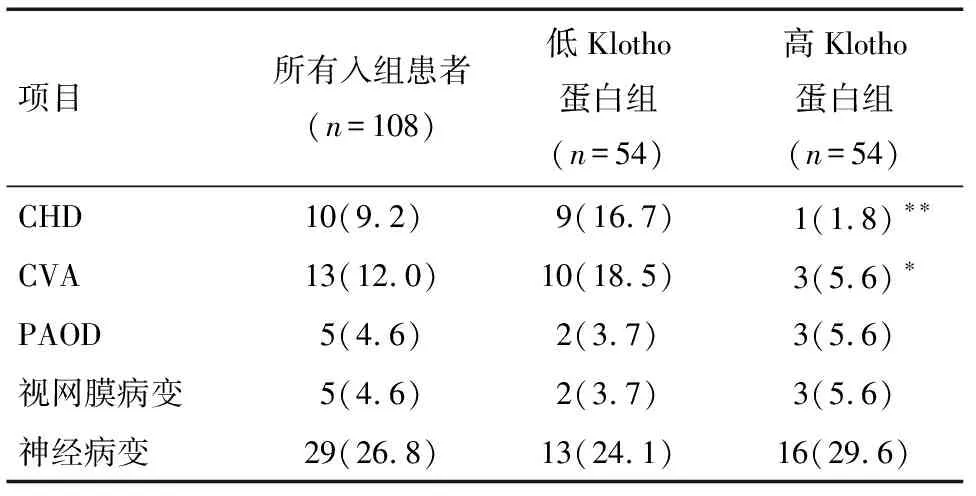
表2 5年随访期间血管病变的发生情况 例(%)
注:与低Klotho蛋白组比较*P<0.05,**P<0.01
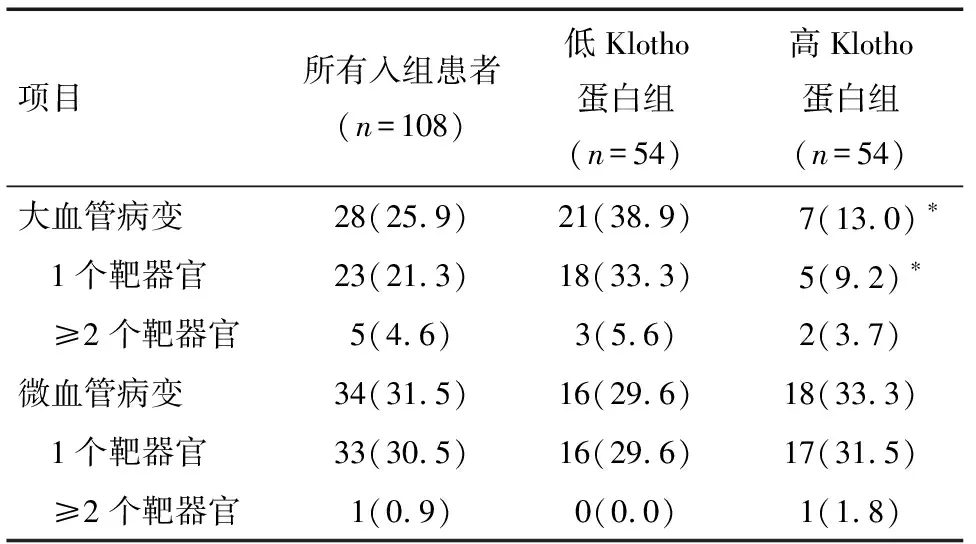
表3 靶器官损害情况 例(%)
注:与低Klotho蛋白组比较 *P<0.01
3 讨论
Klotho蛋白是一种单次跨膜蛋白,在肾脏中高表达,循环中的Klotho蛋白可以通过KlothomRNA选择性剪接后表达或膜型Klotho蛋白水解直接产生[13]。膜型Klotho蛋白可作为FGF23的共同受体发挥作用,而循环中的Klotho蛋白作为一种激素因子,在抗氧化、离子转运调节等过程中起重要作用[13-14]。近年来的研究发现,Klotho蛋白在2型糖尿病和DKD的发生发展中也起重要作用。Klotho蛋白能显著增加胰腺β细胞数量、胰岛素储存和分泌水平,显著增加糖尿病小鼠模型的血清胰岛素水平,从而发挥有益作用[15]。此外,小鼠β细胞特异性表达 Klotho蛋白可增加胰腺胰岛十二指肠同源盒1、增殖细胞核抗原和微管相关蛋白1A/1B轻链3的表达[15]。这些结果表明Klotho蛋白在β细胞的特异性表达可改善β细胞功能并减缓2型糖尿病和DKD的进展。

表4 Klotho蛋白水平与血管病变的相关性 r值
注:*P<0.01
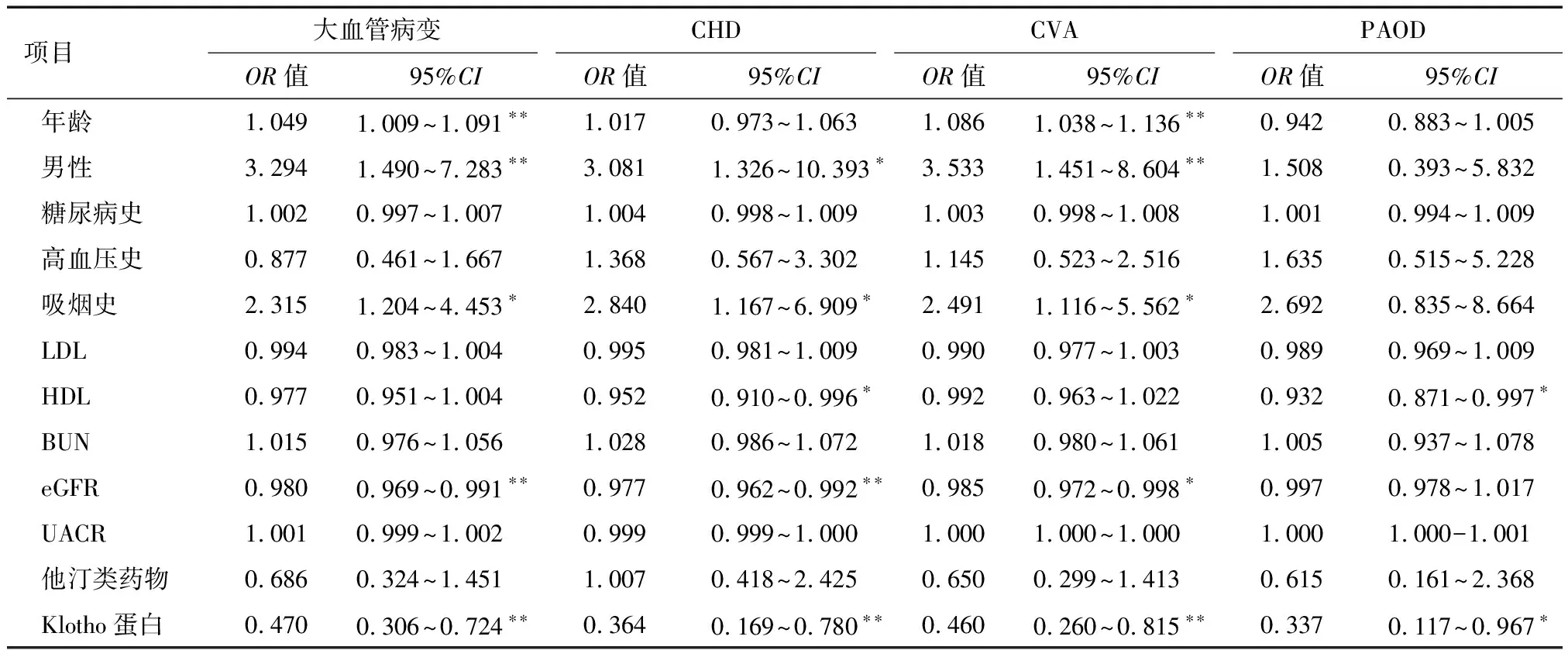
表5 发生大血管病变的单变量危险因素分析
注:*P<0.05,**P<0.01
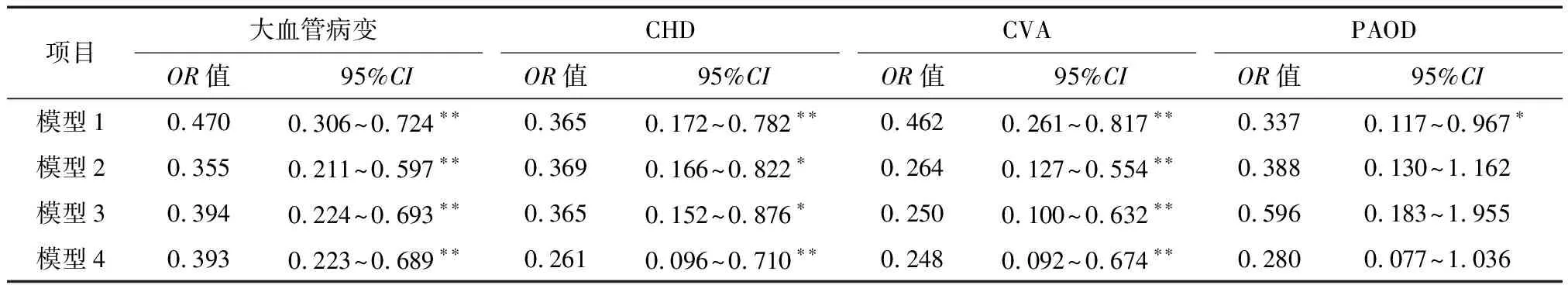
表6 发生大血管病变的多变量危险因素分析
注:模型1:未校正;模型2:校正年龄、性别;模型3:校正年龄、性别、高血压史、吸烟史、LDL、HDL、eGFR、使用他汀类药物;模型4:全校正。*P<0.05,**P<0.01
本研究发现,血清Klotho蛋白水平与CHD和CVA的发生呈负相关,这提示Klotho蛋白对心血管系统具有保护作用,与既往的一些研究[6, 16]结果相一致。Klotho蛋白可通过肾素-血管紧张素-醛固酮系统,调控一氧化氮的产生和钙磷代谢,调节血管张力[17]。许多实验模型也显示Klotho蛋白可减少氧化低密度脂蛋白诱导的氧化应激,改善内皮功能紊乱和动脉粥样硬化[18-19]。低Klotho蛋白水平与CHD、左心室肥厚、血压控制欠佳、血管钙化和寿命缩短密切相关[20]。
然而,对Klotho蛋白在2型糖尿病和DKD患者血管病变中的作用,相关的研究[20-22]结果却不一致。van Ark等[21]研究发现,不论2型糖尿病患者是否合并DKD,血清Klotho蛋白水平与大血管病变间无明显相关性;而Keles等[20]研究发现Klotho蛋白有助于预防1型糖尿病患者的动脉粥样硬化;有学者[22]研究发现血清Klotho蛋白水平的下降与微炎症及动脉粥样硬化相关。本研究显示血清Klotho蛋白水平下降会增加DKD患者的大血管病变的风险,低Klotho蛋白水平是DKD患者发生大血管病变的独立危险因素。研究结果的不一致可能与患者的入组标准不同、病例数有限、Klotho蛋白检测方法不同相关。大血管病变的核心机制是动脉粥样硬化,其机制涉及自由基形成和活性氧产生增加,而且DKD患者的长期高血糖也可刺激动脉粥样硬化形成[23]。
本研究发现低Klotho蛋白的患者也有较高的CVA发生率。Klotho基因主要在肾脏和大脑中表达[24]。既往研究发现Klotho-/-小鼠的神经元细胞中,出现氧化应激水平的增加和钙代谢紊乱[14, 25]。最近的研究也表明Klotho蛋白可能也参与神经元的变性过程,最终可导致CVA或认知障碍[26-27]。另外,Klotho蛋白的基因多态性与心源性栓塞引起的缺血性卒中之间也存在相关性[20]。因此,上述研究结果可以解释低Klotho蛋白水平与CVA之间的密切相关性。
此外,在研究开始时,高Klotho蛋白组患者微血管病变的发生率较高,这可能是因为本研究入组患者年龄较大、糖尿病病程较长。而且经过5年随访,两组患者的微血管病变发生率也相似。研究表明,Klotho蛋白可减少氧化应激、改善内皮功能,并在细胞水平表现出保护血管的作用[28]。
由于血管病变可进一步导致DKD患者的心血管疾病发病率和病死率升高,因此预防或早期治疗十分重要。本研究发现DKD患者血清Klotho蛋白与血管病变的相关性,仍需要长期纵向研究,以便更好地理解血清Klotho蛋白水平与血管病变之间的动态相关性。早期发现低Klotho蛋白血症、并及时干预治疗,是预防DKD患者血管病变的潜在治疗靶点。
本研究也存在一些局限性。首先,本研究是单中心、小样本研究,这限制了研究结果的普适性,需要多中心、大样本研究来进一步明确。其次,既往的研究表明,FGF23与Klotho蛋白可通过信号转导途径产生协同作用,加速心血管疾病的进展,包括CHD、左心室肥厚和血管内皮功能紊乱,与Klotho蛋白相反,FGF23在血管病变中的作用已在许多临床研究中得到证实[29]。然而,本研究未检测FGF23水平,因此无法确定Klotho蛋白的作用是依赖于FGF23还是独立于FGF23,需要后续研究探讨FGF23在其中的作用。第三,既往的研究表明,使用他汀类药物和RAAS抑制剂可能会影响Klotho蛋白的作用[5],因此,本研究中他汀类药物和RAAS抑制剂的高使用率也可能会影响研究结果。
综上所述,本研究发现DKD患者低Klotho蛋白水平与大血管病变之间存在相关性,是大血管病变的独立预测因子。仍需要进一步的临床研究,验证其潜在的治疗价值。

