基于金-汞纳米颗粒可视化检测海产品中的甲基汞
陈清爱, 雷丽琴, 傅依灵, 杨玮娟
(1. 福建商学院旅游与休闲管理学院, 福建 福州 350012; 2. 福建农林大学植物保护学院, 福建 福州 350002)
0 引言
汞污染造成的环境问题和食品安全问题[1]正逐步引起人们的高度重视. 自然界中的汞根据形态不同可分为无机汞和有机汞, 其中有机汞包含甲基汞和乙基汞. 甲基汞的毒性不但高于无机汞, 并且甲基汞脂溶性更强, 更容易经由人体胃肠道吸收, 穿过血脑屏障从而损害中枢神经系统. 据研究报道海产品中汞的主要形态是甲基汞, 例如鱼肉中95%以上汞形态为甲基汞, 它容易通过食物链富集并造成毒性伤害, 通常食物链等级越高, 富集的甲基汞含量越高[2]. 上世纪50年代发生在日本的水俣病, 正是由于食用了甲基汞污染的海产品造成的群体性中毒事件. 为了保障食品安全, 各国对海产品制定了最大残留限量标准, 其中, 我国规定鱼类中甲基汞的最大残留限量标准为0.5 mg·kg-1, 食肉鱼类中甲基汞最大残留限量为1.0 mg·kg-1[3].
对于食品安全检测来说, 仅检测总汞含量无法准确评估其毒性, 因此需分别检测不同形态汞的浓度,而有机汞的测定一直以来是食品安全与环境评价的重点和难点. 目前有机汞检测方法主要依赖于离子色谱法、 液相色谱法和毛细管电泳法等分离方法与原子荧光光谱法、 电感耦合等离子体质谱法等检测方法的联用技术[4-8], 这些方法需要复杂的样品制备或昂贵的大型仪器. 近年来, 为了避免繁琐的样品制备并实现现场便携式检测, 有机汞残留的快速检测方法也取得了一定的进展. 例如Zhang等[9]通过合成一种有机小分子荧光探针同时检测无基汞和甲基汞, 但这一方法的广泛使用受有机小分子合成和荧光检测稳定性的限制. 自从富含胸腺嘧啶的DNA被发现能够与汞形成T-Hg-T结构, 便被大量用于无机汞离子的测定[10]. 近年来, DNA 识别在甲基汞检测中的应用也受到越来越多的关注. 其中, Deng等[11]筛选并优化了甲基汞特异性核酸序列, 并结合金属纳米合金法设计了甲基汞的荧光快速检测方法. Chen等[14]进一步通过CE-ICP-MS方法验证了这些DNA序列可用于甲基汞识别及分离检测. 同时, 研究者们在此基础上发展了多种可视化检测方法, 例如设计了银-汞纳米合金生长法和基于金纳米棒的显色方法等, 用于甲基汞和乙基汞的快速、 可视化检测, 然而上述可视化检测方法需要在加热反应或经过额外的修饰步骤才能完成检测[13-14]. 因此, 开发一种更加温和、 廉价、 快速的甲基汞检测方法并进一步提高其检测灵敏度, 具有重要的应用价值和实际意义.

图1 基于HT9核酸调控金-汞纳米颗粒生长的甲基汞可视化检测示意图Fig.1 Colorimetric detection of CH3Hg+ with a label-free Au@Hg nanoparticle growth mediated by HT9 DNA template
本实验设计一种基于核酸调控金-汞纳米颗粒生长的非标记、 可视化甲基汞检测方法, 其原理如图1所示, 利用能特异性识别甲基汞的HT9 DNA序列为模板, 结合甲基汞后, 经硼氢化钠还原后形成不同浓度的汞纳米晶种, 在此基础上加入氯金酸和盐酸羟胺, 使纳米晶种继续生长成金-汞纳米颗粒, 呈现由无色向紫红色的颜色变化. 研究探讨传感体系的可行性, 讨论实验条件对该方法测定结果的影响, 并将该方法用于海产品提取液中甲基汞的快速可视化检测.
1 实验部分
1.1 试剂和仪器
硝酸汞(99.9%, 质量分数)、 氯化甲基汞、 氯金酸、L-半胱氨酸购自西格玛奥德里奇有限公司, 硼氢化钠、 氯化钠、 氯化镁、 三氯化铁、 氯化亚铁、 氯化钾、 氯化钙、 硝酸铜、 硝酸铅、 氯化镉、 氯化锌、 氯化铝、 硝酸镍、 氯化镧、 氯化钴、 硝酸铬均购自国药集团化学试剂有限公司, 上述化学试剂均为分析纯; 实验用水为二次蒸馏水. DNA序列由上海生工生物技术有限公司(上海, 中国)合成, 并由该公司通过HPLC 纯化. 384孔透明酶标板购自美国康宁公司, 吸收光谱扫描使用Tecan SparkTM 10M多功能酶标仪(瑞士帝肯集团公司), 电感耦合等离子体质谱使用安捷伦7700型(美国安捷伦科技公司), 离子色谱使用美国Thermo Fisher公司ICS-2100型, 透射电镜表征使用日立高新透射电子显微镜HT7700 (120 kV)(日立高新技术公司), 水合粒径检测使用Nanotrac Wave Zeta电位仪(美国麦奇克公司).
1.2 实验方法1.2.1 基于金-汞纳米颗粒生长检测汞离子
在50 μL含不同浓度甲基汞的缓冲液Tris-HCl (10 mmol·L-1Tris-HCl, 100 mmol·L-1NaCl, 2 mmol·L-1MgCl2, pH=7.0)中加入10 μL 37.5 μmol·L-1DNA, 混匀后室温静置5 min, 加入5 μL 25 mmol·L-1NaBH4(现配现用, 冰水), 混匀, 室温静置 20 min待充分反应, 加入5 μL 200 mmol·L-1NH2OH·HCl溶液及50 μL 1.0 mmol·L-1HAuCl4溶液, 混匀, 直接取50 μL加入384孔酶标板测定400~1 000 nm 吸收光谱. 由于甲基汞溶液毒性很高, 必须在通风良好的环境中配制, 并应格外小心, 避免皮肤直接接触. 实验中产生的所有含汞废物的处置应按照实验室规范进行.
1.2.2选择性实验
选择甲基汞浓度为5 μmol·L-1, 分别选取常见的干扰离子Al3+、 Ni2+、 Cr3+、 Ca2+、 K+、 Fe3+、 Fe2+、 La3+、 Co2+、 Cd2+、 Cu2+、 Pb2+各500 μmol·L-1, 无机汞浓度为5、 500 μmol·L-1, 配制于缓冲液中, 与10 μL 37.5 μmol·L-1DNA混匀后室温静置5 min, 加入5 μL 25 mmol·L-1NaBH4(现配现用, 冰水)混匀, 室温静置20 min待充分反应; 加入5 μL 200 mmol·L-1NH2OH·HCl及50 μL 1.0 mmol·L-1HAuCl4, 混匀, 取50 μL加入384孔酶标板测定400~1 000 nm 吸收光谱.
1.2.3加标实际样品中甲基汞的检测
小黄鱼、 海带、 鲍鱼样品购自福州市场, 购买后储存于冰上, 立即送到实验室. 海带样品表面经过纯水冲洗后, 用无尘纸吸走表面水分. 鲍鱼样品取可食部分, 小黄鱼切取食用肌肉部分, 将上述3种海产品分别打碎, 均质, 保存于-20 ℃冰箱. 准确称取5.0 g海带、 鲍鱼肉、 小黄鱼肉均质样品, 加标样品中加入500 ng·g-1甲基汞标准溶液, 放入100 mL聚四氟乙烯消解瓶中, 加入20 mL 1 mol·L-1盐酸溶液, 盖紧后放入微波消解器中. 微波系统功率为400 W, 70 ℃加热5 min. 将提取物冷却至室温后, 移出上清液. 再加入20 mL 1mol·L-1盐酸溶液, 以同样方式重复提取残留物1次, 合并两次上清液. 从中取1 mL提取液, 用0.22 μm滤膜过滤后加入3 ku超滤管中, 10 000 r·min-1离心5 min以分离大分子基质, 从收集管的滤液中取400 μL, 用真空离心浓缩仪浓缩至接近干燥, 加入50 μL反应缓冲液Tris-HCl (10 mmol·L-1Tris-HCl, 100 mmol·L-1NaCl, 2 mmol·L-1MgCl2, pH=7.0)充分溶解, 用本研究所发展的方法检测. 将空白样品微波提取液与等体积2.0 mmol·L-1L-半胱氨酸(pH=2.0)混匀络合, 加标样品用1.0 mmol·L-1L-半胱氨酸 (pH=2.0) 稀释62.5倍, 取25 μL通过 IC-ICP-MS 分析对比结果, IC-ICP-MS分离检测条件参考文献[5], 分离柱为两个串联的Zorbax SCX阳离子柱, 流动相为1.0 mmol·L-1L-半胱氨酸(pH 2.0), 流速为1 mL·min-1.
2 结果与讨论
2.1 基于纳米晶种及纳米金汞合金的表征
通过动态光散射法表征金-汞纳米颗粒的生长情况, 空白样品与DNA混合后加入硼氢化钠还原, 通过Zeta电位仪未测得纳米颗粒, 加入氯金酸生长后, 同样未测得分散的纳米颗粒. 含甲基汞离子的样品经硼氢化钠还原后, 溶液呈无色, 水合粒径为(4.7±1.3)nm, 如图2(a)所示, 在pH=7.0缓冲液中ζ电位为-200 mV, 说明被还原的汞纳米颗粒被带负电的DNA包裹, 同时DNA作为稳定剂使纳米颗粒分散于含高浓度盐缓冲液中. 通过透射电镜表征, 经还原获得的汞纳米晶种为分散的球状颗粒, 如图2(b)所示, 其粒径分布为(2.5±1.1)nm, 如图2(c)所示. 加入氯金酸并且进一步还原后, 溶液由无色变为紫红色, 此时经动态光散射测得水合粒径为(30.2±10.8)nm, 如图2(d)所示, 在pH=7.0缓冲液中ζ电位为+0.1 mV, 说明带负电的晶种颗粒几乎完全被金还原覆盖形成核-壳结构的Au@Hg纳米合金颗粒. 通过透射电镜表征可知, 经生长获得的金-汞纳米颗粒为分散的球状颗粒, 如图2(e)所示, 经统计, 其粒径分布为(25.4±8.0)nm, 如图2(f)所示.


图2 金-汞纳米合金生长不同反应阶段的表征Fig.2 Characterization of Au@Hg nanoparticle at different growth stages
2.2 DNA 模板的优化
在已有文献报道的基础上, 选择识别汞离子的富T 碱基DNA序列作为研究对象, DNA 序列如表1所示, 这些序列被报道可用于识别甲基汞离子或无机汞离子[11, 15]. 本文研究不同形态汞存在下, DNA序列对于金-汞纳米颗粒生长的影响, 并获得最优的DNA序列. 结果如图3所示, HT9 DNA对于甲基汞离子的特异性最好且信号最强, 相应的吸收光谱如图4所示, 因此选择HT9 DNA作为模板用于金-汞纳米颗粒生长从而实现甲基汞的检测.
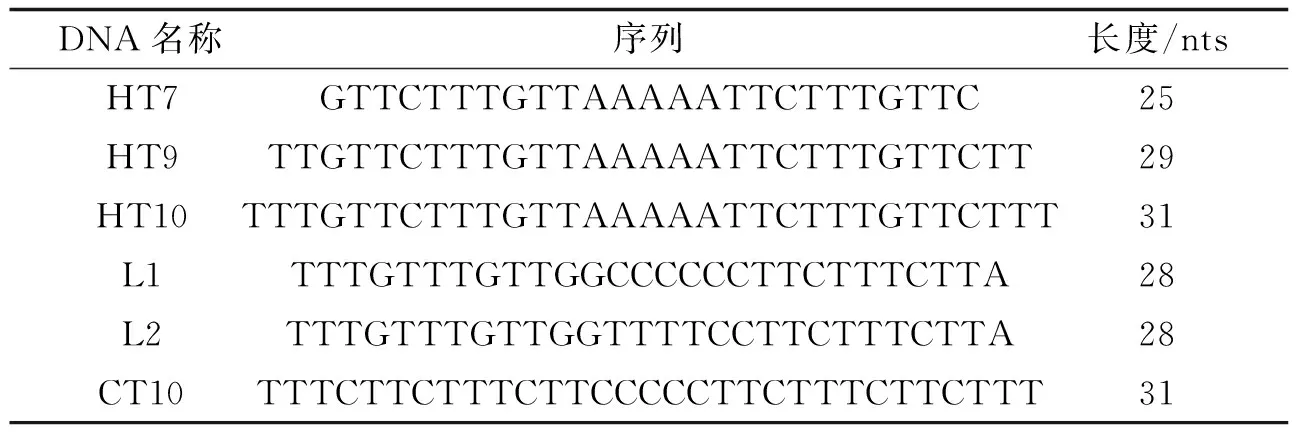
表1 检测所用DNA 序列

图3 不同序列DNA调控生长金-汞纳米颗粒照片Fig.3 Photographs of Au@Hg nanoparticle grown by different sequences of DNA
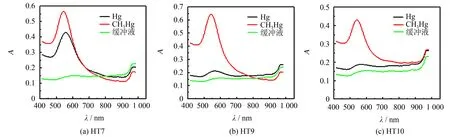

图4 不同序列DNA调控金-汞纳米颗粒生长响应光谱图Fig.4 Response spectrum of Au@Hg nanoparticle grown by different sequences of DNA
2.3 金-汞纳米颗粒生长体系对于甲基汞的检测性能
在最优实验条件下(HT9 DNA 浓度为37.5 μmol·L-1, NaBH4浓度为25 mmol·L-1, 还原时间为20 min, 盐酸羟胺溶液浓度为200 mmol·L-1, 氯金酸溶液浓度为1.0 mmol·L-1), 考察传感体系可视化检测甲基汞的效果, 如图5所示. 从图5(a)可观察到传感体系检测方法甲基汞的吸光图谱变化, 随着甲基汞浓度的升高, 传感体系在550 nm处的吸光峰也随之上升. 由图5(b)可知, 传感体系在550 nm处的吸收值与甲基汞离子浓度存在一定的线性关系. 当甲基汞浓度在0.05~4.00 μmol·L-1范围内, 传感体系在550 nm处的吸收值与甲基汞离子浓度具有良好的线性关系, 其线性方程为A550=0.041 1×c(CH3Hg+)+0.1769,r=0.990, 以3σ/k( 其中σ= 0.000 14,k= 0.041 1) 计算的仪器检测限为0.01 μmol·L-1. 此外, 随着甲基汞浓度的升高, 传感体系的颜色由无色变为紫色并逐步加深(见图5(c)), 通过目视法可检测甲基汞浓度低至0.20 μmol·L-1.

图5 传感体系检测甲基汞Fig.5 Detection of methyl mercury by the sensor system
2.4 特异性研究
通过含不同离子与空白样品在550 nm处的吸光度比为信号/背景值, 评价不同金属离子对汞离子检测的干扰情况. 如图6所示, 5、 500 μmol·L-1无机汞离子(Hg2+)及500 μmol·L-1其他金属离子Al3+、 Ni2+、 Cr3+、 Ca2+、 K+、 Fe3+、 Fe2+、 La3+、 Co2+、 Cd2+、 Cu2+、 Pb2+, 对5 μmol·L-1甲基汞的检测几乎无干扰. 由于反应缓冲液中含100 mmol·L-1Na+及5 mmol·L-1Mg2+, 因此无需额外评估这两种常见金属离子对于检测的干扰.

图6 甲基汞可视化传感器选择性考察Fig.6 Specificity of the proposed colorimetric assay
2.5 方法验证和实际样品的分析
使用本方法测定市售海带、 鲍鱼、 小黄鱼等3种海产品加标样品中甲基汞含量, 并将检测结果与离子色谱-电感耦合等离子体质谱(IC-ICP-MS)检测所得参考值进行比较. 海产品的前处理方法[9]和检测方法[6]参考已报道文献. 图7为 Hg2+和 甲基汞的IC-ICP-MS 分离谱图. 如图7所示, 经半胱氨酸络合后, 含有1 μg·g-1甲基汞经IC-ICP-MS检测, 保留时间为50 s, 而含有1 μg·g-1Hg2+的保留时间为95 s. 以小黄鱼提取液和加入0.5 μg·g-1甲基汞的加标样品为例, 图8为实际样品中的甲基汞 IC-ICP-MS 谱图. 从图8中的小分离峰可以看出小黄鱼提取液中汞的保留时间为50 s, 说明其形态主要为甲基汞, 这与文献所报道的鱼肉中95%以上的汞形态为甲基汞相吻合; 同时也能检测到加标样品的甲基汞浓度. 本方法所得结果与IC-ICP-MS检测结果对比(见表2)基本吻合, 5次重复测定结果的相对标准偏差小于 4.6%, 对于0.5 μg·g-1甲基汞加标回收率为90.4%~97.0%. 上述结果表明, 本方法用于海产品提取液分析具有较好的可靠性和准确度.

图7 Hg2+和 甲基汞的IC-ICP-MS 分离谱图Fig.7 IC-ICP-MS chromatogram for separation of Hg2+ and methyl mercury

图8 实际样品中甲基汞的 IC-ICP-MS 谱图 Fig.8 IC-ICP-MS chromatogram for methyl mercury in real samples

表2 不同海产品空白实际样品与加标样品检测结果(n=5)
3 结语
本研究发展了一种甲基汞离子的快速可视化检测方法, 该方法基于HT9核酸序列对于甲基汞离子的特异性识别, 通过晶种生长法还原后形成金-汞纳米颗粒, 并结合金-汞纳米颗粒的表面等离子体效应, 随着甲基汞浓度的升高, 呈现紫红色的颜色变化, 从而实现甲基汞的检测. 与以往报道的基于金纳米聚集显色方法相比[16], 本方法通过HT9 DNA 特异性识别甲基汞离子, HT9 DNA作为汞纳米晶种的模板和保护剂, 使纳米晶种稳定分散于高盐浓度的溶液中, 经测定, 所生成的纳米晶种在Tris-HCl中ζ电位为-200 mV, 分散性好, 从而可作为第二步生长的模板, 获得稳定的金-汞纳米颗粒. 含有甲基汞的浓度越高, 形成的金-汞纳米颗粒浓度越高, 样品在550 nm处的吸光度值越高, 颜色变化随着甲基汞浓度升高由无色过渡为红色, 避免了由于高盐浓度样品造成纳米颗粒聚沉而产生假阳性结果, 因此抗基质干扰能力较强, 同时本方法背景信号低、 操作简单有效, 30 min内即可完成, 非标记的检测法使得成本更加低廉. 本方法成功应用于海带、 鲍鱼、 小黄鱼加标样品提取液的检测, 回收率在90.4%~97.0%之间, 与IC-ICP-MS检测结果相近, 具有较好的准确度和选择性.

