miR-155对人胚肺成纤维细胞HELF增殖、凋亡和胶原蛋白合成的影响
宿利清,王立红,贺 岚,付秀华
内蒙古医科大学附属医院呼吸与危重症医学科 呼和浩特 010059
有研究[1-3]报道,微小RNA(miRNA)的异常表达在肺成纤维细胞的异常增殖和胶原蛋白的合成中发挥着重要作用,并逐渐成为肺纤维化的研究热点。miR-155是一种与肺部疾病关系密切的miRNA,已被证实在肺纤维化过程中表达上调,具有促进肺纤维化的作用[4-6],但临床上以miR-155为靶点的肺纤维化治疗的实验依据尚不充分。有研究[7]发现,miR-155可通过靶向调控Smad5促进肾脏的纤维化,但其是否通过靶向调控Smad5参与肺纤维化过程尚不清楚。因此,本研究通过构建miR-155低表达的人胚肺成纤维细胞HELF,观察miR-155与Smad5的靶向关系以及两者在HELF细胞增殖、凋亡和胶原蛋白(Col-Ⅰ和Col-Ⅲ)合成中的作用,以期为以miR-155为靶点的肺纤维化治疗提供新的依据。
1 材料与方法
1.1主要试剂Trizol试剂、Lipofectamine 2000、cDNA合成试剂盒购自美国Invitrogen公司,α-MEM培养基、CCK-8试剂盒和Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司。胰蛋白酶、二甲基亚砜、青霉素、链霉素和双荧光素酶报告基因检测试剂盒购自美国Sigma公司。qRT-PCR试剂盒和PCR引物购自上海吉玛制药技术有限公司。BCA蛋白浓度测定试剂盒购自美国Thermo Scientific公司。PVDF膜购自美国Millipore公司。β-actin抗体购自武汉博士德生物工程有限公司。Col-Ⅰ抗体、Col-Ⅲ抗体、山羊抗鼠/兔IgG二抗和si-Ctrl、si-Smad5均购自美国Santa Cruz公司,Smad5抗体购自美国CST公司。Smad5 3’-UTR野生型(Smad5-WT)、突变型(Smad5-MUT)质粒和miR-155模拟物、miR-155抑制剂及其相应的阴性对照均购自广州锐博生物科技有限公司。miR-155上游引物序列为5’-CTCGTGGTAATGCTAATT GTGA-3’,下游引物序列为5’-GTGCAGGGTC CGAGGT-3’;内参U6上游引物序列为5’-GCGCGTCGTGAAGCGTTC-3’,下游引物序列为5’-GTGCAGGGTCCGAGGT-3’。Smad5上游引物序列为5’-GTGGCATATAGGCAGGAGGA-3’,下游引物序列为5’-AACCTGAGCCACAATGAACC-3’;内参β-actin上游引物序列为5’-GGCGGCAACACCATG TACCCT-3’,下游引物序列为5’-AGGGGCCG GACTCGTCATACT-3’。
1.2细胞培养、分组及转染人胚肺成纤维细胞HELF购自南京凯基生物科技发展有限公司。HELF细胞培养所用的培养基为含有体积分数10%胎牛血清、青-链霉素的α-MEM培养基。置于体积分数为5%CO2、37 ℃、饱和湿度的细胞培养箱中常规培养。将对数生长期的HELF细胞以适当密度(2.5×105个/孔)铺于6孔板上,于细胞培养箱中培养过夜,待细胞达80%融合度时将细胞分为对照组(未转染组)、anti-miR-NC组(转染miR-155抑制剂阴性对照)、anti-miR-155组(转染miR-155抑制剂),参照Lipofectamine 2000转染试剂说明书进行瞬时转染。转染6 h后,更换成含血清的完全培养基继续培养。培养48 h后收集各组细胞用于后续实验。
1.33组细胞中miR-155mRNA表达的qRT-PCR检测采用Trizol法提取对照组、anti-miR-NC组和anti-miR-155组HELF细胞的总RNA,并参照cDNA合成试剂盒说明书步骤合成cDNA。以cDNA为模板,U6和β-actin为内参,按照PCR试剂盒说明书进行扩增,并采用2-ΔΔCt法计算miR-155的表达水平。PCR反应条件:94 ℃预变性120 s;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。
1.43组细胞增殖的CCK-8法检测取继续培养48 h后的对照组、anti-miR-NC组和anti-miR-155组HELF细胞,加入CCK-8试剂10 μL/孔,反应1 h后,上酶标仪测定490 nm处的吸光度值。实验重复3次。
1.53组细胞凋亡的双染法检测收集继续培养48 h后的对照组、anti-miR-NC组和anti-miR-155组HELF细胞,并以PBS洗涤2次。以500 μL的结合缓冲液重悬细胞后,参照凋亡试剂盒依次加入Annexin V-FITC和PI试剂各5 μL。避光条件下反应15 min后,上流式细胞仪检测。实验重复3次。
1.63组细胞中Col-Ⅰ和Col-Ⅲ蛋白表达的Western blot检测向待测的对照组、anti-miR-NC组和anti-miR-155组HELF细胞中加入RIPA细胞裂解液,于冰上裂解30 min,离心取上清液,加入蛋白上样缓冲液煮沸变性5 min。取变性蛋白样品50 μg行SDS-PAGE凝胶电泳。转PVDF膜后,以50 g/L脱脂奶粉溶液于37 ℃下封闭1 h后,加入特异性一抗(按1∶1 000稀释)于4 ℃下反应过夜。洗膜后,加入二抗(按1∶2 000稀释)于37 ℃下反应2 h。再次洗膜后,加入化学发光剂显色曝光,凝胶成像系统扫描,以β-actin为内参,Image J软件分析目的条带的灰度值。实验重复3次。
1.7miR-155和Smad5靶向关系的双荧光素酶报告基因实验及各组细胞中Smad5mRNA和蛋白表达的检测采用TargetScan(http://www.targetscan.org)生物信息学软件预测miR-155的靶基因可能为Smad5。取对数生长期的HELF细胞,以适当密度接种至24孔板上,常规培养达75%融合度时,将细胞分为miR-NC组(转染miR-155模拟物阴性对照)和miR-155组(转染miR-155模拟物)、anti-miR-NC组(转染miR-155抑制剂阴性对照)、anti-miR-155组(转染miR-155抑制剂),参照Lipofectamine 2000转染试剂说明书进行瞬时转染。转染48 h后,根据双荧光素酶报告基因检测试剂盒说明书,并以海肾质粒的荧光值为内参,检测各组细胞的荧光素酶活性。采用qRT-PCR和Western blot检测各组细胞中Smad5 mRNA和蛋白的表达。
1.8Smad5沉默逆转miR-155低表达对HELF细胞增殖、凋亡、Smad5、胶原蛋白合成的作用取对数生长期的HELF细胞,以适当密度接种至24孔板上,常规培养达75%融合度时,将细胞分为anti-miR-NC组、anti-miR-155组、anti-miR-155+si-Ctrl组(共转染miR-155抑制剂和si-Ctrl)和anti-miR-155+si-Smad5组(共转染miR-155抑制剂和si-Smad5),参照Lipofectamine 2000转染试剂说明书进行瞬时转染。48 h后,分别检测4组细胞的吸光度、凋亡率和细胞中Smad5、Col-Ⅰ和Col-Ⅲ蛋白的表达水平。实验重复3次。
1.9统计学处理采用SPSS 22.0进行数据分析,应用单因素方差分析和SNK-q检验比较各组细胞中miR-155、吸光度值、凋亡率和细胞中Smad5、Col-Ⅰ和Col-Ⅲ蛋白表达水平的差异,检验水准α=0.05。
2 结果
2.13组细胞中miR-155表达水平、吸光度值和凋亡率的比较结果见表1。由表1可知,转染miR-155抑制剂后,HELF细胞中miR-155 mRNA的表达水平较对照组明显降低(P<0.05);而转染miR-155抑制剂阴性对照的HELF细胞中的miR-155 mRNA的表达水平与对照组相比差异无统计学意义(P>0.05)。CCK-8和流式细胞仪检测发现,与对照组相比,anti-miR-155组细胞的吸光度值降低,凋亡率升高(P<0.05);anti-miR-NC组细胞的吸光度值和凋亡率差异无统计学意义(P>0.05)。
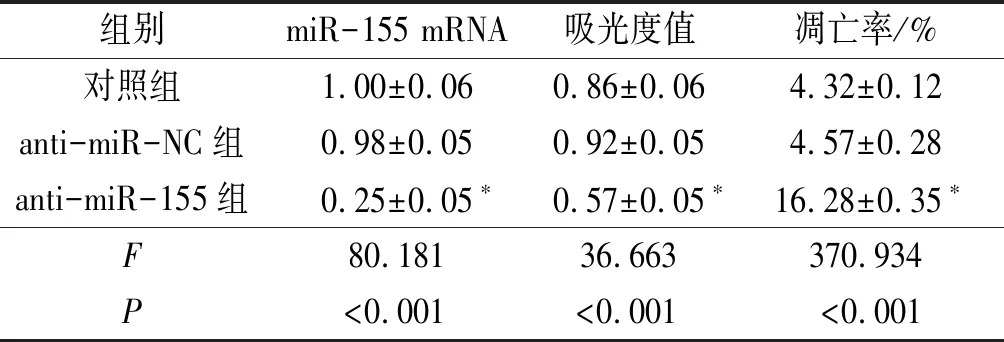
表1 3组细胞中miR-155表达水平、细胞的吸光度值和凋亡率的比较(n=3)
2.23组细胞中Col-Ⅰ和Col-Ⅲ蛋白表达的比较结果见表2。由表2可知,与对照组相比,anti-miR-NC组细胞中Col-Ⅰ和Col-Ⅲ蛋白的表达水平无明显改变(P>0.05);而anti-miR-155组中Col-Ⅰ和Col-Ⅲ蛋白的表达水平降低(P<0.05)。
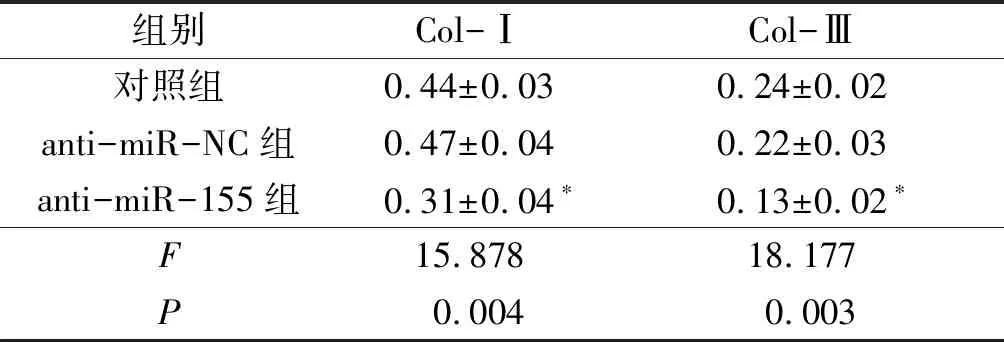
表2 3组细胞中Col-Ⅰ和Col-Ⅲ蛋白表达的比较(n=3)
2.3各组细胞的荧光素酶活性和细胞中Smad5mRNA、蛋白表达的结果见表3。由表3可知,miR-155组细胞的荧光素酶活性较miR-NC组降低;而anti-miR-155组细胞的荧光素酶活性较anti-miR-NC组均升高(P<0.05)。miR-155组和anti-miR-155组细胞的荧光素酶活性较相应对照miR-NC、anti-miR-NC组均无明显改变(P>0.05)。miR-155组细胞中Smad5 mRNA和蛋白的表达水平低于miR-NC组(P<0.05),anti-miR-155组细胞中Smad5 mRNA和蛋白的表达高于anti-miR-NC组(P<0.05)。
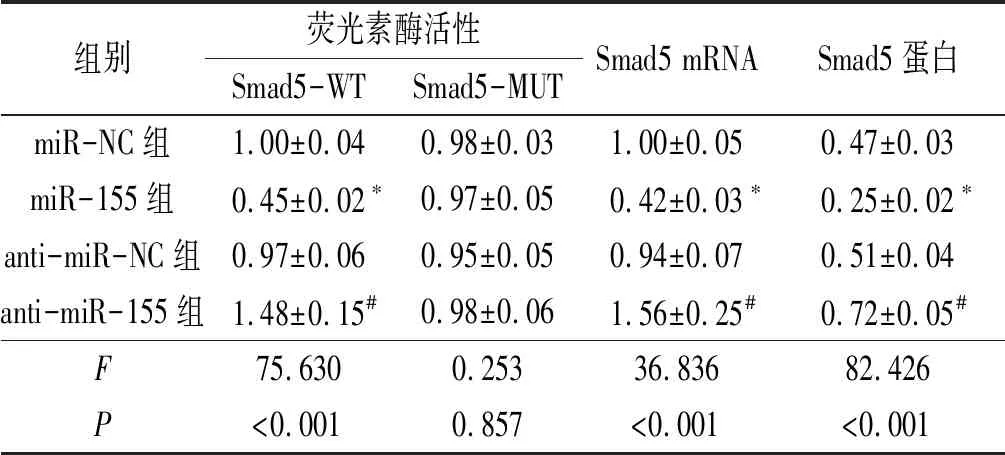
表3 各组细胞的荧光素酶活性和细胞中Smad5 mRNA、蛋白表达水平的比较(n=3)
2.4Smad5沉默逆转miR-155低表达对HELF细胞增殖、凋亡及胶原蛋白合成的作用结果见表4。由表4可知,与anti-miR-NC组相比,只转染miR-155抑制物下调miR-155表达后,HELF细胞的吸光度值和Col-Ⅰ、Col-Ⅲ蛋白的表达水平均降低,而Smad5蛋白表达水平和细胞凋亡率均升高(P<0.05);而转染si-Smad5后,miR-155低表达对HELF细胞的上述作用均受到抑制。
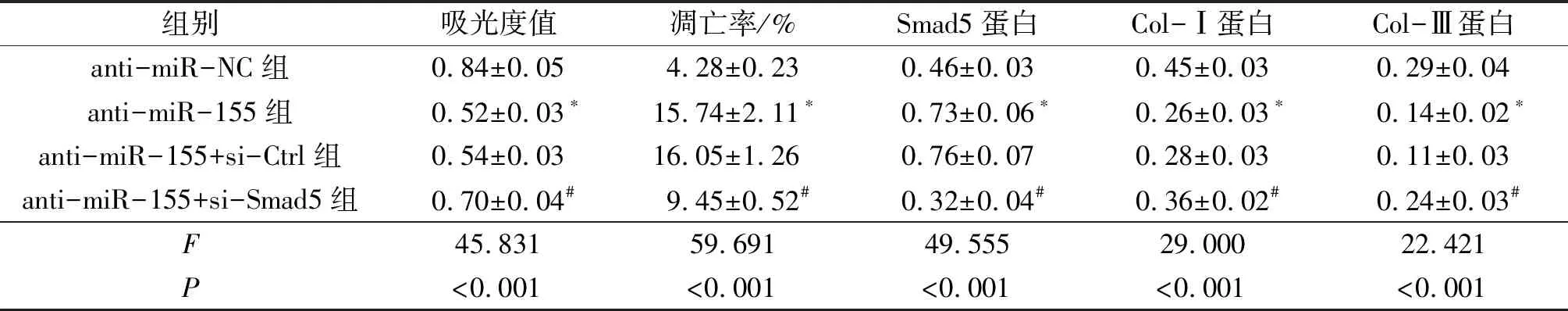
表4 各组细胞的吸光度值、凋亡率和细胞中Smad5、Col-Ⅰ和Col-Ⅲ蛋白表达水平的比较(n=3)
3 讨论
miRNAs是一类广泛分布于机体组织和细胞中的单链小分子RNA,可通过与靶基因mRNA的3′UTR区域结合,降解靶基因mRNA或抑制其翻译,导致靶基因的沉默,参与调控细胞增殖、分化和凋亡等生物过程,与癌症、闭塞性疾病和神经性疾病等多种疾病的发生发展关系密切[8-10]。miR-155是一种多功能的miRNA,位于人21q21染色体上,可通过调控多种靶基因参与细胞的增殖、凋亡过程。例如:下调miR-155表达可通过靶向SOCS3抑制淋巴瘤细胞增殖,促进细胞凋亡[11]。在动脉粥样硬化斑块中上调的miR-155可通过靶向eNOS发挥促进血管平滑肌细胞增殖和迁移的作用[12]。同时,miR-155也可通过多种途径参与纤维化疾病的发生发展过程。如:miR-155敲除可通过靶向肿瘤蛋白p53抑制心肌成纤维细胞增殖和分化,减少胶原沉积,进而可改善左心室功能,减少梗死面积[13]。miR-155在心梗后的纤维化过程中也发挥着重要作用,其可通过靶向调控TP53INP1的表达,促进心脏成纤维细胞的增殖、胶原合成和表型转化,并抑制成纤维细胞凋亡[14]。
Smads蛋白家族是TGF-β超家族中一类重要的细胞因子,在调节成纤维细胞增殖和凋亡过程中发挥中重要作用[15-16]; Smad5是Smads家族中的重要成员,位于第5号染色体长臂3区1带,被证实可通过介导BMP-7信号转导发挥保护机体肾脏纤维化的作用,且miR-155可通过靶向调控Smad5促进糖尿病肾病肾脏纤维化[7,17]。肺纤维化的分子机制十分复杂,肺成纤维细胞的过度增殖和细胞外基质的过度沉积是肺纤维化的重要病理特征。胶原蛋白Col-Ⅰ和Col-Ⅲ是构成细胞外基质的重要成分,可由成纤维细胞分泌合成[18]。因此,探讨成纤维细胞增殖、凋亡和胶原蛋白合成的分子机制对阐明肺纤维化发生发展机制具有重要意义。尽管已有研究[6]指出,miR-155可通过靶向转录调节因子LXRα发挥保护肺纤维化的作用,但miR-155是否可通过靶向Smad5参与肺成纤维细胞增殖、凋亡和胶原合成的调控机制并不清楚。本研究首先通过转染miR-155抑制物建立miR-155低表达的人胚肺成纤维HELF细胞株,采用常规生物学手段观察miR-155低表达对HELF细胞增殖、凋亡和胶原合成的影响。结果发现,miR-155低表达能够抑制HELF细胞增殖和Col-Ⅰ、Col-Ⅲ胶原蛋白的合成。这一结果反向印证了早期Kurowska-Stolarska等[6]发现的miR-155高表达的小鼠原代肺成纤维细胞的增殖活力和胶原合成能力增强的结论。此外,本研究还发现,miR-155低表达可促进HELF细胞凋亡。同时,采用TargetScan软件预测并通过双荧光素酶报告基因实验检测发现,miR-155可与Smad5 3’UTR区域结合并负向调控Smad5表达;转染si-Smad5成功沉默Smad5表达后,发现miR-155低表达对HELF细胞增殖、凋亡和胶原合成的作用明显削弱。提示,miR-155可通过靶向Smad5调控肺成纤维细胞增殖、凋亡和胶原蛋白的合成,进而参与肺纤维化的发生发展。
综上所述,miR-155在肺纤维化过程中发挥着重要作用,其低表达可通过靶向调控Smad5表达来抑制成纤维细胞增殖、胶原蛋白合成,并促进细胞凋亡。本研究仅从体外细胞水平上探讨了miR-155在成纤维细胞增殖、凋亡和胶原蛋白合成的作用,后续仍需从体内动物水平上加以验证,为miR-155成为肺成纤维化治疗的靶点提供新的参考依据。

