丹黄消炎液对糖尿病小鼠创面组织中HIF1-α及VEGF 表达的影响
刘国涛,王 军,周 玉,卢增珍
慢性创面难愈是糖尿病最常见的并发症之一,往往反复发作、迁延不愈、治疗费用高[1]。现代研究表明,糖尿病创面血管新生的主要机制与低氧诱导因子1-α(HIF1-α)/血管内皮生长因子(VEGF)轴密切相关[2]。虽然表皮生长因子类凝胶可以促进创面VEGF 的表达,但不适用于伴有感染的糖尿病创面[3]。祛瘀生肌类中药不仅可以促进创面坏死组织的脱落,还可以促进VEGF 表达[4]。课题组前期临床研究表明,丹黄消炎液外敷对糖尿病创面具有很好的疗效[5],但具体作用机制尚不明确。本研究通过建立I 型糖尿病小鼠创面模型,探讨丹黄消炎液通过HIF1-α/VEGF 治疗糖尿病创面的作用机制。
1 材料与方法
1.1 动物 SPF 级雄性BALB/c 小鼠共60 只,8周龄,体质量(19±2)g,由中国食品药品检定研究院提供,实验动物许可证号SCXK(京)2014-0013。
1.2 药物 丹黄消炎液为天津中医药大学第一附属医院院内制剂,由天津中医药大学中医药研究院提供(主要成分:黄芪、丹参、皂角刺、当归、银花、大黄、关黄柏。其中芦荟大黄素、大黄酸、大黄酚和大黄甲醚的总含量不少于生药的1.5%),每克含生药6.67 g。0.9%氯化钠溶液,国药准字:H37022336,山东辰欣药业股份有限公司。医用碘伏,国药准字:20180811,山东利尔康医疗科技股份有限公司。
1.3 主要试剂及仪器 链脲佐菌素(STZ,批号:Y161101),北京索莱宝科技用有限公司;柠檬酸(批号:20180401),天津大茂化学试剂厂;柠檬酸钠(批号:20180509),天津大茂化学试剂厂;异氟烷(批号:045740),深圳市瑞沃德生命科技有限公司;血糖试纸(批号:4527442),上海强生医疗器械有限公司;血糖仪(AW0647775005A),上海强生医疗器械有限公司;AKT 一抗:北京博奥森生物技术有限公司。β-actin 内参抗体:天津赛尔生物有限公司。辣根过氧化酶(HRP)标记二抗:天津赛尔生物有限公司。Epgiadients PCR 仪:Eppendorf 公司。ABI 7500 fast 荧光定量PCR 仪:Life Technologies 公司。
1.4 I 型糖尿病小鼠模型的建立 随机选取10 只小鼠作为正常组,余50 只禁食不禁水16 h,称重后用一次性无菌1 mL 注射器以60 mg/kg 将1%的STZ 柠檬酸-柠檬酸钠缓冲溶液经腹腔注入小鼠体内,连续5 d;对照组10 只腹腔注射柠檬酸-柠檬酸钠缓冲溶液。1 周后将随机血糖>16.7 mmol/L的小鼠挑出,此次实验成功制作I 型糖尿病小鼠40 只[6]。
1.5 创面模型的建立 取I 型糖尿病小鼠40 只与正常组小鼠10 只,参考文献[7]方法用动物剃毛器在背部刮出25 mm×25 mm 区域,用脱毛膏脱去剩余毛发,正常饲喂1 d。然后将小鼠以4%的异氟烷诱导麻醉,将小鼠俯卧位固定,以3%异氟烷维持麻醉。稍用力拉伸小鼠一侧腰背部皮肤使之拉伸变平,用15 mm×15 mm 的印章标记,局部碘伏消毒,用眼科剪沿着边缘剪去全层皮肤,医用无菌敷料贴敷,自粘型弹力绷带固定,分笼饲养。
1.6 分组与给药 将造模成功的糖尿病创面小鼠随机挑选30 只采用区组随机法分为模型组、阳性药组、中药组,每组10 只,正常组10 只。模型组、正常组用生理盐水1 mL/只外敷,阳性药组用碘伏1 mL/只外敷,中药组丹黄消炎液1 mL/只外敷,医用自粘绷带包扎,连续用药7 d。
1.7 观察指标及方法 分组后检测各组小鼠血糖:下午14:00 先用75%酒精棉球消毒鼠尾皮肤和眼科剪,待酒精挥发后剪破鼠尾尾尖1 mm,擦去第一滴血,用血糖试纸检测小鼠尾巴第二滴血,记录读数并于小鼠尾部涂布红霉素软膏以防感染;给药7 d 后对小鼠进行麻醉,计算各组创面愈合面积:用数码相机固定距离(30 cm)、固定焦距、固定标尺下照片,并用Image J 软件计算治疗愈合面积。
1.8 病理学染色 给药7 d 后收集各组小鼠创面部位皮肤组织,HE 染色观察各组小鼠创面组织病理学变化;此外,运用Masson 染色观察各组小鼠创面纤维组织分布及含量。
1.9 荧光定量PCR 检测HIF1-α 及VEGF mRNA表达水平 造模给药后,提取各组小鼠创面皮肤中总RNA,反转录合成cDNA,采用SYBR Green Real Time RT-PCR 试剂盒进行扩增,检测各组小鼠创面皮肤组织中HIF1-α 及VEGF mRNA 表达,以β-actin 为内参,具体引物序列见表1。

表1 引物序列
1.10 免 疫 组 化 检 测CD31、HIF1-α 和VEGF蛋白表达水平 造模给药后,运用免疫组化法检测各组小鼠创面皮肤组织中CD31、HIF1-α 和VEGF 蛋白表达水平。
1.11 统计学方法 采用SPSS 22.0 软件进行统计分析,计量资料采用表示,多组比较采用单因素方差分析,组间两两比较采用SNK-q 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠血糖水平比较 阳性药组、中药组和模型组的小鼠血糖值显著高于正常组(P<0.01),阳性药组、中药组和模型组间的小鼠血糖值差异无统计学意义,均符合I 型糖尿病小鼠模型的评定标准[6],见表2。
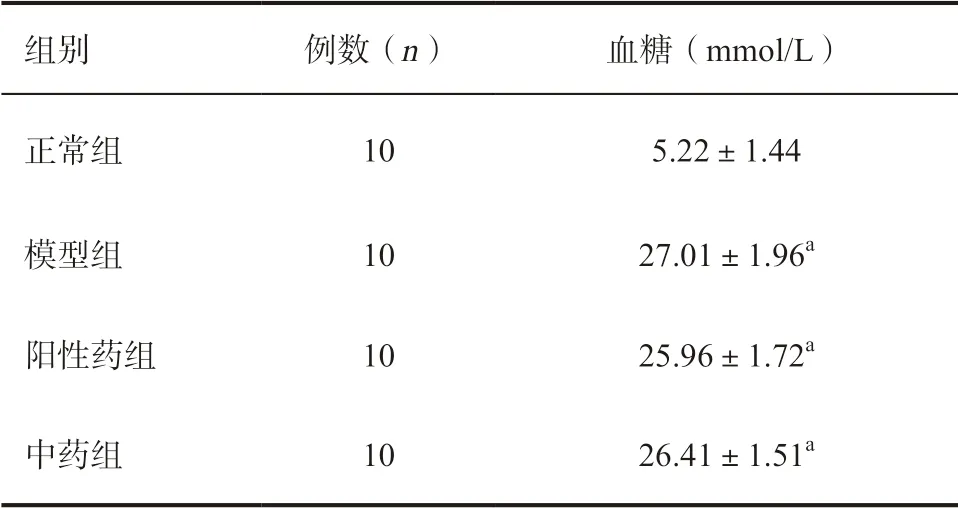
表2 各组小鼠血糖水平比较
2.2 各组小鼠治疗后创面愈合面积比较 正常组、阳性药组和中药组的创面愈合面积均大于模型组,差异有统计学意义(P<0.05),且中药组创面愈合面积大于正常组和阳性药组,差异均有统计学意义(P<0.05),见表3。
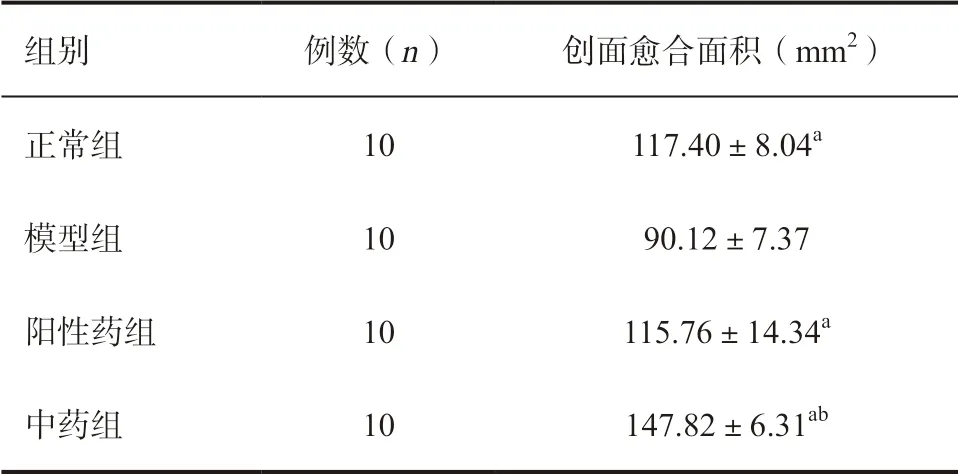
表3 各组小鼠创面愈合面积比较
2.3 治疗7 d 后各组创面病理切片HE 染色结果 HE 染色可见各组组织损伤处大面积坏死,表皮、真皮结构不清,局部可见出血(红色箭头);脓细胞渗出(黄色箭头):模型组>正常组>阳性药组>中药组;嗜酸性丝网状或均质状(黑色箭头):模型组>正常组>阳性药组=中药组。炎性细胞浸润(橙色箭头):模型组>正常组>阳性药组>中药组;肉芽组织内纤维结缔组织(绿色箭头):模型组<正常组<阳性药组<中药组;新生毛细血管(蓝色箭头):模型组<正常组<阳性药组<中药组,见图1。
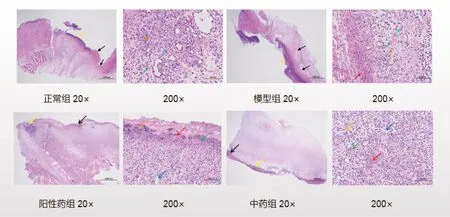
图1 各组治疗7 d 后小鼠创面组织的HE 染色图
2.4 治 疗7 d 后 各 组 创 面Masson 染 色 结果 Masson 染色可见各组组织损伤处大量肌纤维组织,与模型组相比,其余各组创面组织中纤维组织显著增多且排列致密,其中正常组最为明显,中药组和阳性药组次之,见图2。各组肌纤维容积分数,与模型组相比,正常组、阳性药组和中药组肌纤维容积分数显著增加,且中药组的肌纤维容积分数高于阳性药组,差异均有统计学意义(P<0.05),见表4。

表4 各组小鼠的肌纤维容积分数比较
2.5 各组小鼠创面组织中HIF1-α、VEGF mRNA水平比较 与模型组相比,正常组、阳性药组、中药组HIF1-α mRNA 和VEGF mRNA 表达水平显著上调,且中药组的HIF1-α、VEGF mRNA 表达水平高于阳性药组,差异有统计学意义(P<0.05),见图3。

图3 各组治疗7 d 天后小鼠创面HIF1-α、VEGF mRNA 表达水平(n=6)
2.6 各组小鼠创面组织中CD31、HIF1-α、VEGF 表达水平比较 CD31 主要表达于毛细血管部位,见图4,与模型组相比,正常组、阳性药组、中药组小鼠创面组织中 CD31 显著增加,且中药组高于阳性药组,差异有统计学意义(P<0.05)。HIF1-α 及VEGF 主要表达于纤维组织与血管内皮细胞的细胞质中(见图5、6)。与模型组相比,正常组、阳性药组及中药组创面组织中HIF1-α及VEGF 阳性表达水平显著增加(P<0.05)。中药组的HIF1-α 与阳性药组相比无统计学差异,但两组HIF1-α 蛋白阳性表达水平均低于正常组(P<0.05);中药组创的VEGF 蛋白表达水平显著高于阳性药组,差异有统计学意义(P<0.05),见表5。
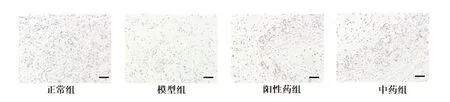
图4 各组小鼠创面组织中CD31 免疫组化染色(×100)
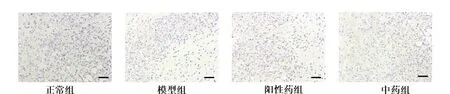
图5 各组小鼠创面组织中HIF1-α 免疫组化染色(×100)
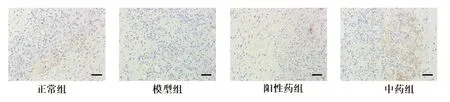
图6 各组小鼠创面组织中VEGF 免疫组化染色(×100)
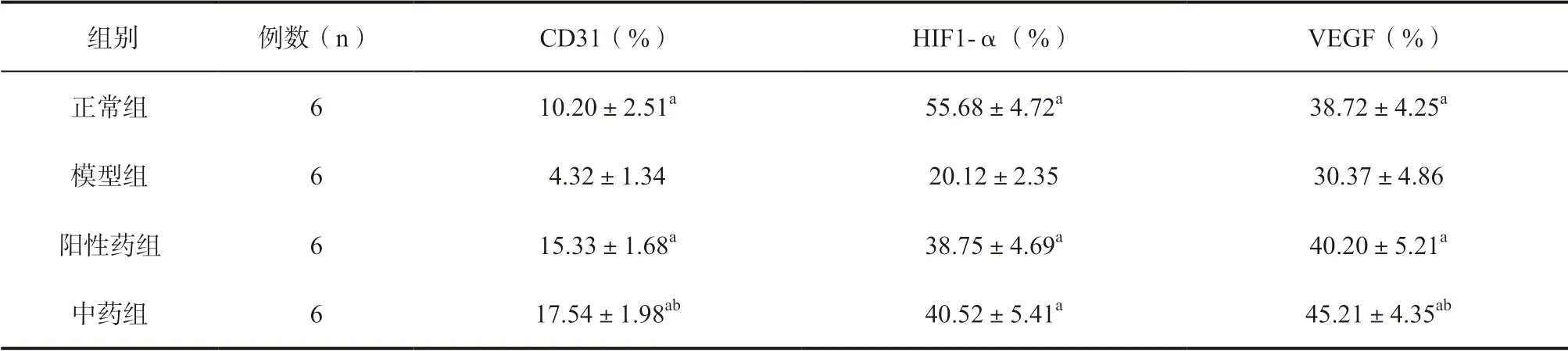
表5 各组创面组织中CD31、HIF1-α 和VEGF 比较
3 讨论
糖尿病创面愈合缓慢机制尚不明确,造成创面感染、血糖难以控制,尤其是发生在足部的糖尿病创面会引发骨髓炎、败血症等严重危及患者生命的并发症[1]。糖尿病属中医文献中的“消渴”范畴,在此基础上形成的创面可见于中医“脱疽”,《明代外科正宗》又有“若无变证,外无混杂,此十中可保其三四矣;若割取后,黑色仍漫,痛肿尤甚,败恶无脓,口干舌硬,食不知味者终死”记载。当下中医治疗多以固本箍毒、祛腐生新为糖尿病足溃疡治疗原则[8]。中医外治法可以直接作用于创面,具有较好的箍围去腐长肉的功效,且可以减少全身用药对脾胃带来的影响。因此,中医外治法在促进创面愈合方面更具优势。糖尿病创面的病因,起初表现为局部的溃破,气血瘀阻不畅,瘀而化热成脓成腐,导致创面愈合延迟。清热化瘀类中药具有清热利湿、化瘀生肌的作用,同时中药湿敷可以有效减轻创面渗出,使药力深达患处促进肉芽生长,在创面外治中广泛应用。
研究表明,糖尿病会导致严重的并发症,影响身体的各个器官代谢,糖尿病会导致皮肤血管数量减少和VEGF 表达下降,同时糖尿病造成皮肤抗氧化防御水平降低,这是导致皮肤损伤后愈合延迟的潜在原因[9]。各种原因导致糖尿病患者皮肤损伤后,机体修复大致分为止血、炎症、增殖和重塑四个阶段[10],糖尿病创面炎症阶段肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和 白 细 胞 介 素-1β(interleukin-1β,IL-1β)的表达升高,活性氧(reactive oxygen species,ROS)产生增多[11]。在正常的血氧供应条件下,HIF1-α 会迅速羟基化;在低氧组织条件下,HIF1-α 的羟基化减少,非羟基化的HIF1-α 蛋白可以稳定并启动VEGF 基因的表达[12],而高浓度的ROS 诱导会降低HIF1-α 与其辅酶p300 的结合,导致HIF1-α 反式激活功能下降,使得缺氧诱导的VEGF 表达降低导致新生血管受损[13]。因此,HIF1-α/VEGF 的功能受损是糖尿病患者血管生成障碍和伤口愈合延迟的重要原因。本研究结果提示,糖尿病小鼠创面VEGF 蛋白表达量低于普通小鼠创面;丹黄消炎液治疗后小鼠创面可见CD31、HIF1-α 和VEGF 表达水平升高;HIF1-α和VEGF mRNA 水平增加;然而HIF1-α 和VEGF蛋白免疫组化结果提示糖尿病的某些机制会下调HIF1-α 的表达,治疗后有其他因子或蛋白可以通过不依赖HIF1-α 的方式增加VEGF 的表达。课题组前期临床研究表明,丹黄消炎液外敷不仅能有效控制创面感染,还可以有效促进伤口缩小,促进创面趋向愈合,提示创面感染可能是导致这种现象的原因之一[14]。
文献报道,黄芪可以提高创面VEGF 的表达并促进愈合[15]。其有效成分黄芪甲苷IV 可以刺激细胞迁移,并上调HIF1-α 表达促进血管生成[16]。丹参有效成分丹参酮IIA 通过促进HIF1-α 和VEGF 因子的表达对缺血组织产生保护作用[17]。与单体药相比,丹参黄芪药可以从创面愈合的多阶段多靶点干预VEGF 表达[18]。目前,中医外治法治疗糖尿病创面的常见机制有:抑制晚期糖基化终产物诱导的细胞凋亡和细胞功能障碍,促进巨噬细胞的转型,激活Wnt/β-catenin 通路抑制糖原合成酶3β 的活性等[19-20]。糖尿病创面及周围的成纤维细胞、血管内皮细胞、巨噬细胞等,可分泌多种生长因子,包括转化生长因子-β1、胰岛素样生长因子-1、表皮生长因子等,通过激活相应的通路,促进创面的愈合[21]。本研究结果显示,糖尿病模型小鼠创面VEGF、HIF1-α 的表达下调,提示糖尿病模型小鼠出现了创面愈合延迟,这与现在的研究结果一致。丹黄消炎液外敷可以增加CD31 的荧光强度,表明血管生成增多;同时可以促进创面VEGF、HIF1-αmRNA 表达,促进创面愈合。临床研究发现,在患有2 型糖尿病和糖尿病足的患者的血液循环和组织活检中,血管生成因子SDF-1α 均显着降低[22]。这说明基质细胞衍生因子-1α(SDF-1α)可能通过激活HIF1-α/VEGF 信号通路参与了糖尿病创面的愈合过程。糖尿病创面是机制复杂的慢性创面之一,中医中药对慢性创面的促愈也是从多通路、多靶点来发挥作用的[23]。本方对创面愈合的其他蛋白或通路是否有促进作用,尚需将进行更深层次的课题研究和临床验证。

