核转录因子κB、P53 在膀胱癌组织中的表达及其与临床病理特征的关系
高 超,高 燕,杜张敏,付 曦,黄国军
膀胱尿路上皮癌是常见的恶性肿瘤,具有多发性和高复发率的特点。据估计2012 年北美大约有142 170 例膀胱癌新发病例[1]。膀胱癌在实体恶性肿瘤中的发病率排在第四位,且好发于男性,男女比例约为4∶1[2]。目前膀胱癌的确切发病及复发的分子机制并不十分清楚。目前认为与患者整个膀胱黏膜上皮基因组不稳定性有关。核转录因子κB(NF-κB)可以与细胞核内DNA 顺式作用元件相结合,启动DNA 转录,在多种肿瘤中其表达水平升高,且与肿瘤的预后不良有关。P53是经典的肿瘤抑制基因。几乎在所有恶性肿瘤中,50%以上会出现P53 基因的突变。P53 基因编码的蛋白质是一种转录因子,控制着细胞周期的启动。当细胞受损,且无法得到修复时,P53 蛋白将参与启动过程,使细胞进入凋亡程序。本研究采用免疫组织化学SP 法检测NF-κB 和P53 蛋白在膀胱移行上皮癌中的表达,并探讨其表达与患者临床特征和预后的关系。
1 资料与方法
1.1 临床资料 选择2014 年2 月—2017 年1 月成都市郫都区人民医院确诊并手术的膀胱移行上皮癌患者48 例。纳入标准:病理学确诊为膀胱尿路上皮癌者,术前未接受过放化疗,临床病例资料完整,术后随访资料齐全。排除标准:其他病理类型的膀胱癌患者,合并其他恶性肿瘤者。选择同期因膀胱良性病变行手术治疗的非膀胱癌患者16 例,均无恶性肿瘤病史。
1.2 仪器与试剂 一抗:鼠抗人NF-κB,兔抗人P53 单克隆抗体(购自美国Santa Cruz 公司);即用型免疫组化SP 试剂盒(购自北京中山生物技术公司),微波炉(购自格兰仕公司),微量加样仪(购自德国Eppendor 公司)。
1.3 检测方法 采用免疫组织化学SP 法检测膀胱癌组织、癌旁组织及非膀胱癌患者正常尿路黏膜组织中NF-κB 和P53 蛋白的表达水平。首先对切片进行脱蜡和水化,然后进行抗原修复后,应用PBS 洗2 次,加正常山羊血清封闭,室温20 min,后甩去液体,加一抗(NF-κB 或P53),4 ℃过夜。过夜后37 ℃复温45 min,PBS 清洗3 次后加二抗,37 ℃,1 h,PBS 清洗后加入SP 液室温20 min。DAB 显色10 min,显微镜下观察染色程度。苏木精复染2 min,脱水、封片然后置显微镜下进行观察。
1.4 观察指标与评价标准 观察癌组织、癌旁组织和正常膀胱尿路上皮组织中NF-κB 和P53 的表达水平;记录患者年龄、性别、肿瘤分级、临床分期及淋巴结转移情况。NF-κB 阳性染色多位于癌细胞胞浆内,散在分布于核内,呈棕黄色颗粒或团块,弥漫分布。P53 蛋白表达主要分布在细胞核和细胞质中,呈棕黄色颗粒状。根据Handel 等[3]的分级标准双盲法计分:<5%为-,5%~25%为+,26%~49%为++,≥50%为+++。
1.5 统计学分析 数据分析采用STATA12.0 软件完成,计量资料采用表示,组间比较采用t检验,计数资料采用例(%)表示,组间比较采用卡方检验或fisher 确切概率法。无疾病进展生存时间(Disease free survival, DFS)等采用中位数表示,组间比较采用Log-rank 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 免疫组化结果 NF-κB 阳性染色多位于癌细胞胞浆内,散在分布核内,呈棕黄色颗粒或团块,弥漫分布;P53 蛋白表达主要分布在细胞核和细胞质中,呈棕黄色颗粒状,图1。

图1 NF-κB 和P53 表达情况
2.2 NF-κB、P53 蛋白在癌、癌旁及正常黏膜组织中的表达 膀胱癌组织的NF-κB 和P53 蛋白阳性率高于癌旁组织和正常黏膜组织,癌旁组织的NF-κB 和P53 蛋白阳性率高于正常黏膜组织,差异均有统计学意义(P<0.05),见表1。
2.3 NF-Kb、P53 蛋白表达与患者临床病理特征的关系 NF-κB 阳性表达与膀胱癌患者肿瘤病理分级存在相关性,高级别膀胱癌(G2/G3)组织中NF-κB 阳性率显著高于低级别(G1)肿瘤组织(P<0.05);P53 阳性表达与膀胱癌患者肿瘤分期存在相关性,T2-3期患者阳性率显著高于Tis-1期(P<0.05),见表2。

表1 各组织中NF-κB、P53 蛋白阳性表达情况比较
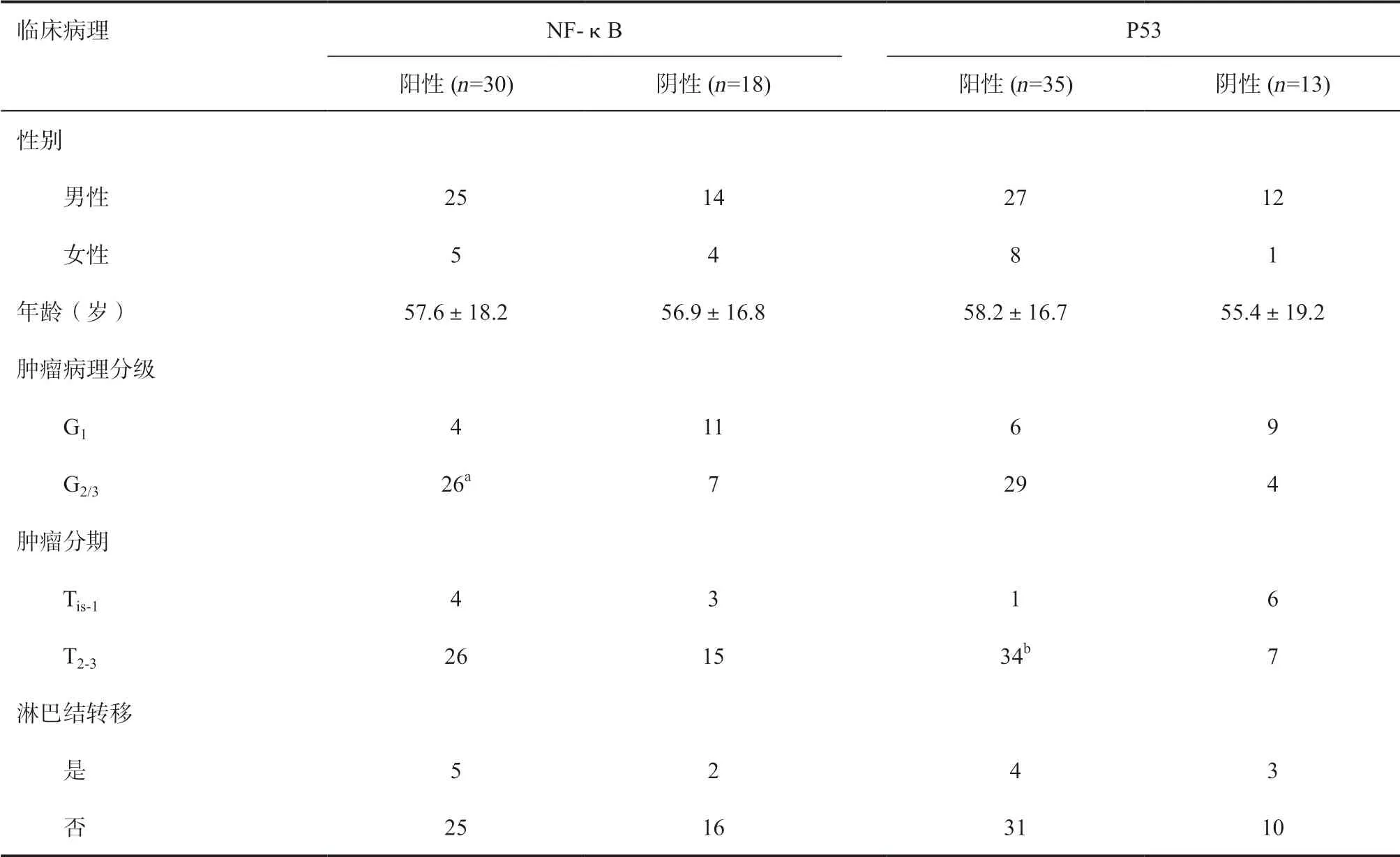
表2 NF-κB、P53 蛋白表达与患者临床病理特征的关系
2.4 蛋白表达表达与DFS 的关系 NF-κB 表达阳性和阴性患者的中位DFS 分别为8.9 个月和30.1 个月,阳性组复发风险显著高于阴性组[HR=2.14,95% CI=1.05 ~4.33 (P<0.05)];P53 表达阳性和阴性患者的DFS 分别为9.2 个月和28.6 个月,阳性组复发风险显著高于阴性组[HR=2.02,95%CI=1.22 ~3.62(P<0.05)],表3,图2。
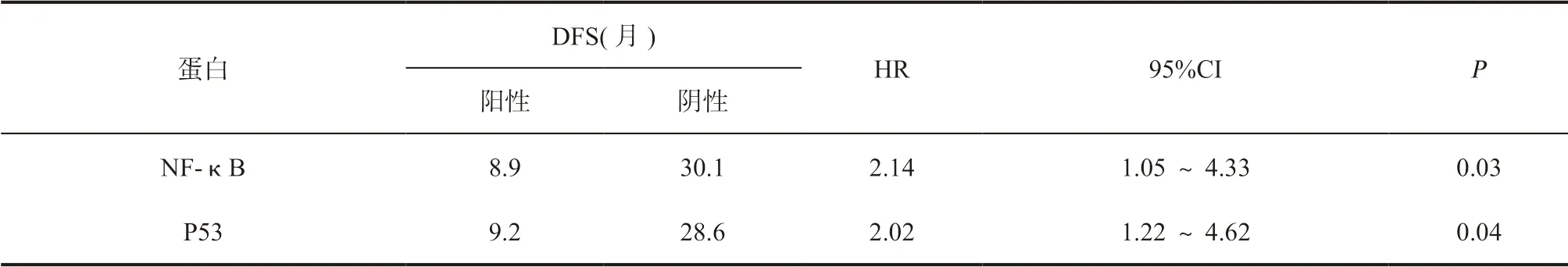
表3 NF-κB、P53 蛋白表达与DFS 的关系
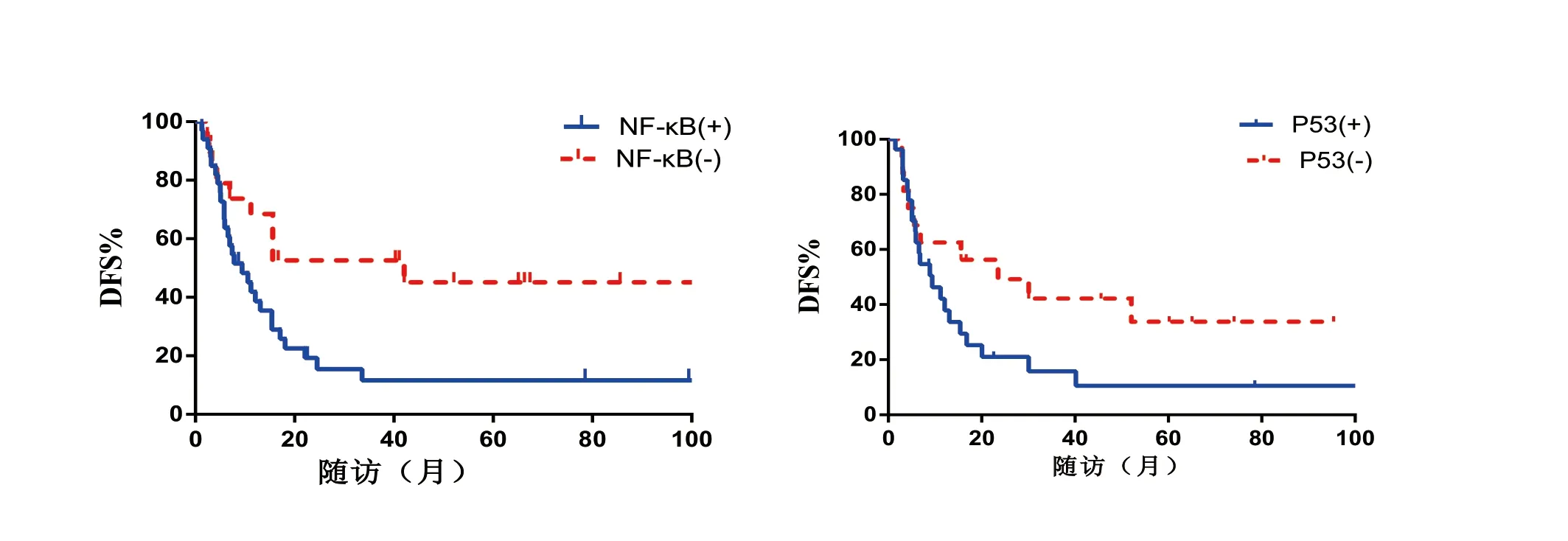
图2 NF-κB、P53 表达与肿瘤复发风险的关系
3 讨论
膀胱癌是我国泌尿系统中最常见的恶性肿瘤[4]。由于其具有多发性、癌旁黏膜存在癌前病变的特点,治疗后的复发率仍高达30%~50%[5-6],给患者及家庭带来极大的健康和生活压力。目前,膀胱癌发生发展的确切分子机制并不十分清晰。近年来的研究显示,DNA 损伤-修复平衡在膀胱癌的发生中发挥重要作用[7-9]。DNA 损伤后的及时修复在维持基因组的稳定性、防止肿瘤的发生起关键作用。有研究报道DNA 损伤反应可通过下面两条途径来监控肿瘤的发生:(1)ATM/CHK2/p53 通路诱导细胞周期停滞、DNA 修复和凋亡;(2)ATM/NKG2DL 通路诱导抗肿瘤免疫。研究认为,实体恶性肿瘤普遍存在p53 基因突变或其他DNA修复、凋亡相关分子功能异常[10-11]。
NF-κB 为一个转录因子蛋白家族,包括5个 亚 单 位:Rel(cRel)、p65(RelA,NF-κB3)、RelB 和p50(NF-κB1)、p52(NF-κB2)[12]。NF-κB 的抑制单位IκB 通过其C 末端特定的锚蛋白重复序列(ankyrin repeat motif)与NF-κB结合,并覆盖NLS 阻止NF-κB 向细胞核内转移。在静息的细胞中,NF-κB 和IκB 形成复合体,以无活性形式存在于胞浆中。当细胞受细胞外信号刺激后,IκB 激酶复合体(IκB kinase,IKK)活化将IκB 磷酸化,使NF-κB 暴露核定位位点。游离的NF-κB 迅速移位到细胞核,与特异性κB序列结合,诱导相关基因转录[13]。已有研究表明[14-15],有多条信号通路参与MICA 的表达调控。对活化的T 淋巴细胞和宫颈癌HeLa 细胞MICA蛋白表达机制的研究发现,MICA 基因第1 内含子含有转录因子NF-κB 结合位点,NF-κB 抑制剂PDTC 能抑制MICA 蛋白表达,而且转染NF-κB基因到HeLa 细胞能上调MICA 表达,表明MICA可能是NF-κB 的靶基因[16]。前面提到,一些DNA 损伤剂可通过ATM 介导的DNA 损伤反应途径上调NKG2DL 表达,而ATM 介导的DNA 损伤反应又可诱导NF-κB 活化[17],因此,笔者推测NF-κB 可能是联系DNA 损伤反应和MICA 表达的中介分子。ATM 诱导NF-κB 活化的信号通路已基本清楚,探讨ATM/NF-κB 通路对MICA表达的调控作用将为监控膀胱癌的复发和进展提供新靶点。可溶性MICA 蛋白(sMICA)形成是肿瘤实现免疫逃逸的新机制,患者血清和尿液中sMICA 是否可作为新的膀胱癌标志物也是值得探讨的问题。另有NF-κB 可以通过与细胞核DNA结合启动某些基因的转录,从而调控细胞的增殖、分化及凋亡[18]。在多种恶性肿瘤细胞如胃癌、肝癌、肺癌、乳腺癌及结直肠癌中均可检测到NF-κB 的异常变动,且其异常表达与肿瘤的预后不良有关。
本研究分析了48 例膀胱癌患者癌组织、癌旁组织和非膀胱癌患者正常尿路黏膜组织中NF-κB和P53 蛋白阳性表达情况,发现癌组织中NF-κB和P53 阳性率显著高于癌旁组织和非肿瘤患者正常膀胱黏膜组织,提示NF-κB 和P53 在膀胱癌的发生发展中可能发挥重要作用。同时本研究还发现NF-κB 与膀胱癌患者肿瘤病理分级有关,高级别膀胱癌(G2/G3)组织中NF-κB 阳性率显著高于低级别(G1)肿瘤组织。而P53 与膀胱癌患者肿瘤分期存在相关性,T2-T3期患者阳性率显著高于Tis-T1 期。提示NF-κB 和P53 的阳性表达可能与肿瘤的恶性程度及侵袭能力有关。但其确切相关性有待进一步的分子生物学实验证实。同时,本研究分析了NF-κB 和P53 蛋白表达与患者DFS 的关系,结果提示NF-κB 和P53 阳性表达组的DFS 显著小于阴性组,说明NF-κB 和P53可作为膀胱癌术后复发预测的潜在分子标志物。

