醒脑静注射液对MCAO大鼠神经功能、神经细胞炎症及氧化应激损伤的影响
王振凤 田克姚 刘南海
[摘要] 目的 研究醒脑静注射液对大脑中动脉阻塞大鼠神经功能、神经细胞炎症及氧化应激损伤的影响。 方法 选择SD雄性大鼠并随机分为SHAM组、MCAO组、醒脑静组,用线栓法建立MCAO模型后,醒脑静组给予醒脑静注射液干预,SHAM组和MCAO组给予生理盐水干预。比较三组间神经功能缺损评分、脑缺血组织细胞凋亡率、炎症指标及氧化应激指标的差异。 结果 MCAO组大鼠的神经功能缺损评分、脑缺血组织细胞凋亡率、脑缺血组织中NF-κB的表达水平和NOX4的表达水平及IL-1β、TNF-α、MMP-9、ICAM-1、ROS、MDA的含量均明显高于SHAM组,T-AOC的含量明显低于SHAM组;醒脑静组大鼠的神经功能缺损评分、脑缺血组织细胞凋亡率、脑缺血组织中NF-κB的表达水平和NOX4的表达水平及IL-1β、TNF-α、MMP-9、ICAM-1、ROS、MDA的含量均明显低于MCAO组,T-AOC的含量明显高于MCAO组。 结论 醒脑静注射液能够改善MCAO大鼠的神經功能,且这一改善作用与神经细胞炎症及氧化应激损伤受抑制有关。
[关键词] 脑梗死;大脑中动脉阻塞;醒脑静注射液;凋亡;炎症反应;氧化应激反应
[中图分类号] R743.3;R741.05 [文献标识码] A [文章编号] 1673-9701(2020)36-0036-04
[Abstract] Objective To study the effects of Xingnaojing Injection on nerve function, nerve cell inflammation and oxidative stress injury(OSI) in rats with middle cerebral artery occlusion. Methods SD male rats were selected and randomly divided into the SHAM group, the MCAO group and the Xingnaojing group. After MCAO model was established by suture-occluded method, Xingnaojing group was given Xingnaojing injection, while Sham group and MCAO group were given normal saline. The neurological deficit score, apoptosis rate of ischemic brain tissue, inflammation index and oxidative stress index were compared among the three groups. Results The neurological deficit score, apoptosis rate, expression levels of NF-κB and NOX4, and contents of IL-1β, TNF-α, MMP-9, ICAM-1, ROS and MDA in MCAO group were significantly higher than those in SHAM group, while the content of T-AOC was significantly lower than that in SHAM group. In the Xingnaojing group, the neurological deficit score, the apoptosis rate in cerebral ischemia tissue, the expression levels of NF-κB and NOX4 in cerebral ischemia tissue and the contents of IL-1β, TNF-α, MMP-9, ICAM-1, ROS and MDA were significantly lower than those in MCAO group. The content of T-AOC was significantly higher than that in MCAO group. Conclusion Xingnaojing injection can improve the nerve function of MCAO rats, and this improvement is related to the inhibition of nerve cell inflammation and OSI.
[Key words] Cerebral infarction; Middle cerebral artery occlusion; Xingnaojing injection; Apoptosis; Inflammatory reaction; Oxidative stress reaction
急性脑梗死是威胁人类健康及生命的常见心脑血管疾病之一,具有较高的致死率和致残率[1-2],探寻能够保护脑组织、减轻神经损伤的药物一直是相关领域的研究热点。醒脑静注射液是根据安宫牛黄丸组方精制而成的静脉注射液,其有效成分包括麝香、冰片、栀子等,现代药理学研究证实,醒脑静注射液中的多种成分具有抗炎、抗氧化等活性,进入体内能够发挥脑保护作用。国内已有临床研究证实,醒脑静注射液用于治疗脑梗死患者能够改善神经功能[3-4],但醒脑静注射液是否在脑梗死的治疗中起到抗炎、抗氧化作用仍未明确。为了探明醒脑静注射液用于脑梗死治疗的价值及分子机制,本研究以大脑中动脉阻塞(Middle cerebral artery occlusion,MCAO)模型大鼠作为实验对象,具体分析醒脑静注射液对MCAO大鼠神经功能、神经细胞炎症及氧化应激损伤的影响,现报道如下。
1 材料与方法
1.1 材料来源
1.1.1 动物 广东省医学实验动物中心采购的SD雄性大鼠作为实验动物,SPF级,体重250~280 g,许可证号SYXK桂2016-0003。
1.1.2 试剂 醒脑静注射液购自河南天地药业公司,TUNEL试剂盒、蛋白裂解液购自上海碧云天公司,Western-blot检测所用核因子-κB(Nuclear factor kappa-B,NF-κB)、NADPH氧化酶4(NADPH oxidase 4,NOX4)第一抗体购自Abcam公司,酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)试剂盒购自上海酶联公司,化学荧光法试剂盒、硫代巴比妥酸法试剂盒、比色法试剂盒购自南京建成研究所。
1.2 方法
1.2.1 动物分组及干预方法 实验动物随机分为SHAM组、MCAO组、醒脑静组,每组各12只。MCAO组和醒脑静组采用线栓法建立MCAO模型:腹腔注射10%水合氯醛麻醉后,仰卧位固定,做颈正中切口后分离右侧颈总动脉(Common carotid artery,CCA)、颈外动脉(External carotid artery,ECA)、颈内动脉(Internal carotid artery,ICA),将ECA用缝线结扎并离断,将CCA的近端结扎,远端用动脉夹夹闭,在CCA的主干做一小切口,将尼龙线栓经切口插入后移去CCA上的动脉夹,将线栓缓慢向内推进,遇到阻力时停止并向后退回约1 mm,剪断血管外的线栓,缝合切口后完成造模。SHAM组按照相同方法麻醉并暴露CCA、ECA、ICA,但不进行结扎、夹闭操作。大鼠苏醒后参照Zea-Longa[5]法,评分1~3分为造模成功。醒脑静组从造模后4 h开始进行药物干预,给予醒脑静注射液(无锡济民可信山禾药业股份有限公司,批号:2017C9E8,5 mL/支)3 mL/kg腹腔注射,每隔半小时1次,连续3次;SHAM组和MCAO组给予生理盐水3 mL/kg腹腔注射,每隔半小时1次,连续3次。
1.2.2 神经功能缺损评分方法 造模后24 h,采用Zea-Longa[5]的5分制评分法进行神经功能缺损的评价,无神经功能缺损为0分,左前肢不能完全伸展为1分,行走时向左侧转圈为2分,行走时向左侧倾倒为3分,意识丧失为4分。
1.2.3 脑缺血组织中细胞凋亡的TUNEL检测 完成神经功能缺损的评价后,处死大鼠并解剖得到缺血部位的脑组织,取适量脑组织制作冰冻脑片,用TUNEL试剂盒中的TUNEL染色液和DAPI染色液进行染色后,在荧光显微镜的高倍视野下进行观察,记录凋亡细胞数和总细胞数后计算细胞凋亡率。
1.2.4 脑缺血组织中基因表达的Western-blot检测 取缺血部位脑组织适量,加入蛋白裂解液后进行超声匀浆,匀浆后的组织悬液在4℃离心机中以12 000转/min的速度离心10 min,取上层澄清的蛋白样本后加入聚丙烯酰胺分离凝膠,电泳后将蛋白样本电转移至PVDF膜;含有蛋白样本的PVDF膜在5%脱脂牛奶中封闭2 h后孵育NF-κB、NOX4的第一抗体、4℃过夜;第2天取出PVDF膜,孵育第2抗体后用ECL显影系统对NF-κB、NOX4的蛋白条带进行显影,计算NF-κB/GAPDH、NOX4/GAPDH的灰度值比值作为蛋白表达水平。
1.2.5 脑缺血组织中细胞因子及氧化介质的试剂盒检测 取缺血部位脑组织适量,加入磷酸盐缓冲液后进行超声匀浆,匀浆后的组织悬液在4℃离心机中以12 000转/min的速度离心10 min,取上清后采用ELISA试剂盒检测白介素-1β(Interleukin-1β,IL-1β)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、基质金属蛋白酶-9(Matrix metalloproteinase-9,MMP-9)、细胞间黏附分子-1(Intercellular cell adhesion molecule-1,ICAM-1)的含量,采用化学荧光法试剂盒检测活性氧簇(Reactive oxygen species,ROS)含量,采用硫代巴比妥酸法试剂盒检测丙二醛(Malondialdehyde,MDA)含量,采用比色法试剂盒检测总抗氧化力(Total antioxidant capacity,T-AOC)含量。
1.3 统计学方法
采用SPSS21.0统计学软件录入数据,三组间计量资料的比较采用方差分析,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
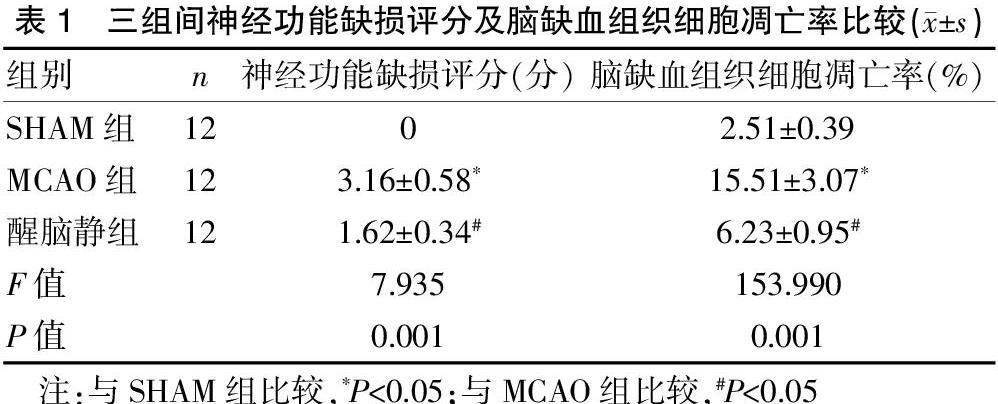
2.1 三组间神经功能缺损评分及脑缺血组织细胞凋亡率比较
MCAO组大鼠的神经功能缺损评分及脑缺血组织细胞凋亡率均明显高于SHAM组,醒脑静组大鼠的神经功能缺损评分及脑缺血组织细胞凋亡率均明显低于MCAO组,三组间神经功能缺损评分及细胞凋亡率比较,差异有统计学意义(P<0.05)。见表1。
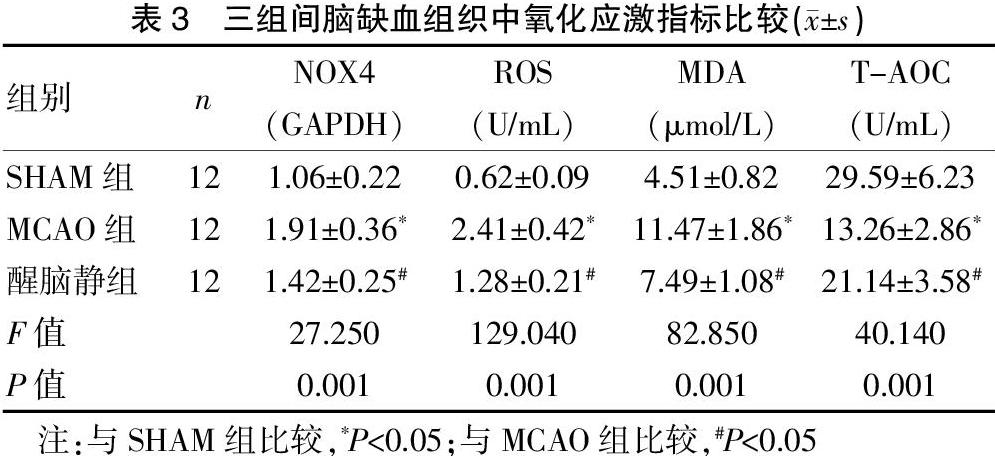
2.2 三组间脑缺血组织中炎症反应指标比较
MCAO组大鼠脑缺血组织中NF-κB的表达水平及IL-1β、TNF-α、MMP-9、ICAM-1的含量均明显高于SHAM组,醒脑静组大鼠脑缺血组织中NF-κB的表达水平及IL-1β、TNF-α、MMP-9、ICAM-1的含量均明显低于MCAO组,差异有统计学意义(P<0.05)。见表2。
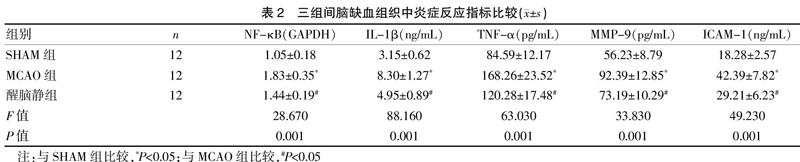
2.3三组间脑缺血组织中氧化应激指标比较
MCAO组大鼠脑缺血组织中NOX4的表达水平及ROS、MDA的含量均明显高于SHAM组,T-AOC的含量明显低于SHAM组;醒脑静组大鼠脑缺血组织中NOX4的表达水平及ROS、MDA的含量均明显低于MCAO组,T-AOC的含量明显高于MCAO组,差异有统计学意义(P<0.05)。见表3。
3 讨论
醒脑静注射液是用于脑梗死[3-4]、脑出血[5]、脑外伤[6]等疾病治疗的中药注射液,其有效成分包括麝香、冰片、栀子等中药材,能够通过介导抗炎、抗氧化以减轻患者神经功能的损伤。为了明确醒脑静注射液用于脑梗死治疗的价值及机制,本研究在建立MCAO大鼠模型的基础上首先观察了醒脑静注射液的神经保护作用。本研究结果显示,MCAO组大鼠的神经功能缺损评分明显升高、醒脑静组大鼠的神经功能缺损评分明显低于MCAO组,提示醒脑静注射液能够改善MCAO组大鼠的神经功能。缺血脑组织中细胞过度凋亡是引起神经损伤的基本病理环节,本研究对MCAO大鼠缺血脑组织中细胞凋亡率的分析显示,MCAO组大鼠脑缺血组织的细胞凋亡率明显升高,而醒脑静组大鼠脑缺血组织的细胞凋亡率明显低于MCAO组,提示醒脑静注射液对MCAO大鼠缺血脑组织中的细胞凋亡具有显著抑制作用,这一结果与醒脑静注射液减轻MCAO大鼠神经损伤的结果一致,共同表明醒脑静注射液具有神经保护作用。
脑梗死部位炎症反应的过度激活是引起神经功能损伤的重要病理环节。动物实验表明,大量炎症细胞在脑梗死周围浸润[7-8]。NF-κB是调节炎症反应的核心转录因子,在生理状态下与抑制因子I-κB结合并处于失活状态;在缺血缺氧等病理因素刺激下,NF-κB表达增多并与I-κB解离,大量游离的NF-κB进入细胞核后启动IL-1β、TNF-α、MMP-9、ICAM-1等炎症基因的表达[9-10]。IL-1β、TNF-α具有促炎活性,能够介导多种炎症细胞发生活化并向炎症部位迁移、浸润[11-12];MMP-9具有水解蛋白质的活性,能够促进炎症细胞破坏血脑屏障并在脑梗死病灶内浸润[13];ICAM-1具有细胞间黏附活性,能够促进炎症细胞向炎症部位的黏附并放大炎症反应[14]。本研究对MCAO模型大鼠脑缺血组织中炎症指标的分析显示,MCAO组大鼠脑缺血组织中NF-κB的表达水平及IL-1β、TNF-α、MMP-9、ICAM-1的含量均明显升高,而醒脑静组大鼠脑缺血组织中NF-κB的表达水平及IL-1β、TNF-α、MMP-9、ICAM-1的含量均明显低于MCAO组。这一结果表明NF-κB介导的炎症反应在缺血脑组织中明显激活,醒脑静对缺血脑组织中NF-κB介导的炎症反应具有抑制作用。
炎症细胞在脑梗死病灶周围的浸润不仅能够通过多种炎症介质的释放来介导脑组织的炎症损伤,还能通过增加自由基的释放来介导脑组织的氧化应激损伤。NOX4是介导自由基生成的重要催化酶,多种炎症细胞能够通过表达NOX4以增加自由基的释放并引起组织发生氧化应激损伤[15-16]。ROS是重要的自由基类型,具有极强的氧化性,与细胞膜、线粒体膜、内质网膜等膜结构中的脂质发生氧化反应,造成膜结构破坏的同时也生成脂质氧化产物MDA,消耗T-AOC[17-19]。本研究对MCAO模型大鼠脑缺血组织中氧化应激指标的分析显示,MCAO组大鼠脑缺血组织中NOX4的表达水平及ROS、MDA的含量均明显升高,T-AOC的含量明显减少,而醒脑静组大鼠脑缺血组织中NOX4的表达水平及ROS、MDA的含量均明顯低于MCAO组,T-AOC的含量明显高于MCAO组。这一结果表明NOX4介导的氧化应激反应在缺血脑组织中明显激活,醒脑静对缺血脑组织中NOX4介导的氧化应激反应具有抑制作用。
综上所述,醒脑静注射液能够改善MCAO大鼠的神经功能并抑制脑缺血组织中NF-κB介导的炎症反应、NOX4介导的氧化应激反应,进而表明醒脑静注射液的神经改善作用与神经细胞炎症及氧化应激损伤受抑制有关。
[参考文献]
[1] Huang D,Refaat M,Mohammedi K,et al.Macrovascular complications in patients with diabetes and prediabetes[J].Biomed Res Int,2017,2017:7839 101.
[2] Moussaddy A,Demchuk AM,Hill MD.Thrombolytic therapies for ischemic stroke:Triumphs and future challenges[J]. Neuropharmacology,2018,134(Pt B):272-279.
[3] 尹楠,唐志鹏,徐国,等. 醒脑静注射液对老年重症脑梗死的疗效及血清VEGF、IL-8水平的影响[J]. 河北医药,2018,40(3):393-396.
[4] 阿布都沙拉木·阿布都热衣木,居来提·艾买提,木胡牙提. 醒脑静注射液联合银杏叶提取物注射液治疗老年急性脑梗死的临床研究[J]. 中国临床药理学杂志,2018,34(11):1282-1284.
[5] Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20:84-91.
[6] 韦文皓,江涛. 醒脑静注射液对高血压脑出血患者脑水肿及外周血炎症介质水平的影响[J]. 川北医学院学报,2018,33(3):347-349.
[7] 周正山,刘德山,袁野,等. 醒脑静注射液对中重度颅脑损伤患者氧化应激的影响[J]. 中医临床研究,2018, 10(11):61-63.
[8] 何霞,崔璨,陈敏. 骨髓间充质干细胞移植对实验性大鼠缺血性脑梗死免疫炎性反应的影响研究[J]. 中国免疫学杂志,2018,34(5):647-652.
[9] 陈宁宁,王建平,刘恒方,等. 骨髓单个核细胞对脑梗死大鼠炎症反应的影响[J]. 中风与神经疾病杂志,2017, 34(4):320-323.
[10] Chen J,Yang C,Xu X,et al. The effect of focal cerebral ischemia-reperfusion injury on TLR4 and NF-κB signaling pathway[J]. Exp Ther Med,2018,15(1):897-903.
[11] Zhao H,Chen Z,Xie LJ,et al. Suppression of TLR4/NF-κB signaling pathway improves cerebral ischemia-reperfusion injury in rats[J]. Mol Neurobiol,2018,55(5):4311-4319.
[12] Chevin M,Guiraut C,Sébire G. Effect of hypothermia on interleukin-1 receptor antagonist pharmacodynamics in inflammatory-sensitized hypoxic-ischemic encephalopathy of term newborns[J]. J Neuroinflammation,2018,15(1):214.
[13] Kim JW,Park MS,Kim JT,et al. The impact of tumor necrosis factor-α and interleukin-1β levels and polymorphisms on long-term stroke outcomes[J]. Eur Neurol,2018,79(1-2):38-44.
[14] Setyopranoto I,Malueka RG,Panggabean AS,et al. Association between increased matrix metalloproteinase-9 (MMP-9)levels with hyperglycaemia incidence in acute ischemic stroke patients[J]. Open Access Maced J Med Sci,2018,6(11):2067-2072.
[15] Wu BN,Wu J,Hao DL,et al. High serum sICAM-1 is correlated with cerebral microbleeds and hemorrhagic transformation in ischemic stroke patients[J]. Br J Neurosurg,2018,4:1-6.
[16] Casas AI,Geuss E,Kleikers PWM,et al. BNOX4-dependent neuronal autotoxicity and BBB breakdown explain the superior sensitivity of the brain to ischemic damage[J]. Proc Natl Acad Sci USA,2017,114(46):12 315-12 320.
[17] Yao H,Ago T,Kitazono T,et al. NADPH oxidase-related pathophysiology in experimental models of stroke[J]. Int J Mol Sci,2017,18(10):E2123.
[18] Forrester SJ,Kikuchi DS,Hernandes MS,et al. Reactive oxygen species in metabolic and inflammatory signaling[J].Circ Res,2018,122(6):877-902.
[19] Chen R,Lai UH,Zhu L,et al. Reactive oxygen species formation in the brain at different oxygen levels:The role of hypoxia inducible factors[J]. Front Cell Dev Biol,2018, 10(6):132.
(收稿日期:2020-10-15)

