原发性泌尿生殖系统淋巴瘤的临床特点分析
王霆钧 叶烈夫 朱庆国


[摘要] 目的 探讨原发性泌尿生殖系统淋巴瘤的临床特点、诊断治疗方法及预后。 方法 收集福建省立医院泌尿外科自2012年1月~2019年6月期间收治的12例原发性泌尿生殖系统淋巴瘤患者的临床资料。 结果 本组病例发病年龄48~84岁,平均(64.4±3.8)岁。临床表现:3例原发性肾上腺淋巴瘤,1例原发性肾脏淋巴瘤,4例原发性膀胱淋巴瘤,以排尿困难、血尿,下腹痛伴尿道刺激症状就诊。本研究纳入病例中10例患者病理报告为:弥漫性大B细胞淋巴瘤(Diffuse large B cell lymphoma,DLBCL),均为非生发中心型(N-GCB)。另外2例病理结果:1例为膀胱黏膜相关淋巴组织淋巴瘤(MALT淋巴瘤),1例采用R-CHOP(利妥昔单抗+环磷酰胺+表阿霉素+长春新碱+泼尼松)方案化疗3个疗程。 结论 原发性泌尿生殖系统淋巴瘤临床表现缺乏特异性,预后较差,误诊率高,影像学检查有助于进一步鉴别诊断,病灶穿刺活检能提供有效病理支持,治疗主张采取手术治疗与全身化疗相结合的方案。
[关键词] 原发性;泌尿生殖系统淋巴瘤;影像学检查;预后
[中图分类号] R733 [文献标识码] B [文章编号] 1673-9701(2020)36-0067-07
[Abstract] Objective To explore the clinical features, diagnosis and treatment methods, and prognosis of primary genitourinary lymphoma. Methods The clinical data of 12 patients with primary genitourinary lymphoma who were admitted to the Department of Urinary Surgery of Fujian Provincial Hospital from January 2012 to June 2019 were collected. Results The age of onset of cases in this group was 48-84 years, and the average age of onset was(64.4±3.8) years. Clinical manifestations were 3 cases of primary adrenal lymphoma, 1 case of primary renal lymphoma, and 4 cases of primary bladder lymphoma. The patients were admitted due to dysuria, hematuria, lower abdominal pain and urinary tract irritation; the pathological reports of 10 patients included in this study were diffuse large B cell lymphoma(DLBCL), all of which were non-germinal centre B cells(N-GCB). Pathological results of the other 2 cases were 1 case with bladder mucosa-associated lymphoid tissue lymphoma(MALT lymphoma), and 1 case receiving R-CHOP(rituximab+cyclophosphamide+epirubicin+vincristine+prednisone) regimen for 3 courses of chemotherapy. Conclusion The clinical manifestations of primary genitourinary lymphoma lack specificity, the prognosis is poor, and the misdiagnosis rate is high. Imaging examination can help further differential diagnosis, and the lesion needle biopsy can provide effective pathological support. The treatment advocates a combination of surgical treatment and systemic chemotherapy.
[Key words] Primary; Genitourinary lymphoma; Imaging examination; Prognosis
泌尿生殖系統淋巴瘤是一种少见的恶性肿瘤,绝大多数为非霍奇金淋巴瘤(NHL),以继发为主,约占90%,原发性泌尿生殖系统淋巴瘤罕见。主要涉及肾上腺、肾、输尿管、膀胱、前列腺、睾丸、阴茎,且不伴有全身其他部位浸润。随淋巴瘤总体发病率上升而呈增加趋势。该病临床表现不典型,容易与相关部位其他恶性肿瘤混淆,误诊率高。本研究收集福建省立医院泌尿外科自2012年1月~2019年6月期间收治的12例原发性泌尿生殖系统淋巴瘤患者的临床资料,包括患者发病情况、临床表现、辅助检查、临床分期及治疗方案,进行回顾性分析研究,探讨疾病的临床特点、合理治疗的策略与影响预后的因素,提高对原发性泌尿生殖系统淋巴瘤的认识,现报道如下。
1 对象与方法
1.1研究对象
收集福建省立医院泌尿外科自2012年1月~2019年6月期间收治的12例原发性泌尿生殖系统淋巴瘤患者的临床资料进行回顾性分析,其中肾上腺3例、肾脏1例、膀胱4例、睾丸3例、精索1例。结合Yasunaga及Fox等提出的原发性肾脏、性腺淋巴瘤诊断标准[1-2],参照2016版世界卫生组织(World Health Organization,WHO)淋巴肿瘤分类方法[3],采用如下纳入标准[3]:(1)病理证实、淋巴瘤局限于肾上腺、肾脏、膀胱或性腺等部位;(2)其他脏器、部位淋巴瘤无累及;(3)外周血及骨髓活组织检查未见异常细胞;(4)至少3个月内未发现其他部位的淋巴瘤。本组病例均符合上述诊断标准。排除不符合上述纳入标准者,合并多种急慢性疾病和免疫系统疾病者,严重精神疾病者[4]。
1.2 资料收集
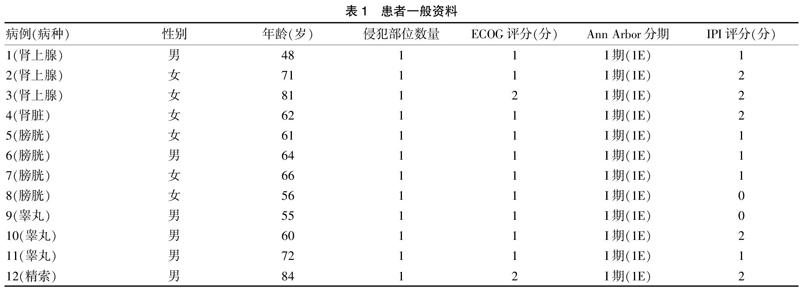
(1)记录以下临床指标:年龄、性别、临床表现包括有无全身症状(又称B症状:发热、出汗或盗汗、体重减轻等)、血清乳酸脱氢酶水平(Serum lactate dehydrogenase,LDH)、患者体能状态(以ECOG评分为指标)(表1)、临床分期(Ann Arbor临床分期)(表2)、国际预后指数(International Prognostic Index,IPI)(表3)及治疗方案。(2)病理检查结果:本研究所有入选的12例患者均经病理检查证实,入选病例中3例肾上腺淋巴瘤、1例肾脏淋巴瘤患者经B超声引导下病灶穿刺获得病理组织;4例膀胱淋巴瘤患者通过膀胱镜取得病理标本;3例睾丸、1例精索淋巴瘤患者通过手术切除病灶送检。
1.3 治疗方法与疗效评价
记录所有入选病例就诊至随访截止时间内所接受的治疗措施,包括手术方式、全身化疗方案及疗程、是否接受鞘内化疗等。按照RECIST标准判定疗效,分为完全缓解(Complete remission,CR)、部分缓解(Partial remission,PR)、疾病稳定(Stable disease,SD)和疾病进展(Progressive disease,PD)。
1.4 随访
通过查阅患者历次住院病历资料、门诊复查和电话询问等方式随访,记录患者的病情转归及生存状态,随访截止至2019年12月31日。总生存(Overall survival,OS)时间指初诊至死亡或末次随访的时间;无进展生存(Progression free survival,PFS)时间指初诊至淋巴瘤复发或进展或至末次随访的时间。
2 结果
2.1 临床特征
2.1.1 一般资料 本研究纳入病例12例,其中肾上腺3例、肾脏1例、膀胱4例、睾丸3例、精索1例,男6例,女6例,男女比例1:1,年龄48~84岁,发病平均年龄(64.4±3.8)岁。所有患者临床分期(Ann Arbor分期)均为Ⅰ期,体能状态评分(ECOG score,ECOG评分)1~2分,国际预后指数(IPI score,IPI评分)0~2分(表1)。可以观察到本组病例好发人群为老年人,分期以早期为主。
2.1.2 病变部位与临床表现 原发性肾上腺淋巴瘤患者临床表现:所有患者患侧腰部均有不同程度不适或疼痛、2例有不明原因乏力、消瘦,1例患者合并B症状,无明显阳性体征,LDH均升高,无肾上腺皮质功能不全症状。肾脏淋巴瘤患者临床表现:左侧腰部闷痛伴有不规则低热,最高38℃,无血尿、尿频、尿急、尿痛、排尿困难及体重减轻,体检未触及肿块,左肾区叩击痛,LDH升高。膀胱淋巴瘤患者临床表现:肉眼血尿、下腹疼痛、尿频、尿急、尿痛3例,排尿困难2例,LDH均正常。睾丸淋巴瘤患者临床表现:所有患者均以患侧阴囊肿胀,睾丸无痛性进行性肿大、沉重感为首发症状,体检患侧睾丸明显肿大,质稍硬,无或轻触痛,LDH升高1例。精索淋巴瘤患者临床表现:左阴囊根部及左腹股沟区疼痛性肿物,无腹痛、血尿,LDH升高。膀胱、睾丸、精索淋巴瘤患者均无发热、消瘦等全身症状(表2)。
2.2 病理类型
本研究纳入病例中10例患者病理报告为:弥漫性大B细胞淋巴瘤(Diffuse large B cell lymphoma,DLBCL),均为非生发中心型(Non germinal centre B cells,N-GCB)。免疫组化表达:Ki67(10%~90%阳性),CD20阳性10例,MUM1阳性9例,Bcl-6阳性8例,Bcl-2阳性4例。另外2例病理结果:1例为膀胱黏膜相关淋巴组织淋巴瘤(MALT淋巴瘤),免疫组化表达:Ki67(30%阳性),CD20、CD5、Bcl-2阳性。另1例为膀胱滤泡性淋巴瘤,免疫组化表达:Ki67(90%阳性),CD20、Bcl-6阳性。所有病例CD10、CK均阴性(表2)。
2.3 影像学表现
(1)B型超声:除外2例肾上腺淋巴瘤患者,其余10例患者行B型超声检查。肾脏淋巴瘤表现:患侧肾脏不均质低回声肿物。膀胱淋巴瘤表现:膀胱壁局部增厚、异常回声,输尿管扩张并异常回声。睾丸淋巴瘤表现:睾丸弥漫性增大、单个或多个局灶性回声减弱。精索淋巴瘤表现:患侧腹股沟不均质回声团块。(2)CT:9例患者行CT检查,其中2例肾上腺淋巴瘤,CT平扫病变区肾上腺实性圆形软组织肿块,边界清,内见斑片状高密度影,CT增强肿瘤实性部分轻度强化;1例肾脏淋巴瘤CT显示左侧肾脏稍低密度占位性病变;4例膀胱淋巴瘤CT表现为膀胱壁弥漫性增厚,占位性病变,膀胱腔变窄;2例睾丸淋巴瘤CT表现为睾丸形态失常,睾丸内软组织密度肿物影,部分边界不清,增强轻-中度强化,见小血管穿行。(3)磁共振成像(Magnetic resonance imaging,MRI):4例患者(1例肾上腺淋巴瘤、2例膀胱淋巴瘤、1例精索淋巴瘤)行MRI检查,双侧肾上腺区见不规则形混杂信号影,T1加权像时多表现为软组织肿块,与后背肌肉相近;T2加权像时信号明显高于肌肉。增强后大多轻度不均匀强化,少數呈中度强化。膀胱淋巴瘤表现膀胱壁不规则增厚伴结节样凸起。精索淋巴瘤表现阴囊内不规则肿块,DWI呈高信号,ADC呈较低信号,增强后不均匀轻/中度强化。(4)PET-CT:本研究4例患者(3例肾上腺淋巴瘤、1例肾脏淋巴瘤患者)行PET-CT检查,2例患者(1例肾上腺淋巴瘤、1例精索淋巴瘤患者)治疗后复查。PET-CT表现:肾上腺区、肾脏软组织肿块影,病灶区放射性异常浓聚。
2.4 治疗及预后
3例肾上腺淋巴瘤患者接受全身化疗,1例采用R-CHOP(利妥昔单抗+环磷酰胺+表阿霉素+长春新碱+泼尼松)方案化疗3个疗程,因严重化疗副反应中断,2例采用R-ECHOP(R-CHOP+依托泊苷)方案分别化疗6和7个疗程,同时配合鞘内注射(甲氨喋呤+阿糖胞苷)预防中枢浸润。1例肾脏淋巴瘤患者接受R-CHOP方案化疗7个疗程。4例膀胱淋巴瘤患者行经尿道膀胱肿瘤电切术(TUR-BT),术后3例患者接受R-CHOP方案分别化疗8、4、6个疗程,1例患者拒绝化疗。3例睾丸淋巴瘤患者行患侧根治性睾丸切除术,术后接受R-CHOP方案分别化疗4、6、8个疗程。1例精索淋巴瘤患者行左精索肿物+左睾丸+左附睾切除术,术后行R-ECHOP方案化疗8个疗程。所有患者均随访4个月~7年,平均随访时间为4.5年,4例完全缓解(CR),6例部分缓解(PR),2例(肾上腺、膀胱淋巴瘤各1例)疾病进展(PD)致死亡,总有效率为83.3%,其中3例患者总生存期(OS)超过80个月(表3)。
3 讨论
3.1 原发性肾上腺淋巴瘤(PAL)
淋巴瘤较少累及肾上腺,PAL更是一种非常罕见的疾病,PAL是恶性度较高的肿瘤,预后差。文献报道近2/3以上病例累及双侧肾上腺,男女均可发病,以中老年男性患者居多,男女比例为2∶1~3∶1,发病平均年龄约66岁[4-5]。本研究60岁以上占2/3,平均发病年龄66.7岁,证实PAL以老年患者为主。
PAL的病因至今仍不明,可能与自身免疫系统紊乱、病毒(EB病毒、JC多瘤病毒、HIV病毒等)感染、p53基因及c-kit基因突变[6,7]等因素密切相关。PAL缺乏特异性的临床表现,最常见的表现为腰背部疼痛或腰部肿块等局部症状,也可出现B症状和体征,约20%患者无任何症状。对照本研究中的3例患者,临床表现亦不典型,2例仅以腰部疼痛为主要表现,另1例伴随发热、盗汗、体重下降等B症状。PAL的临床特征之一可出现肾上腺皮质功能不全[8],多见于双侧肾上腺实质90%以上受累者,表现为血ACTH升高,皮质醇水平的降低,严重者出现ADDISONS病的表现,如食欲减退、恶心呕吐、极度虚弱无力、皮肤和黏膜色素沉着、低钠血症及高钾血症等症状。另外本病还可伴LDH升高,部分病例可出现中枢浸润及相应症状。虽本组患者均未出现肾上腺皮质功能不全及中枢侵犯的临床症状,但所有患者LDH明显升高,最高达987 U/L。
PAL患者超声检查可发现患侧肾上腺不均质低回声肿块,呈圆形或不规则形。PAL的CT检查定位准确,可见肾上腺实质性软组织肿块影,边界清,平扫肿瘤密度均匀,CT值稍低于肝脏密度,增强扫描多数肿瘤呈进行性轻中度强化。MRI具有一定的特征性表现,MRI在T1加权像时呈低信号强度,在T2加权像呈高信号强度[9]。PET-CT检查结果显示,肾上腺或肾上腺区占位伴FDG代谢异常,同时能够排除其他组织器官受累的情况。本组研究的3例PAL患者,2例行CT、1例行MRl检查,见肾上腺区低密度肿块影,增强扫描不均匀强化,3例患者PET-CT上均表现为肾上腺区高代谢团块影。
病理组织学及免疫组化检查是诊断PAL的金标准,通过超声引导下穿刺活检或经手术切除可获得病理组织标本。据报道,PAL病理类型主要为B细胞型NHL,以DLBCL最常见。DLBCL分为生发中心型(GCB)和非生发中心型(N-GCB),以N-GCB常见,免疫组化表型CD10、CD20、Bcl-6多为阳性,N-GCB和增殖性指数Ki67高表达,认为与不良预后相关[10]。本研究3例病理类型属DLBCL,免疫组化亦有相同的表达,分型均为N-GCB型且Ki67表达60~90%,提示预后不良。由于PAL缺乏特异的临床表现,当出现相应的临床症状及影像学特征性改变时,应考虑PAL可能,并配合病理学检查,以做出明确诊断。
结合文献资料,本研究认为PAL病理类型主要为NHL,以DLBCL最常见。PAL预后较差,国内外采用的治疗措施有根治性手术、联合化疗、放疗等,由于PAL发病多为老年患者,早期症状少,发现时往往肿瘤较大,完整手术切除困难。如何选择联合化疗,研究表明R-CHOP化疗方案治疗效果明显,尤其对于老年弥漫大B细胞淋巴瘤疗效更好,2年总生存期(OS)及无进展生存率(PFS)分别为68%和51%[11]。但对于淋巴瘤分期较晚的患者效果欠佳,完全缓解率仅为33%[12]。本研究收集的3例PAL患者均未采取手术治疗,2例PAL患者分别采用联合依托泊苷的R-ECHOP方案化疗6、7个周期,并配合鞘内注射(甲氨喋呤+阿糖胞苷)預防淋巴瘤中枢浸润,取得部分缓解(PR),至今已存活24个月和89个月,另1例PAL患者,采用R-CHOP方案治疗4个周期,因病情进展及严重化疗副反应而死亡。由此可见,手术不是PAL单一的治疗方法,R-ECHOP化疗方案配合预防性鞘内注射能取得较好的效果。
3.2 原发性肾淋巴瘤(PRL)
原发于肾脏的淋巴瘤较为罕见,文献报道PRL多见于中老年人,发病年龄43~79岁,平均63岁,男性略多于女性,约2∶1[13],本组病例与该年龄段相符。
PRL的病因及发病机制尚不明确,可能与以下因素相关:(1)与肾脏慢性炎症有关,有研究认为由于肾脏存在炎性反应,导致淋巴细胞向肾实质浸润,在某些致癌因素作用下,进一步发展为恶性淋巴瘤[14]。(2)肾小囊富含淋巴细胞,此处淋巴细胞的过度增生,并向肾实质浸润,导致PRL发生[15]。
PRL患者早期大多缺乏特异性症状,随病情进展部分患者出现腰部疼痛、无痛性肉眼血尿及B症状,临床报道中,PRL可发生于单侧或双侧肾脏,单侧发病者左侧多于右侧,单侧多于双侧,双侧占10%~20%[13],双侧淋巴瘤患者可能出现肾功能减退或肾功能衰竭。本研究中的一例患者亦发生于左侧,临床表现左侧腰部闷痛伴有不规则低热,LDH明显升高,血生化检查肾功能正常,与报道相符,但未出现肾功能减退表现。
PRL影像学表现缺乏特异性,B超显示患侧肾脏增大,内部回声不均匀的低回声团块,可引导经皮肾穿刺活检为诊断提供病理支持。目前多数临床研究认为CT扫描为首选的影像学诊断手段。CT在显示病变程度、累及范围及远期随访具有一定价值,PRL依据CT表现可分为肾周肿物型、肾内肿物型和肾弥漫增大型[16],本组病例为肾内肿物型。PRL典型的CT影像学表现为均匀等密度或稍低密度肿块,边界不清,增强扫描无明显或轻度强化,特征性表现为:(1)肿瘤向周围生长累及邻近血管时,大多数患者的血管仍保持通畅,血管被推压或移位不明显。(2)弥漫浸润型或肾周肿物型淋巴瘤患者肾脏形态无明显改变[17]。MRI典型表现肿物T1加权像为等或稍低信号,T2加权像为等或稍高信号,呈轻度均匀延迟强化,出现上述影像应考虑PRL可能[18]。PET-CT典型表现为肾脏占位伴FDG异常高代谢,对PRL诊断有较高价值。
PRL病理分型绝大多数为DLBCL,本组病例亦属该类型,为N-GCB,免疫组化有相应的表达CD20、Bcl-6、MUM1阳性,Ki67(10%阳性)。
由于PRL临床表现无特异性,早期诊断较困难,发现上述影像学特征表现时应考虑该病,配合肾穿刺活检以明确诊断。PRL治疗及预后不同于常规肾脏肿瘤,预后较差。现有的共识认为,化疗为PRL的基础治疗。单侧PRL可考虑根治性切除术辅助全身化疗以提高生存率,其预后与病理组织类型、临床分期和治疗方法等因素有关。本研究中该例患者采取超声引导穿刺活检确诊,因拒绝手术,采取R-CHOP联合化疗,第三疗程结束后肿瘤缩小超过50%,取得部分缓解(PR),共进行7个疗程R-CHOP治疗,总生存期(OS)已达86个月,显示手术治疗非唯一途径,R-CHOP方案规范化疗对于控制PRL也具有较好的疗效。
3.3 原发性膀胱淋巴瘤(PBL)
PBL较罕见,其发病率约占膀胱肿瘤的1%。PBL女性患者多见,男女比例为1∶2~1∶3,多为中老年人,好发年龄为40~80岁。本组收集的4例患者,男女比例为1∶3,平均年龄60.7岁,符合中老年人、女性比例大于男性的发病特点。
PBL病因及发病机制,多数的观点认为与慢性膀胱炎症有关,研究发现22%~33%的PBL病例存在慢性膀胱炎病史[19],其机制为慢性膀胱炎症刺激导致膀胱黏膜内淋巴组织增生聚集;也有观点认为淋巴瘤来源于胚胎时期泄殖腔的淋巴组织。PBL可为多发或单发。本组4例患者入院尿常规检查白细胞2+~4+,尿白细胞数、细菌数明显升高,均存在泌尿系感染证据,1例患者膀胱镜亦提示慢性炎性改变,支持PBL与膀胱慢性炎症的相关性推断。
PBL最常见的临床症状为肉眼血尿,尿频、尿急、尿痛等膀胱刺激征,排尿困难及耻骨上区疼痛等。本组病例临床症状相似,2例表现为排尿困难、反复肉眼血尿(占2/4),3例下腹闷痛伴膀胱刺激症状(占3/4),LDH均轻度升高。
PBL超声检查可发现膀胱壁不规则增厚或肿块,多呈实性低回声。CT上最常见表现为膀胱侧壁单发或多发软组织结节或肿块,基底较宽,可因肿瘤累及膀胱壁内外而表现为膀胱壁不规则增厚,增强后病灶明显强化,强化不均匀,有报道认为膀胱壁多发结节为PBL的典型征象。PBL的MRI特征为肿瘤在T1加权呈低信号,T2加权呈高信号。部分病例可显示伴发的肾、输尿管积水征象。膀胱镜检查特点:PBL可发生于膀胱任何部位, 多见于膀胱三角区及输尿管口区域,以膀胱壁弥漫滤泡样隆起或单发和多发的外生性结节为主要表现,肿瘤表面黏膜质地脆,可见溃疡或出血。本组4例患者CT均发现膀胱壁多发不规则增厚,增强扫描强化明显,诊断膀胱癌可能,建议膀胱镜检查,对PBL的确诊有较高参考价值。
PBL最常见的病理类型为DLBCL和黏膜相关淋巴组织淋巴瘤(MALT),MALT淋巴瘤在原发局限性膀胱淋巴瘤中相对常见,本组中DLBCL占2例(占50%),分型为N-GCB,MALT淋巴瘤、滤泡性淋巴瘤(FL)各1例,免疫组化表达为CD20均阳性,与此相符。
PBL的诊断主要依靠临床表现及超声、CT、MRI、膀胱镜等辅助检查,病理结果是关键。PBL均需行全身化疗,治疗方案推荐手术切除联合全身化疗,对于早期较局限的PBL可行TUR-BT,如肿瘤较大可考虑行根治性膀胱切除手术,术后首选CHOP方案,本组4例患者均采取TUR-BT手术,术后3例患者行R-CHOP全身化疗,1例取得完全缓解(CR),2例部分缓解(PR),总有效率为75%,总生存期(OS)为29~66个月。1例患者术后拒绝化疗,于5个月后死亡。由此认为单纯TUR-BT效果有限,手术切除联合R-CHOP全身化疗是治疗PBL较为有效的方法。
3.4原發性睾丸淋巴瘤(PTL)
PTL属原发性结外淋巴瘤,发病率极低,占非霍奇金淋巴瘤的1%~2%、睾丸恶性肿瘤的1%~9%,年发病率约为0.26/10万[18],文献报道多为小例数或个案报道。以老年男性为主,其发病年龄多在60岁以上。本组3例患者平均年龄62.3岁,与之特点相符。
PTL患者多存在睾丸慢性炎症或机体免疫缺陷,其发病可能与慢性睾丸炎、隐睾病、睾丸外伤、精索丝虫病、长期应用免疫抑制剂、人类免疫缺陷病毒感染等因素有关。
PTL多因单侧睾丸的无痛性包块或肿大就诊。PTL以单侧受累多见,双侧睾丸受累者约占20%,35%的患者可出现对侧睾丸侵犯。本组病例中右侧睾丸受累1例、左侧睾丸受累2例。
在PTL检查方法中,超声检查是常用、最重要的影像学检查方法,特征性表现为睾丸弥漫性增大,结节性或弥漫性分布的不均质低回声区,血流信号较正常睾丸组织丰富,血管走向紊乱,呈非分支线性分布,同时可伴有鞘膜积液。CT是评价PTL较好的影像检查方法,CT典型表现为睾丸增大多呈类圆形,密度相对均匀,增强后中度至明显强化,可见小血管穿行。本组3例患者均通过超声检查发现异常,2例患者CT发现阴囊内团块状软组织密度肿物,部分边界不清,增强扫描均匀强化,见多发小血管穿行的特征性改变,为PTL诊断及定位提供了帮助。
DLBCL是PTL最常见的病理类型,本研究中所有的3例PTL患者病理类型均为DLBCL,分型为N-GCB,与相关研究报道结果一致,免疫组化亦有相应表达为Ki67(50%~80%阳性)、CD20、MUM1阳性。
由于PTL临床表现无特异性,当老年患者出现睾丸无痛性、进行性肿大时,结合相应的影像学检查,首先应考虑该病可能。单纯睾丸切除术对于PTL效果欠佳,文献报道,PTL患者单纯行睾丸切除术,5年内复发率超过60%,最常见的复发部位为神经系统和对侧睾丸[19]。鉴于PTL多属于侵袭性NHL,所有患者均推荐全身化疗,但由于存在血睾屏障,化疗药物在睾丸无法达到有效浓度,从而影响化疗效果,因此推荐采用手术联合全身化疗的治疗原则。加拿大癌癥研究中心(BCCA)针对134例睾丸DLBCL患者的一项回顾性研究,通过多因素分析发现使用利妥昔单抗对改善患者的PFS、OS及疾病进展累积发生率均有益。本组3例PTL患者均行睾丸根治性切除手术,术后进行全程规范R-CHOP方案化疗, 2例患者完全缓解(CR),1例部分缓解(PR)。目前3例PTL患者均存活,有效率达100%,其中1例患者OS达80个月。由此认为,睾丸根治性切除手术联合全程规范的R-CHOP化疗,有助于改善PTL患者预后,提高生存率。
3.5 原发性精索淋巴瘤(PLSC)
PLSC是一种罕见疾病,多发于中老年男性。PLSC病因不明,以患侧腹股沟阴囊触及肿块为主要临床表现,部分可伴局部疼痛、坠胀等不适症状,进行性增大,病程较短,多无发热、消瘦等B症状。体检于腹股沟区或阴囊部可触及质硬肿块、无或轻触痛,表面可光滑或呈结节状,透光实验阴性。超声检查可探及实质性、非匀质性低回声肿块。本组1例患者以发现腹股沟-阴囊区疼痛性肿块就诊,LDH显著升高。
PLSC超声检查显示精索周围低回声、微细血管增生组织,增强超声显示明显血管增生。MRI显示,在T2加权像上,睾丸周围的精索血管低密度强化、组织弥漫性浸润,在T1加权像上显示等强度,缺乏脂肪组织,弥漫性加权像上信号强度较高。本例患者超声发现左侧腹股沟低回声肿物,MRI显示阴囊内不规则肿块,不均匀中度强化,均提示肿瘤可能。
PLSC病理类型多为NHL,在国内外文献综述中仅有个别病例报道,多项病例报道PLSC组织病理学和免疫组织学特点以DLBCL为主,本组1例患者病理类型亦为DLBCL,免疫组化表达为Ki67(80%),CD20、MUM1、Bcl-6阳性。
PLSC罕见,术前明确诊断困难,临床上发现腹股沟、精索部位进行性增大的肿块,边界不清,表面不光整,应考虑本病可能。文献报道PLSC患者预后很差。与PTL相似,PLSC有淋巴结和结外模式的进展或复发的倾向。治疗原则建议采用手术、放疗、联合化疗和中枢神经系统预防的治疗方案。本组患者行左精索肿物+左睾丸+左附睾切除术,术后进行规范R-ECHOP方案化疗,疗程结束后,获完全缓解(CR)。定期随访,于2年后复查CT、MRI,未发现病灶的进展复发迹象,总生存期(OS)47个月,显示手术联合规范化疗的治疗方案能取得较好效果。
原发性泌尿生殖系统淋巴瘤较罕见,可发生于肾上腺、肾脏、输尿管、膀胱、睾丸等多个部位,病理分型多数为NHL,以DLBCL最常见。好发于老年人,男性多于女性,预后欠佳。临床表现缺乏特异性,容易与相关部位其他恶性肿瘤混淆,误诊率高,影像学检查可协助鉴别诊断,病理检查是确诊的依据,病灶穿刺活检能提供有效帮助,而PET-CT的应用有助于定位、诊断及疗效判断。治疗策略主张采取手术与化疗相结合的治疗原则。所有患者均推荐全身化疗,R-CHOP是有效的化疗方案。对于不能耐受或拒绝全身化疗的患者,单纯手术治疗虽然效果欠佳,但仍可作为一种有效的治疗手段。
[参考文献]
[1] Swerdlow SH,Campo E,Pileri SA,et al. The 2016 revision ofthe World Health Organization classification of lymphoidneoplasms[J]. Blood,2016,127(20):2375-2390.
[2] Yuan L,Sun L,Bo J,et al. Systemic and prophylactic intrathecal chemotherapy for primary adrenal lymphoma:A retrospective study of 20 case reports[J].Medicine,2019, 98(24):e15 662.
[3] Laurent C,Casasnovas O,Martin L,et al.Primary adrenal lymphoma:Presentation,management and prognosis[J].QJM,2017,110(2):103-109.
[4] Lages ADS,Bastos M,Oliveira P,et al.Diffuse large B-cell lymphoma of the adrenal gland:A rare cause of primary adrenalinsufficiency[J].BMJ Case Rep,2016.
[5] 李忠学,俞璐,杨柳飞,等原发性肾上腺淋巴瘤的CT,MRI表现[J].实用放射学杂志,2016,32(8):1317-1319.
[6] Lu TX,Miao Y,Wu J Z,et al.The distinct clinical features andprognosis of the CD10(+)MUM 1(+)and CD10(+)Bcl6(-)MUM I(-)diffuselarge B-cell lymphoma[J].Sci Rep,2016,6:20 465.
[7] 蔡蓉,史倩云,冯潇,等.肾上腺弥漫大B细胞淋巴瘤6例临床病理分析[J].临床与实验病理学杂志,2016,32(4):400-404.
[8] Erdogmus S,Akturk S,Kendi CZ,et al. Diffuse large B-Cell lymphomapresenting with bilateral renal masses and hematuria:A case report[J]. Turk J Haematol,2016,33(2):159-162.
[9] Shetty S,Singh AC,Babu V. Primary renal lymphoma-a case report and review of literature[J]. J Clin Diagn Res,2016,10(9):XD05-XD07.
[10] Raspollini MR,Castiglione F,Martignoni G,et al.Multiple and bilateral kidney tumors with clear cells of three different histotypes:A case report withclinicopathologicand molecular study[J].APMlS,2016,124(7):619-623.
[11] 李明全,王巖,娄晓宇,等.原发性肾脏淋巴瘤的MRI特征[J].放射学实践,2016,31(3):258-261.
[12] Gupta NK,Pal DK. Systemic non-Hodgkins lymphoma initially presenting as a bladder mass[J].Urology Annals,2017,9(3):285-287.
[13] Horasanli K,Kadihasanoglu M,Aksakal OT,et al.A case ofprimarylymphoma of the bladder managed with muhimodal therapy[J].Nat Clin Pract Urol,2008,5(3):167-170.
[14] Kim JH,Shim JS,Noh TI,et al.Concurrent bladder lymphoma and bladder cancer presenting as metastatic bladder cancer[J].World J Mens Health,2012,30(2):141-145.
[15] Ahmad SS,Idrisy SF,Follows GA,et al. Primary testicular lymphoma[J].Clin Oncol (R Coll Radiol),2012,24(5):358-365.
[16] Cheah CY,Wirth A,Seymour JF.Primary testicular lymphoma[J].Blood,2014,123(4):486-493.
[17] Shi YK,Sun Y,Liu TH. Diagnosis and treatment of malignantlymphoma in China(2015 edition)[J]. Chin J Oncol,2015,37(2):48-58.
[18] 程丽,徐凯,汪秀玲,等.原发性睾丸淋巴瘤的MSCT诊断及鉴别诊断[J].实用放射学杂志,2018,34(7):1063-1065,1102.
[19] Kridel R,Telio D,Villa D,et al. Diffuse large B-cell lymphoma with testicular involvement:Outcome and risk of CNS relapse in therituximab era[J].Br J Haematol,2017, 176(2):210-221.
(收稿日期:2020-10-12)

