精子Tektin-2基因单核苷酸多态性与特发性弱精子症的相关性研究
李伟伟,李丽玮*,闫娅妮,刘茶,刘聪,殷秀荣,胡悦
(1.秦皇岛市妇幼保健院生殖医学科,秦皇岛 066000;2.秦皇岛市妇幼保健院检验科,秦皇岛 066000;3.秦皇岛市第一医院男性不育科,秦皇岛 066000)
不孕症是一个全球性问题,不孕夫妇的比例在全世界人口中达到15%。在所有的不孕因素中,男性因素约占50%[1]。近50%的不育夫妇和大约90%的不育男性中存在四种主要精液异常,包括无精子症、少精子症、弱精子症和畸形精子症[2]。在这些病例中,弱精子症是男性不育的主要原因之一,仅次于少精子症[3]。弱精子症可以作为一种独立的疾病存在,也可能与其他精子异常相关或作为综合征的一部分存在。弱精子症是精子浓度≥15×106/ml而精子前向运动(PR)<32%。临床上将病因不明或者发病机制不清楚的弱精子症称为特发性弱精子症。临床治疗特发性弱精子症无法采取有效的措施,治疗效果不理想。因此很多特发性弱精子症的患者只能依靠辅助生殖技术。因此深入研究特发性弱精子症的发病机制,会为临床治疗弱精子症提供有力的依据。
精子运动相关蛋白包括离子通道、细胞骨架蛋白、细胞信号蛋白及糖酵解蛋白等,研究表明这些蛋白在精子的运动中必不可少。Tektins蛋白包括Tektin-1、Tektin-2、Tektin-3、Tektin-4、Tektin-5,是一组微管相关的细胞骨架蛋白[4]。这些蛋白主要存在于雄性生殖细胞的中心粒、纤毛鞭毛的微管蛋白。国内已有相关报道证明Tektins与弱精子症相关[5-6],国外学者Tanaka等[7]也报道Tektin-2在弱精子症者中表达下降。有学者克隆了人类Tektin-2基因,在睾丸中显示出特异性表达,并且精确定位于成熟精子的鞭毛中[8]。这种蛋白质的定位及其与精子运动的关联使其成为研究弱精子症病因的良好候选基因。但是目前缺乏关于Tektin-2的多态性与弱精子症的相关性的研究。秦皇岛身处京津冀地段,是环渤海地区重要港口城市。因此我们在秦皇岛妇幼保健院生殖中心和秦皇岛市第一医院男性不育科选取192例特发性弱精子症患者作为弱精子症组、208例精子活力正常的不育男性(女方无不孕症相关疾病)作为不育症组和213例精液正常的已生育男性作为正常对照组,研究Tektin-2的多态性与秦皇岛地区特发性弱精子症的相关性。
资料和方法
一、研究对象及分组
2017年5月至2019年8月期间从秦皇岛市妇幼保健院生殖医学科、秦皇岛市第一医院男性不育科首次接受不孕症咨询并登记的夫妇中招募了192例特发性弱精子症的男性伴侣作为弱精子症组。另募集208例精子活力正常的不育症男性作为不育症组,213例年龄相当的可育健康男性(至少生育一个孩子)作为正常对照组。
纳入标准:所有研究对象均为秦皇岛本地人,并且从出生至纳入研究时一直生活在秦皇岛;男方患者年龄均在23~44岁之间。弱精子症组:男方未生育,精子浓度≥15×106/ml,前向运动精子<32%;不育症组:男方未生育,精子浓度≥15×106/ml,前向运动精子≥32%;正常对照组:男方已生育,精子浓度≥15×106/ml,前向运动精子≥32%。
排除标准:男方患有已知疾病如隐睾症、睾丸炎、附睾炎、精索静脉曲张、输精管阻塞、及内分泌性腺功能减退,核型异常和Y染色体微缺失也均被排除在研究之外。另外,吸烟、药物滥用及酗酒的患者也不纳入研究。
本研究经秦皇岛市妇幼保健院伦理委员会讨论通过,所有受试者均签署知情同意书。
二、研究方法
1. 精液分析:所有受试者均需要禁欲2~7 d,手淫法留取精液于无菌的取精杯内。由专业技术人员按照第五版WHO标准进行操作,每份精液标本必须重复计数两次,取平均值。
2. 提取基因组DNA:采用精子基因组DNA提取试剂盒(北京百奥森泰)提取人精子的总DNA。步骤如下:吸取液化后的精液(1~3)×106至1.5 ml EP管,加入500 μl Solution A,混匀,12 000 rpm,离心1 min。弃掉上清,重复步骤1一次。弃掉上清,EP管底部留取约50 μl Solution A,用移液器吹打均匀。加入600 μl Solution B和10 μl Solution C,用移液器吹打均匀,50℃~65℃孵育20~30 min。加入等体积的异丙醇,上下颠倒混匀至出现白色絮状物(即精子基因组DNA)。用移液器将白色絮状物吸入到提前准备好的含有800 μl 75%酒精的EP管中,颠倒数次;12 000 rpm离心1 min,用移液器吸掉上清,室温干燥10~15 min;加入200~800 μl的Elution Buffer,50℃~65℃孵育10 min,用移液器吹打均匀,-20℃保存基因组DNA。
3. 基因组DNA的扩增和位点rs12043423测序:基因组DNA提取后寄送上海生工生物工程有限公司进行SNP的测序。Tektin-2引物序列为:F:5′-CAGAGCAAAATGGACAGGAA-3′;R:5′-TAGCGCTTGTCCCCACTTTA-3′。 应用 DNA作为模板,建立 50 μl 聚合酶链反应(PCR)体系:模板DNA 1 μl、dNTPs 2 μl、10× PCR Buffer 5 μl、正反向引物各2 μl、Taq 酶 0.5 μl,加去离子水至终体积 50 μl。PCR反应条件:95℃预变性3 min,94℃变性30 s、59℃退火30 s、72℃延伸30 s,共35个循环,最后72℃延伸8 min,降至4℃保温。PCR产物均用1%琼脂糖凝胶电泳观察结果。应用美国 ABI310测序仪对纯化后的DNA片段进行测序分型,并用Sequence analysis 软件进行分析。结果比对用SeqMan软件(测序结果见图1)。
4. 蛋白突变的预测:使用PolyPhen-2生物信息程序(http:∥genetics.bwh.harvard.edu/pph2/)进行了错义突变对蛋白质结构和功能的破坏作用的预测。
三、观察/分析指标
患者一般资料(年龄、BMI、精液参数);不同患者组Tektin-2基因rs12043423多态性位点基因型和等位基因频率,分析相关于特发性弱精子症的风险;rs12043423多态性位点与Tektin-2蛋白表达的关系分析。
四、统计学分析
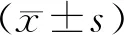
结 果
一、一般资料比较
三组患者间年龄、BMI、精子浓度、正常形态率均无统计学差异(P<0.05)。 弱精子症组精子前向运动率显著低于其他两组(P<0.05)(表1)。
二、Tektin-2基因rs12043423多态性位点基因型和等位基因频率的检测
rs12043423多态性位点测序结果见图1。我们发现Tektin-2基因rs12043423多态性位点在所有研究对象中的分布符合哈迪-温伯格平衡定律(表2);各组的Hardy-Weinberg平衡检验结果分别为:正常对照组(χ2=0.121,P=0.728),弱精子症组(χ2=0.006,P=0.940),不育症组(χ2=0.241,P=0.624)。rs12043423位点的分布在三组中均具有人群代表性。
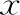
表1 一般资料比较(-±s)
注:与其他两组比较,*P<0.05
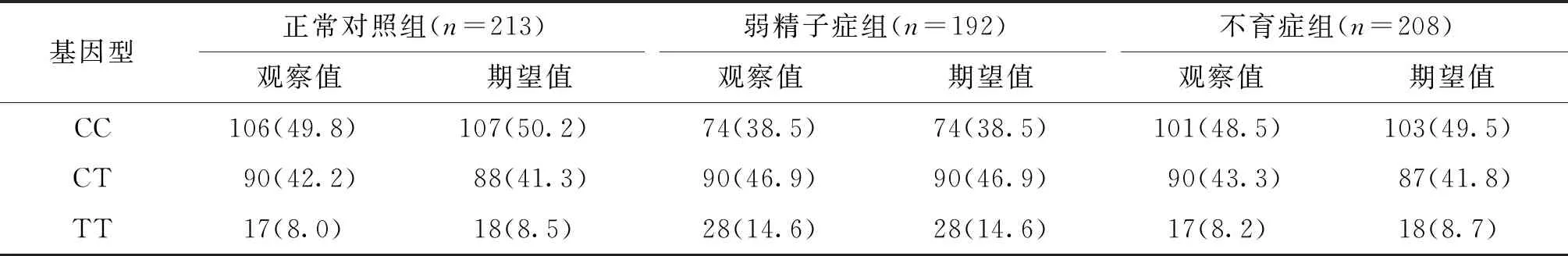
表2 Tektin-2基因rs12043423位点基因型的Hardy-Weinberg平衡检验结果[n(%)]
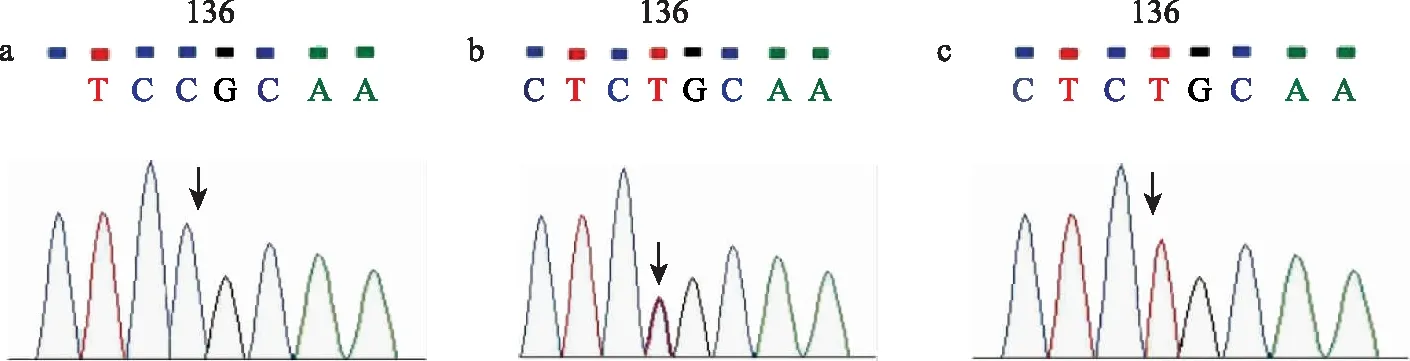
a:CC基因型;b:CT基因型;c:TT基因型;箭头示rs12043423位点第136个碱基的测序结果
经卡方检验,CC和TT在三组间的分布存在显著差异(分别为χ2=6.060,P=0.048;χ2=6.146,P=0.046),而CT在三组间的分布频率无显著性差异(χ2=0.952,P=0.621)。弱精子症组的CC基因型频率显著低于正常对照组及不育症组(P<0.05),而TT基因型频率则显著增加(P<0.05)(表3)。

表3 Tektin-2基因rs12043423(136C>T)的基因型的分布频率[n(%)]
注:与其他两组比较,*P<0.05
弱精子症组C等位基因的分布频率显著低于正常对照组和不育症组,而T等位基因的频率显著高于正常对照组和不育症组(P<0.05)。不育症组和正常对照组比较,不同基因型的分布频率及等位基因的频率在两组间均无显著性差异(P>0.05)(表4)。
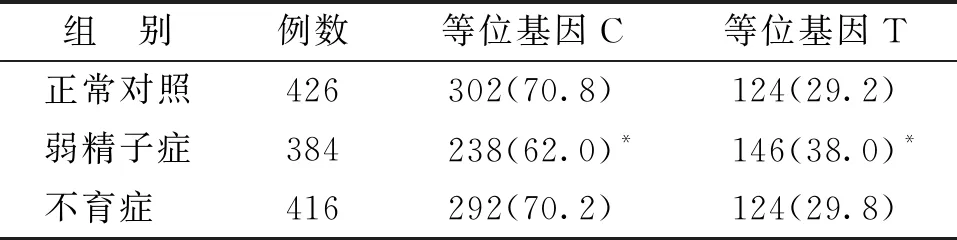
表4 Tektin-2基因rs12043423(136C>T)的等位基因频率的比较[n(%)]
注:与其他两组比较,*P<0.05
三、Tektin-2基因rs12043423多态性位点与特发性弱精子症的危险因素分析
对Tektin-2基因SNP位点单个基因型进行初步分析,以野生型C/C为参照,对杂合型C/T和突变型T/T在正常对照组、不育症组和弱精子症组三组间两两进行χ2检验和发病风险分析。为便于分析,将基因型多态性合并为二分类变量,产生遗传学显性模型、隐性模型和等位基因三种二分类结果,将其与弱精子症的发病风险进行单因素分析。结果表明显性模型的OR值小于1,进一步表明在Tektin-2基因多态性的分布中基因型C/C是特发性弱精子症发病的保护因素,而突变型T/T是特发性弱精症发病的危险因素(表5)。
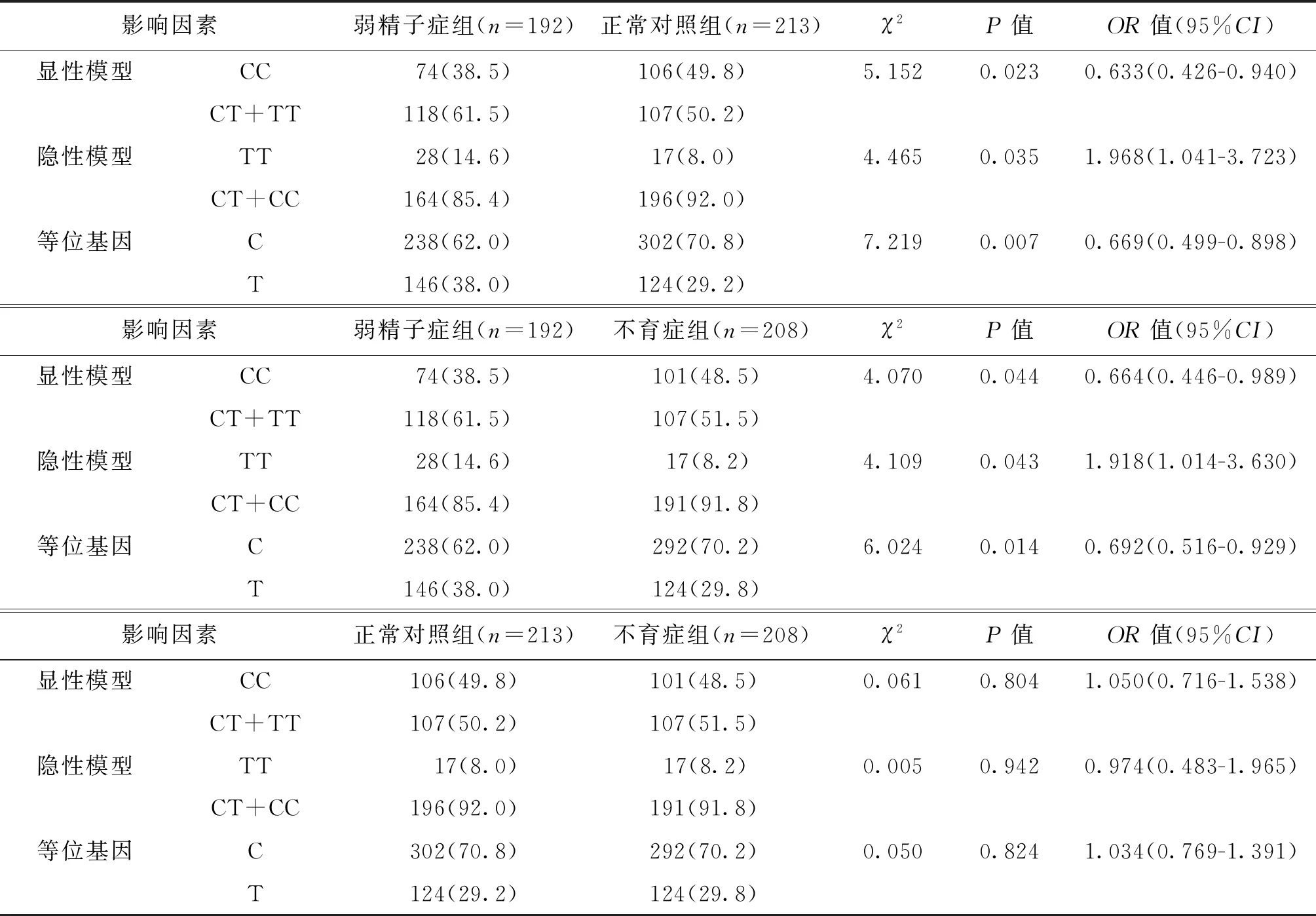
表5 Tektin-2基因rs12043423多态性位点与特发性弱精子症的危险因素分析[n(%)]
四、rs12043423多态性位点与Tektin-2蛋白表达的关系
Tektin-2基因rs12043423位点突变为错义突变,其蛋白质的改变为R46C,我们使用PolyPhen-2分析该变体,结果表明可能具有破坏性(图2)。另外,精氨酸在Tektin-2蛋白的第46位的疏水性与野生型显著不同,并且如果精氨酸被取代可导致蛋白质结构被修饰。
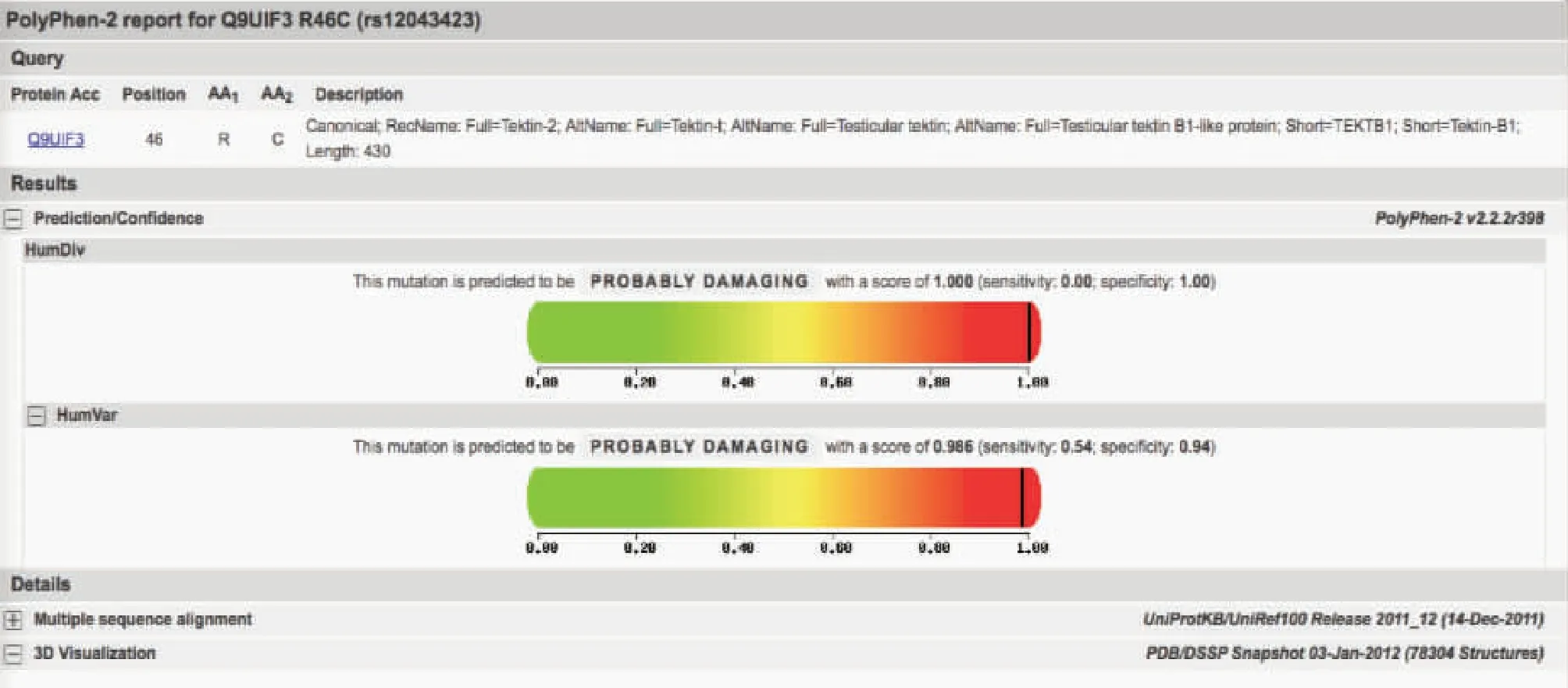
图2 PolyPhen2分析预测Tektin-2蛋白R46C的致病性
讨 论
弱精子症已被确定为男性不育的重要因素之一[9]。染色体异常、微生物感染、内分泌紊乱、精索静脉曲张及自身免疫等因素是弱精子症较明确的发病病因,而精子运动缺陷的潜在分子机制仍在很大程度上不为所知。弱精子症是一种常见于原发性纤毛运动障碍(PCD)的表型,是一种罕见的常染色体隐性遗传疾病,可能导致精子鞭毛的作用受损[10-11]。Tektins是一种高度保守的鞭毛和睫状蛋白家族,在哺乳动物中,Tektins存在于睾丸、脑、视网膜和其他含有纤毛细胞的组织中[12-13]。Tektins是一种不溶性的α-螺旋蛋白,与中间丝(IF)蛋白和核纤层蛋白相关,因此认为Tektins可能在纤毛运动中发挥重要作用[14]。Tektin-2蛋白定位于成熟精子的尾部。其高度保守的序列表明,Tektin-2在鞭毛的形成中具有重要作用[15]。已有研究表明Tektins与弱精子症具有相关性,许祥等[5]研究中证实在弱精子症患者的精子中Tektin-2的表达显著下降。国外学者Bhilawadikar等[16]的研究也表明Tektin-2的水平在活力差的精子中表达显著下降。另外Zuccarello等[17]报道了Tektin-2的A229V位点的多态性可能与弱精子症具有相关性。Zhang等[18]研究了中国四川男性Tektin-2的多态性与弱精子症的相关性,但是国内关于Tektin-2的其他的多态性位点的报道尚少。
单核苷酸多态性(SNP)普遍存在于人类的基因组中,平均每500~1 000个碱基对中就有1个。单核苷酸多态性发生在编码区的概率很小,几乎为周围序列的1/5左右。这种发生在编码区的SNP称为cSNP,主要分两种:一种是同义cSNP(synonymous cSNP),即SNP所致的编码序列的改变并不影响其所翻译的蛋白质的氨基酸序列,突变碱基与未突变碱基的含义相同;另一种是非同义cSNP(non-synonymous cSNP),指碱基序列的改变使得的蛋白质序列也发生改变,从而影响了蛋白质的功能。这种改变常是导致生物性状改变的直接原因。cSNP中约有一半为非同义cSNP。本研究中发现的Tektin-2基因的rs12043423(c.136C>T)即为非同义突变也称错义突变。蛋白质的改变为R46C,精氨酸在Tektin-2蛋白的第46位的疏水性与野生型显著不同,这可能是影响Tektin-2蛋白结构和功能的原因,进而影响精子的活力。
本研究将人群分为弱精子症、不育症和正常对照三组进行比较,发现弱精子症组Tektin-2基因的突变位点rs12043423(c.136C>T)的分布频率与其他两组存在显著差异;而不育症组和正常对照组之间比较,Tektin-2基因的rs12043423(c.136C>T)的分布频率不存在显著差异。弱精子症组rs12043423(c.136C>T)的TT基因型分布频率较正常对照组和不育症组均显著增高(χ2=4.465,P=0.035;χ2=4.109,P=0.043)。结果表明Tektin-2基因的rs12043423位点突变与精子活力相关。正常对照组为精液正常已生育的男性,不育症组为精液正常未生育的男性,两组间Tektin-2基因的rs12043423位点的基因分布频率无显著差异,表明此突变与男性不育不直接相关。
弱精子症组和正常对照组比较,Tektin-2基因突变(杂合子[CT]和纯合子[TT])的发生率分别为61.5%和50.2%;TT基因型与弱精子症的风险因素分析结果为[OR=1.968,95%CI(1.041,3.723),P=0.035],表明这种突变可能是弱精子症发生的可能风险。弱精子症与不育症组比较,Tektin-2基因突变(杂合子[CT]和纯合子[TT])的发生率分别为61.5%和51.5%;TT基因型与弱精子症的风险因素分析结果为[OR=1.918,95%CI(1.014,3.630),P=0.043],同样表明这种突变可能是弱精子症发生的可能风险。
秦皇岛地区地处环渤海,属于暖温带气候,受海洋影响较大。目前,这是秦皇岛地区第一个关于Tektin-2基因的SNP与特发性弱精子症之间关联的研究。本研究结果表明,Tektin-2变体(R46C)可能与特发性弱精子症有关,是弱精子症发病的危险因素。但是由于样本量有限,我们应该进一步扩大样本量分析Tektin-2蛋白的结构和功能,以证明这些变异影响成熟精子的Tektin-2蛋白活性、蛋白质合成和鞭毛损伤。此外,未来的研究包括不同种族和地理来源的受试者,还应进行Tektin-2基因与其他与弱精子症相关的基因的结合分析。

