降调节联合雌孕激素对改善PCOS患者冻融D3胚胎移植临床结局的分析
朱爱珍,王雪松,叶蕾,景霞,王增艳
(1.山西省运城市中心医院生殖医学科,运城 044000;2.广东省广州市中山大学附属第一医院生殖医学中心,广州 510080)
多囊卵巢综合征(PCOS)患者并发卵巢过度刺激综合征(OHSS)的发生率高达20%~30%,PCOS不孕症患者助孕的难题之一是OHSS发生率高。近几年来,对PCOS患者选择全胚冷冻后冻融胚胎移植(FET)可以大大降低重度OHSS的发生率。决定FET成功妊娠的关键因素是合理的子宫内膜准备方案,因此如何为PCOS患者选择适宜的子宫内膜准备方案进行FET成为生殖领域研究热点之一。由于PCOS患者月经不规律,没有自发排卵或者稀发排卵,所以FET周期不适合选用自然周期,临床大多选择激素替代治疗(HRT)人工周期或者促排卵周期。近年来,促性激素激素释放激素激动剂(GnRH-a)垂体降调节后再进行HRT的内膜准备方案(降调节+HRT方案)在FET周期内膜准备方案中应用越来越多。有研究认为GnRH-a垂体降调节可改善子宫内膜容受性[1]。Hill等[2]研究认为GnRH-a降调节联合雌孕激素替代准备内膜在FET中应用,与自然周期比较可以获得较高的临床妊娠率和活产率。张京顺等[3]认为GnRH-a降调节后联合雌孕激素替代准备内膜适用于包括PCOS在内的患者,能改善PCOS患者的FET结局。但降调节+HRT会增加患者的临床花费,目前哪一种内膜准备方案更适宜PCOS患者尚无定论。本研究通过比较单纯雌孕激素替代和降调节联合雌孕激素替代方案准备内膜在PCOS患者中的应用效果,探讨适宜PCOS患者的最佳FET内膜准备方案。
资料与方法
一、研究对象
选择2017年1月至2018年12月在山西省运城市中心医院生殖医学科就诊的75例符合纳入标准的PCOS患者为研究对象,其中有2例患者因出现宫腔积液,3例患者因子宫内膜薄,取消移植未纳入统计分析。最终纳入70例患者(70个周期)的临床资料。纳入标准:(1)按照2004年鹿特丹标准[4]诊断为PCOS;(2)均为第1次移植。排除标准:合并夫妇染色体异常;合并存在子宫畸形和其他子宫基础病变(如子宫内膜异位症、子宫肌瘤、子宫内膜息肉);存在卵巢占位性病变或输卵管积水;合并存在其它内分泌疾病(如甲状腺、肾上腺功能异常等)。
将研究对象按照内膜准备方案的不同分为两组:采用降调节联合雌孕激素替代方案准备内膜的为降调节+HRT组(32个周期),采用雌孕激素替代治疗方案准备内膜的为HRT组(38个周期),比较两组患者的一般资料及妊娠结局。
二、研究方法
1. 内膜准备:HRT组:月经(或撤退出血)第5天开始用雌激素,采用递增方案,即戊酸雌二醇(补佳乐,1 mg/片,拜耳医药,德国)起始剂量为6 mg/d,通过B超检查监测子宫内膜厚度,适当调整药物用量;当超声检查提示子宫内膜厚度≥8 mm时,肌肉注射黄体酮(20 mg/支,浙江仙琚药业)60 mg×3 d行内膜转化。注射黄体酮后第4天,在超声引导下将第3天(D3)胚胎移入宫腔,并继续使用黄体酮及补佳乐。
降调节HRT组:月经(或撤退出血)第3~5天给予GnRH-a(醋酸亮丙瑞林微球,3.75 mg/支,珠海丽珠制药)3.75 mg,注射后28 d开始行HRT(方法同HRT组)。行超声检查提示子宫内膜厚度≥8 mm时,开始转化内膜,肌肉注射黄体酮60 mg×3 d。后续操作同HRT组。
2. 性激素水平测定:采用化学发光法测定月经第2~5天(或撤退出血第2~5天)血清基础性激素水平;孕酮转化日测定E2、孕酮水平。
3. 胚胎解冻及移植:根据玻璃化冷冻操作常规解冻卵裂期胚胎(D3胚胎)。对卵裂期胚胎进行质量评分[11],将胚胎分为4级:1级胚胎:胚胎卵裂球大小均匀,碎片<10%;2级胚胎:卵裂球大小均匀,碎片10%~20%;3级胚胎:碎片20%~50%的胚胎;4级胚胎:碎片>50%的胚胎。定义1级和2级胚胎为优质胚胎。所有患者均移植1~2枚可移植胚胎(1~3级)。
4. 子宫内膜形态分型:A型:三线型,外层和中央强回声线,外层和宫腔中线间为低回声区;B型:中等强度回声,均匀,中线回声断续不清;C型:回声强,无中线回声。
5. 移植结局:在移植后第14天抽血检测HCG水平,血β-HCG>10 U/L为阳性;移植后35 d左右超声可见宫内孕囊及胎芽胎心者为临床妊娠。确认临床妊娠后,递减雌激素。孕激素在妊娠10周时减少,在妊娠12周时停止。超声提示宫腔内见≥3个妊娠囊时,在10周内进行减胎术。
6. 观察指标:一般临床资料,包括患者年龄、体重指数(BMI)、基础性激素水平、不孕年限、移植胚胎数、转化日子宫内膜厚度、E2水平、移植日子宫内膜厚度等;妊娠结局,包括胚胎种植率、临床妊娠率、早期流产率、异位妊娠率等。
三、统计学分析
结 果
一、两组患者的一般资料比较
两组患者的年龄、不孕年限、BMI、基础LH、FSH、E2、睾酮(T)水平及移植胚胎数比较均无显著性差异(P>0.05),组间具有可比性(表1)。
二、两组患者妊娠结局比较
两组患者的胚胎种植率、临床妊娠率、异位妊娠率、早期流产率比较均无显著性差异(P>0.05)。HRT组的补佳乐使用时间及剂量显著高于降调节+HRT组(P<0.05),孕酮转化日内膜厚度及移植日内膜厚度则显著低于降调节+HRT组(P<0.05)(表2)。
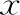
表1 两组患者一般情况比较(-±s)
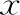
表2 两组患者临床结局比较[(-±s),%]
注:与HRT组比较,*P<0.05。aHRT组有1例患者因内膜厚度不够,加用了阴道芬吗通;降调节+HRT组有5例加用了芬吗通,在比较转化日E2水平时,剔除了两组中该6例患者的数据
讨 论
PCOS患者多表现有内分泌紊乱,LH水平高、雄激素过多、胰岛素抵抗以及糖脂代谢异常等。在诱导排卵周期内,雄激素和抗苗勒管激素(AMH)的分泌增加会影响卵泡的发育。同时,体内LH水平过高会导致子宫内膜过早转化[4],继而引起子宫内膜与胚胎发育不同步,导致胚胎着床率降低。由于PCOS患者不能自发排卵,FET周期倾向于利用人工周期准备内膜[5]。Olivennes[6]发现长效GnRH-a促排卵方案相对于其他促排卵方案,可以获得较高的临床妊娠率和活胎分娩率,这可能与GnRH-a垂体降调节通过抑制垂体分泌内源性雌激素,造成低雌激素状态有关。在PCOS患者中,通过磷脂酶C和腺苷酸环化酶信号通路,高LH水平可激活子宫内膜腺体[7]。GnRH-a降调节联合HRT抑制下丘脑-垂体-卵巢轴,减少LH分泌,且能改善子宫内膜容受性,同时缓解雄激素过多,改善妊娠结局。Groenewoud等[8]研究表明:在FET周期中GnRH-a降调节联合雌孕激素替代方案能获得显著高于自然周期的临床妊娠率和活产率。该结论与Chambers等[9]的结论相似。牛婷等[10]研究认为GnRH-a-HRT组妊娠率高于HRT组。本研究比较了HRT组和降调节+HRT组的临床妊娠率,结果发现降调节+HRT组的临床妊娠率略高于HRT组,但尚无统计学差异,这可能与本研究的样本量较小有关。
子宫内膜容受性是指子宫内膜允许胚胎定位、黏附,并改变子宫内膜间质促进胚胎成功植入的一种状态。“种植窗口”发生在排卵后6~8 d,或受精后5~7 d,这个短暂的窗口期是由卵巢分泌的甾体激素引发的,该过程涉及众多因素的相互作用,如胞饮突、整合素、白血病抑制因子、雌孕激素及其受体等[11]。长效GnRH-a降调节联合雌孕激素替代方案可改善PCOS患者FET的临床结局,可能与子宫内膜中雌激素水平下降有关。有学者指出,GnRH-a处理后血清雌激素水平降低,有利于子宫内膜种植窗口的形成[12],促进胚胎早期种植。但在PCOS患者的FET周期中,采用人工周期雌孕激素替代方案准备内膜对卵泡发育的抑制作用不完全,部分卵泡仍可能分泌雌激素。而长效GnRH-a的应用可以减少内源性雌激素的释放,降低雌激素水平,在体内形成低雌激素环境,更有利于胚胎的种植和植入,继而提高临床妊娠率[13-15]。本研究结果显示,GnRH-a降调节HRT组中孕酮转化日的E2水平明显低于HRT组;孕酮转化日及移植日的子宫内膜厚度均显著高于HRT组;补佳乐使用时间和补佳乐使用剂量亦显著低于HRT组。进一步验证了前述研究的结论。
本研究尚存在以下局限性:首先,作为回顾性研究,患者的选择存在一定偏倚;其次,纳入的样本量较小,研究结果可能存在一定偏倚;最后,研究过程中未收集LH激素水平的变化,可能在机制研究中存在一定缺陷。因此后期尚需进一步增加样本量开展前瞻性研究加以探讨。但本文结果仍为寻找更适合PCOS患者FET周期的内膜准备方案提供了一定数据积累。
综上,本研究结果提示PCOS患者FET周期的内膜准备中,GnRH-a联合HRT方案与HRT方案比较,减少了雌激素的使用时间和使用量,降低了孕酮转化日的E2水平,增加了子宫内膜厚度,亦能获得满意的临床结局。但是,长效GnRH-a的价格相对较高,在一定程度上增加了患者的经济负担。因此,临床上应谨慎合理地掌握临床适应证,以期为患者选择更优的个体化内膜准备方案。

