不育男性抗苗勒管激素与生殖激素及精液质量参数关系的研究
陈伟文,杨龙,吴荣海,黄黎明,陈振翅,黄昌平,徐炜,廖勇彬*
(江门市中心医院1.泌尿外科;2.检验科;3.生殖中心,江门 529030)
男性不育症是一种发病率较高的男科疑难疾病。全球约5%~35%的家庭存在不孕不育问题,其中男方因素约占30%[1]。因此,必须加强男性不育的基础及临床研究。抗苗勒管激素(AMH) 是一种二聚体糖蛋白,由睾丸支持细胞分泌,以旁分泌作用于生精细胞,对生精细胞的成熟分化有着重要作用[2]。胎儿时期,AMH主要抑制苗勒管的发育并使中肾管发育为男性生殖管道[3-4]。目前AMH与性器官发育异常关系比较明确,与男性不育关系是近年研究的热点。因此,本研究探讨精浆和血清AMH与血清生殖激素及精液参数的关系,希望为精液异常所致的男性不育患者的治疗提供参考及帮助。
资料与方法
一、研究对象
选取2018年9~12月来我院生殖中心就诊和咨询的男性不育患者。常规询问患者病史,记录患者不育年限、身高、体重及睾丸总体积;行生殖系统体格检查,测定患者的精液参数,检测其精浆和血清中的AMH,同时检测血清FSH、LH、PRL、T及E2。纳入标准:(1)有规律性生活的男性不育患者;(2)男性性功能正常,可以手淫取精者;(3)对本研究知情同意,能积极配合研究。排除标准:(1)染色体异常、接触有毒、放射性物质患者;(2)既往有隐睾、睾丸扭转、睾丸肿瘤等手术史;(3)近3个月性激素或抗性激素治疗及全身或生殖系统感染患者;(4)患有影响生育的疾病(如尿道下裂、输精管异常、严重的精索静脉曲张、隐睾症、肿瘤等)。
本研究通过江门市中心医院伦理委员会同意批准,所有患者均签署知情同意书。
二、研究方法
1.样本采集:男性在禁欲3~7 d后,于上午(8:00 am~10:00 am)静脉抽血,血标本送检验科测定血清AMH、FSH、LH、PRL、T、E2。患者在舒适环境下使用手淫法采集精液,将精液射入干燥清洁广口器皿,立即送至生殖中心实验室。称重,37℃恒温箱中充分液化,然后进行精液常规及精子质量相关参数分析。用一次性吸头吸取1.5 ml精液,置于7 000 r/min离心机中离心3 min,取上层清液至干洁容器后进行精浆激素AMH测定。
2.激素检测方法:血清和精浆AMH采用AMH试剂盒(批号30151601,罗氏,美国),通过罗氏Cobas e602分析仪电化学发光法检测;血清FSH、LH、PRL、T和E2采用西门子ADVIA centaur XP分析仪直接电化学发光法检测,试剂盒均购自西门子医学诊断产品(上海)有限公司。所有激素项目测定严格按照说明书操作,激素灵敏度、最大浓度、批内变异系数及批间变异系数详细见表1。
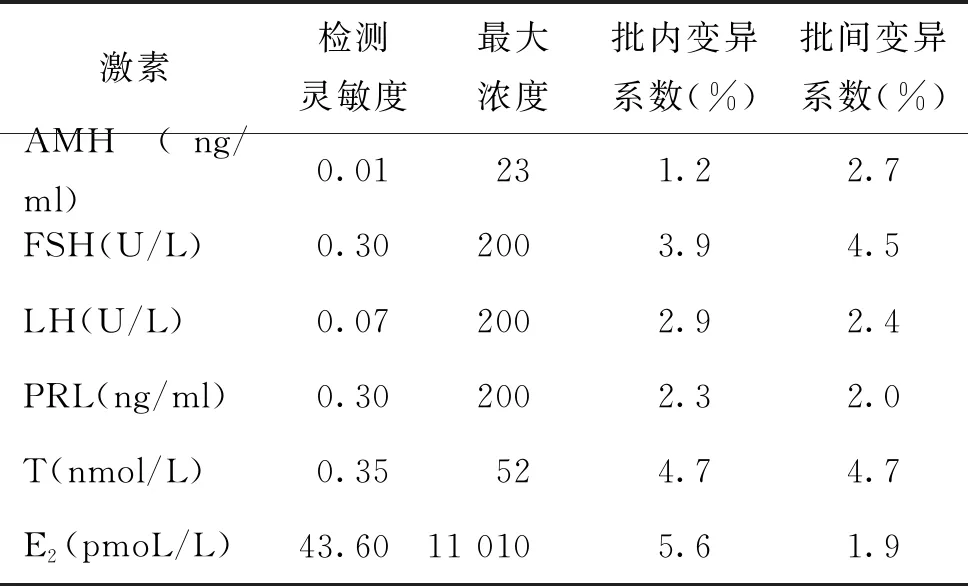
表1 激素检测灵敏度、最大浓度、批内变异系数及批间变异系数
3. 精液参数分析:精液常规利用Sperm Class Analyzer(SCA)运动能力和浓度检测模块进行图像采集和精液分析,参照《世界卫生组织人类精液检查与处理实验室手册(第五版)》(以下简称《WHO-5》)判断检测结果,每一份标本观察10个视野。主要包括精子浓度、前向运动精子(PR)百分比(%)等。精子形态分析根据《WHO-5》形态学严格判读标准及操作程序,采用改良的巴氏染色方法,每次计数200条以上精子,计算精子正常形态率,读片采用人工分析(技师已参加新版手册专业培训);顶体酶采用WHO推荐的改良Kennedy法测定;精子DNA完整性采用吖啶橙染色法。检测试剂盒均购自深圳华康生物医学工程有限公司。
4.分组:参照《WHO-5》标准,根据精液参数分为4组:少精子症组(n=15):精子浓度<15×106/ml,PR>32%;弱精子症组(n=26):精子浓度>15×106/ml,PR<32%;少弱精子组(n=31):精子浓度<15×106/ml,PR<32%;正常精子组(n=35):精子浓度>15×106/ml,PR>32%。
三、统计学分析
结 果
一、一般情况比较
共纳入男性不育患者107例,年龄22~45岁。各组患者间年龄、禁欲天数、精液体积、不育年限、体重指数(BMI)、睾丸总体积等差异均无统计学意义(P>0.05)(表2)。
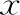
表2 一般情况比较(-±s)
二、血清生殖激素水平比较
单因素方差分析显示,不同组间血清FSH和T水平存在显著性差异(P<0.05),LH、PRL及E2水平则均无显著性差异(P>0.05)。LSD法进行多重比较提示,少弱精子组血清FSH水平显著高于弱精子症组、正常精子组(P<0.05),而与少精子症组无显著性差异(P>0.05),少精子症组、弱精子症组和正常精子组两两比较无显著性差异(P>0.05);正常精子组血清T水平显著高于少精子症组、弱精子症组和少弱精子组(P<0.05),少精子症组、弱精子症组和少弱精子组两两比较无显著性差异(P>0.05)(表3)。
三、血清和精浆AMH的结果分析比较
Kruskal-Wallis多重检验显示,精浆AMH水平组间差异显著(P<0.05),血清AMH水平则无显著性差异(P>0.05)。正常精子组精浆AMH水平显著高于少精子症组、少弱精子组(P<0.05),但与弱精子症组无显著性差异(P>0.05),少精子症组、弱精子症组和少弱精子组两两比较无显著性差异(P>0.05)(表4)。
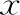
表3 各组血清生殖激素水平比较[(-±s)]
注:采用单因素方差分析LSD法多重比较提示组间差异显著,▲P<0.05;与少弱精子组比较*P<0.05;与正常精子组比较,#P<0.05
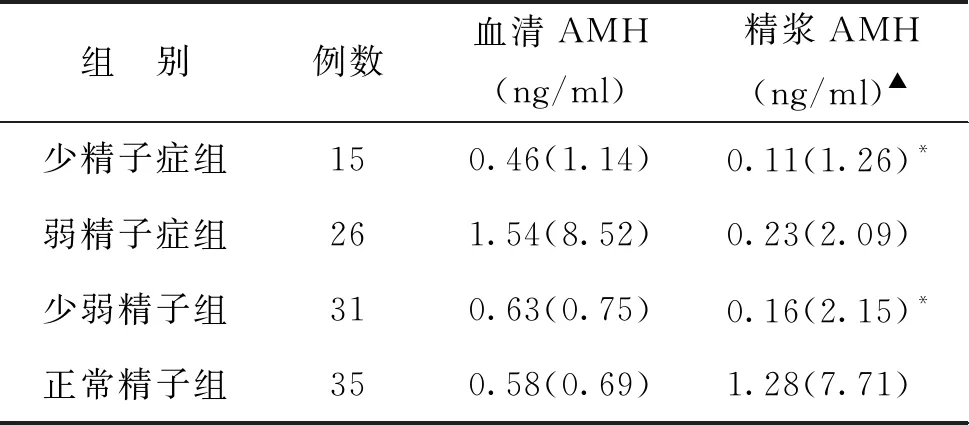
表4 各组血清和精浆AMH的比较[M(QR)]
注:采用Kruskal-Wallis多重检验进行组间多重比较,▲P<0.05;与正常精子组比较,*P<0.05
四、精浆AMH、血清AMH与血清生殖激素的相关性分析
相关性分析显示,血清AMH与精浆AMH无相关性(P>0.05),与血清FSH、LH、PRL、T、E2亦无相关性(P>0.05);精浆AMH与血清FSH、LH呈负相关(P<0.05),与血清T呈正相关(P<0.05),与血清PRL、E2不相关(P>0.05)(表5)。
五、精浆AMH、血清AMH与精液参数的相关性分析
相关性分析显示,血清AMH与精液参数无相关性(P>0.05);精浆AMH与精子浓度、精子总数、PR呈正相关(P<0.05),与精液体积、正常精子形态率、顶体酶活性及精子DNA完整性不相关(P>0.05)(表6)。

表5 精浆AMH、血清AMH与血清生殖激素的相关性分析
注:Spearman相关性分析,*P<0.05

表6 精浆AMH、血清AMH与精液参数的相关性分析
注:Spearman相关性分析,*P<0.05
讨 论
AMH能促进具有分化成输卵管、子宫和阴道上段潜能的男性胎儿苗勒氏管的退化[5],是转化生长因子β(TGF-β)超家族成员之一。在男性胎儿的第8周,睾丸的未成熟支持细胞开始表达分泌AMH,在男性性腺发育及性分化有重要的作用[4]。在未见睾丸的新生儿中,它常常用于鉴别患儿是无睾丸还是隐睾[5-6]。出生后3~12个月的婴儿AMH处于最高水平[7],这可能与支持细胞增殖活跃有关[8];青春期前,由于睾丸支持细胞处于未成熟阶段,体内AMH保持较高水平,生精细胞停留在减数分裂前期。在青春期AMH下降到低水平并保持相对稳定,这可能是由于睾丸间质细胞进一步分化,开始大量分泌T,促进睾丸支持细胞成熟,使生精细胞进入减少分裂,这时T对AMH的抑制大于FSH对其促进作用,最终导致AMH表达迅速下调至婴儿期的3%左右[7,9]。青春期后成年阶段AMH维持在较低水平[10]。生育期AMH水平随年龄的增长而下降[11]。
精子发生是一个激素依赖连续不断增生和分化的过程,主要通过下丘脑-垂体-性腺轴实现。LH作用于睾丸间质细胞(Leydig cells,LCs),促进T的合成。FSH与睾丸支持细胞(Sertoli Cell,SCs)的FSH受体结合,与T共同调节精子的发生[12]。本研究显示FSH与精浆AMH水平呈负相关,这可能在转录因子SOX9、SF1、GATA4以及NF-κB和AP2的作用下,FSH参与激活Gsα蛋白,影响腺苷酸环化酶和蛋白激酶A(PKA)活性进而影响AMH水平[13-15]。本研究发现精浆AMH与LH呈负相关,因为AMH可刺激LH脉冲分泌,AMH变动可引起LH变动[16],也可能通过下丘脑-垂体-性腺轴引起LCs功能失常,导致T生成异常,最终不利于精子发生。本研究观察到精浆AMH水平与血清T呈正相关,这可能是因为血清AMH通过下丘脑中AMH受体的作用,参与到下丘脑-垂体-性腺轴的调节[16],而睾丸局部的AMH通过LCs上的AMH受体对其发挥一定的作用,影响到T的分泌,而T是维持精子发生所必需,通过细胞内雄激素受体(Androgen receptor,AR)介导精子发生过程,在没有T或缺乏功能性AR的环境下,精子发生减少,故AMH可通过影响T水平引起生精障碍。因此,AMH可激活Smad信号通路影响促性腺激素分泌,通过内分泌激素相互作用最终影响生精过程。
SCs产生AMH并能够双向分泌AMH,顶端向生精小管管腔分泌,向基底分泌则进入组织或血液循环,青春期后优先向顶端分泌[9]。由于血睾屏障的存在,使得AMH等大分子物质难以透过屏障而进入血液循环。所以,男性血清AMH与精浆AMH不存在相关性,血清AMH不能很好地预测精子发生[17],与精子质量参数无相关关系(P>0.01)[17-19],本研究也得出类似结果。此外,进入循环的AMH又受到全身性血浆的稀释作用。所以,精子发生过程中精浆AMH水平要明显高于血浆AMH水平[9]。睾丸组织产生的激素随着精液,通过射精由生殖道排出体外,其检测便捷且无创伤。所以探究精浆激素水平,比血清能更好地反映睾丸组织微环境中真实的激素水平状态,能更好地了解睾丸的生精状况,对患者诊治有着重要意义。
Andersen等[19]对94名来自普通人群的志愿者和32名不育男性进行研究发现,精浆AMH与精子浓度、精子总数及PR精子百分率存在相关性(P<0.01)。本研究中,正常精子组的精浆AMH浓度显著高于少精子症组和少弱精子组,且差异有统计学意义(P<0.05);相关性分析发现精浆AMH与精子总数、精子浓度及前向运动呈正相关;与以往报道[17-19]结果相近。Majumdar等[20]通过小鼠实验发现,AMH对胚胎期及出生后小鼠精原细胞的发育有着重要作用。AMH可作用于SCs,并使其产生干细胞因子(stem cell factor,SCF),而SCF又是SCs发育的重要调节因子。SCF通过激活PI3K信号转导途径,进而调节精原细胞的自我更新、增殖和分化。不同浓度的AMH对SCs产生不同效果。Anttonen等[21]使用不同浓度的rh-AMH去处理小鼠SCs,发现10~50 ng/ml低浓度的rh-AMH可通过激活细胞外信号调节激酶(extracellular-signal regulated kinase,ERK)信号转导途径,促使SCs的增殖;然而50~800 ng/ml高浓度的rh-AMH,通过干扰细胞凋亡信号转导通路,使凋亡基因Caspase-3等表达上调和抗凋亡基因Bcl-2表达下调,最终促进了SCs的凋亡。另外,Rehman等[22]也发现低浓度的rh-AMH能够激活丝裂原激活的蛋白激酶(MAPK)家族中非经典ERK信号传导路径,增加SCF mRNA和SCF蛋白表达水平。有研究以重组人FSH治疗特发性少弱畸精症,发现治疗有效患者的精浆AMH基线水平明显高于无效组,治疗后能提高患者AMH,暗示检测精浆AMH能预测患者的药物治疗效果[23]。此外Nery等[24]研究认为精浆AMH还有助于维持精子活力,可以作为评估弱精子症患者冷冻后复苏的精子质量指标之一。
因此,男性不育患者精浆AMH与部分精液参数存在一定的相关性。由于SCs在睾丸结构上起到支持、屏障作用,在功能上起到免疫豁免,以及在精子保护、排出、营养供给方面都起到重要作用,而AMH由SCs产生,并反作用于SCs。在适宜的浓度范围内,随着精浆AMH浓度的升高,精子浓度、PR%等精液参数会随它升高而提高。所以,检测精浆AMH能反映睾丸支持细胞数目及功能状况,一定程度上反映患者睾丸的生精功能。但是,本研究课题仅限于单一中心研究,且样本量较小、研究时间较短,需进一步扩大样本量、多中心、基础及临床研究,探讨精浆AMH与精子质量的关系以及AMH在精子发生中的作用,从而制定合适的医学参考值,指导男性不育诊治工作。

