大鼠脂肪间充质干细胞改善大鼠自体卵巢移植效果
邢彦彦,丁海遐,赵玮,李文*
(1.海军军医大学附属第二医院上海长征医院 生殖中心,上海 200433;2.复旦大学附属金山医院 妇产科,上海 200540)
由于卵巢组织对放化疗极为敏感,肿瘤患者的治疗常影响卵巢结构和功能,导致年轻癌症女性不孕[1]。卵巢自体移植可保存癌症患者女性生育功能,维持性腺内分泌功能,在生育力保存方面有其独特优势[2]。然而,文献研究表明,卵巢移植后卵泡丢失是卵巢移植的主要局限所在[3],严重制约了卵巢移植技术的应用和发展。缺血再灌注损伤是造成移植过程中卵泡丢失的重要原因之一[4]。干细胞在改善缺血性疾病中发挥着重要作用。许多研究人员已经采用脂肪间充质干细胞移植,以减少缺血再灌注损伤对心脏、肾脏、肝脏缺血组织的影响[5-7]。因此,本研究拟通过比较卵巢自体移植组与卵巢自体移植+大鼠脂肪间充质干细胞(Adipose-derived mesenchymal stromal cells,ADMSCs)组中卵巢组织的结构和功能,探究在大鼠卵巢自体移植过程中加入ADMSCs是否会改善大鼠卵巢自体移植效果,提高移植效率。
材料和方法
一、实验动物
8周龄SD雌性大鼠26只,体重180~200 g,由上海市公共卫生临床中心动物实验室提供。大鼠在12 h光照和12 h黑暗循环标准条件下饲养,并在SPF级动物饲养室中给予充足的食物和水。术前阴道涂片均有稳定动情周期。所用动物实验操作均经上海市公共卫生临床中心伦理委员会审查批准(公卫伦审 2019-A018-02)。
二、试剂与仪器
DMEM培养基、胎牛血清、购自美国Gibco公司;干细胞成骨诱导试剂盒、干细胞成脂诱导试剂盒、间充质干细胞检测试剂盒均购自中国赛业生物公司;流式细胞仪(CytoFLEX)购自德国MICROM公司。
三、实验方法
1.实验分组:将大鼠随机分成正常对照组、自体移植组、自体移植+ADMSCs组、去势组(仅用于大鼠血清FSH、AMH水平比较),每组6只。剩余2只用于大鼠脂肪间充质干细胞取材。
2.大鼠脂肪间充质干细胞的分离、培养、鉴定:参考文献[8],从2只供体大鼠腹股沟脂肪中提取脂肪间充质干细胞。大鼠腹股沟脂肪用PBS洗涤后,用剪刀将脂肪组织剪碎,用0.1% I型胶原酶(Gibco,美国)消化60 min,并轻轻搅拌,然后用添加10%胎牛血清(FBS,Gibco,美国)的DMEM培养基进行酶失活并滤除杂质。过滤后,样品在600g下离心5 min,所得沉淀用添加10%FBS和1%双抗的DMEM培养基在37℃、5%CO2恒温培养箱中培养。细胞传代后取第3代细胞通过流式细胞鉴定,使用单克隆抗体抗CD90、CD105、CD34、CD45和CD73抗体(赛业生物)。粘附细胞被固定并悬浮在PBS中(1×106细胞/ml)。PBS洗涤后,用上述单克隆抗体在4℃培养细胞30 min,并用流式细胞仪进行快速分析。取第3代细胞,分别采用成脂诱导分化培养基、成骨诱导培养基进行诱导培养。培养3周后,分别行油红O染色、茜素红染色,观察成脂及成骨效果。
3.卵巢组织自体移植:在自体移植组、自体移植+ADMSCs组,大鼠腹腔注射10%水合氯醛0.3 ml/100 g,备皮消毒后,双侧卵巢切除,将卵巢放置在L15培养基中,去除周围脂肪及输卵管组织,修剪为2 mm×1 mm ×1 mm大小。找出大鼠一侧肾脏组织,将肾被膜撕一小口,将分离好的卵巢组织推入肾被膜下,为防止组织滑脱轻轻将其放置在距离肾被膜切口较远处,同法处理对侧。卵巢移植前,自体移植组在移植部位注入50 μl生理盐水,自体移植+ADMSCSs组注入含有5×104个ADMSCs/50 μl的生理盐水[9](图1)。去势组大鼠行双侧卵巢切除术,正常对照组大鼠做假手术处理。
4.卵巢组织HE染色:术后28 d,自体移植组、自体移植+ADMSCs组大鼠麻醉后取出移植卵巢组织,正常对照组大鼠取出双侧卵巢组织后,取2 mm×1 mm×1 mm大小,多聚甲醛固定,石蜡包埋,连续切片,切片厚度3~4 μm,每个卵巢组织取第5张切片进行HE染色,卵泡计数。并对卵泡种类及形态进行分类,分类标准如下:原始卵泡:指单层扁平或扁平与立方混合的颗粒细胞包绕卵母细胞;初级卵泡:指单层立方型颗粒细胞包绕中间的卵母细胞;次级卵泡:指两层或以上立方型颗粒细胞包绕卵母细胞;窦状卵泡指两层以上的颗粒细胞,卵泡内有窦腔形成;形态正常的卵泡:圆形或椭圆形卵泡形态,颗粒细胞分布均匀,卵母细胞或颗粒细胞未见浓缩核;形态异常的卵泡:卵泡失去圆形或椭圆形结构,卵母细胞形态不规则,核固缩,颗粒细胞排列紊乱、缺失明显或出现核固缩。为了避免重复计数,只有卵母细胞核可见的卵泡被计数在内。
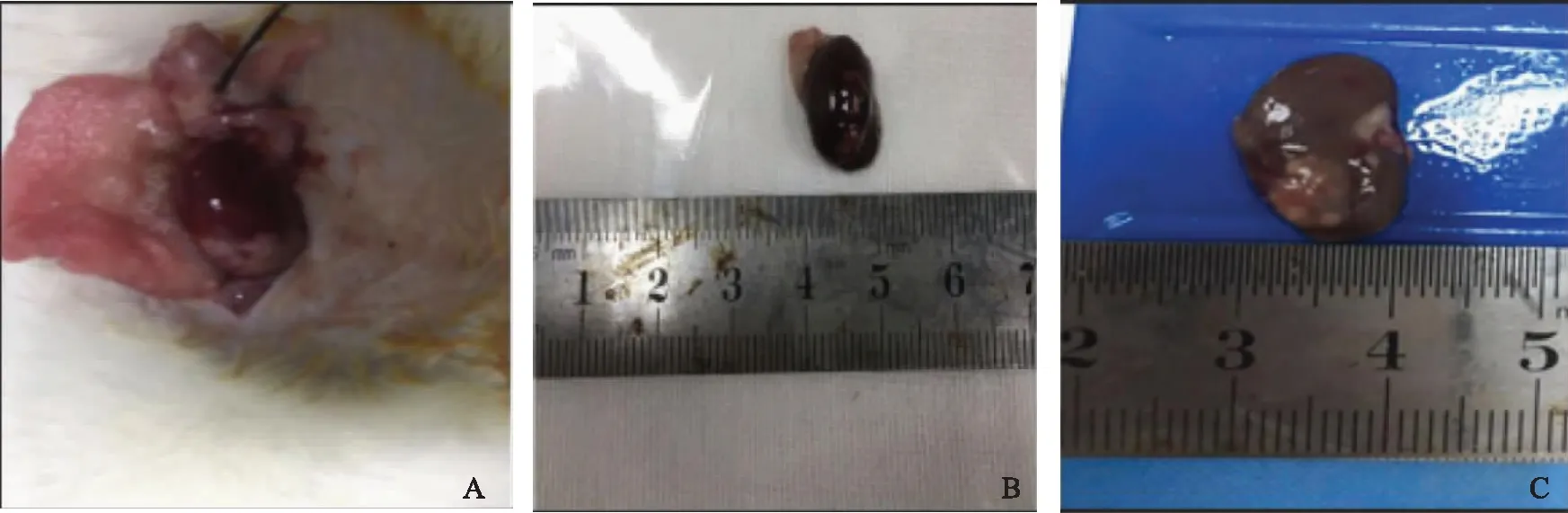
A:卵巢组织移植在肾被膜下;B:自体移植后2 d,卵巢组织充血明显;C:自体移植术后28 d,卵巢组织表面见新生血管
5.TUNEL荧光染色评价细胞凋亡率:卵巢移植后28 d,应用TUNEL荧光染色技术,根据试剂盒(Roche,瑞士)说明书,计算石蜡包埋切片中的DNA损伤率。取各卵巢组织,连续切片,取第4张切片行TUNEL荧光染色,按照试剂盒说明进行检测。荧光显微镜下正常细胞核呈蓝色,凋亡细胞核呈绿色。利用Image Por-plus 6.0图像分析软件计算阳性细胞百分比,即凋亡指数(AI)。
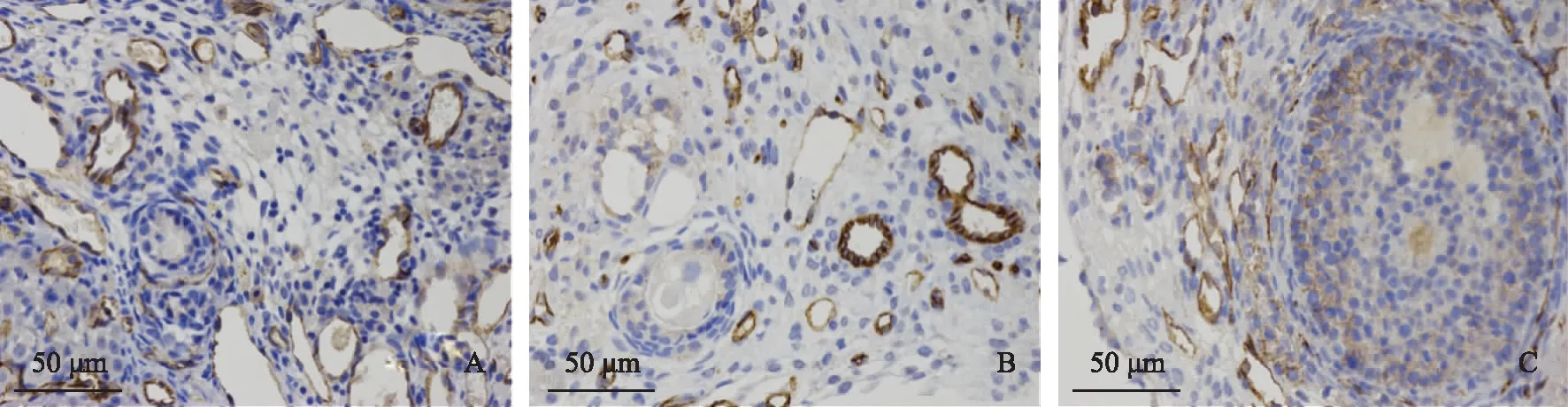
6.CD31免疫组化染色:于移植后28 d取卵巢组织,CD31免疫组织化学染色观察新生血管。取部分切片,梯度乙醇复水,EDTA 抗原修复,山羊血清室温封闭,用PBS冲洗后一抗孵育:滴加 1∶200的大鼠CD31单克隆抗体(武汉赛维尔生物)于切片上,覆盖组织,4℃过夜。二抗孵育:滴加1∶100稀释、HRP标记的山羊抗兔(武汉三鹰生物)工作液孵育,37℃ 30 min,DAB 显色,苏木素复染,脱水,透明,封片。镜下观察,CD31 阳性染色为棕色,高倍镜下观察阳性细胞密度及分布情况。
7.激素水平测定:术前及术后28 d,大鼠内眦静脉取血,4℃、3 000g离心10 min,取上清,ELISA测定血清中FSH、AMH的水平。测定方法及步骤按照ELISA试剂盒(上海西唐生物科技)说明书进行。
8.阴道涂片检查:卵巢移植术后第7天开始,每日用蘸无菌生理盐水的棉签取大鼠阴道涂片,共21次。然后将细胞涂到干净的玻璃载玻片上,在光学显微镜(BX51;Olympus,日本)下放大100倍观察。
四、统计学分析
结 果
一、ADMSCs形态观察及鉴定
流式细胞仪检测显示,从大鼠腹股沟脂肪中分离培养的ADMSCs膜表面黏附分子CD90、CD105、CD73呈阳性,CD34、CD45呈阴性,并且茜素红和油红染色的结果也表明分离的细胞可以分化成成骨细胞和脂肪细胞,提示分离培养的细胞具有多向分化潜能(图2)。
二、卵泡计数
每组12个卵巢组织,每个卵巢组织取第5张切片HE染色后进行卵泡计数。正常对照组、自体移植组、自体移植+ADMSCs组每张切片平均卵数分别为:(32.3±2.9)、(21.5±1.7)、(24.8±1.7)个,自体移植组及自体移植+ADMSCs组的卵泡数均显著低于正常对照组(P<0.05),自体移植组的卵泡数也显著低于自体移植+ADMSCs组(P<0.05)。各组原始卵泡数比较,自体移植组及自体移植+ADMSCs组的原始卵泡数均显著低于正常对照组(P<0.05),自体移植组的原始卵泡数也显著低于自体移植+ADMSCs组(P<0.05)。各组闭锁卵泡数比较,自体移植组及自体移植+ADMSCs组的闭锁卵泡数均显著高于正常对照组(P<0.05),自体移植组的闭锁卵泡数也显著高于自体移植+ADMSCs组(P<0.05)(表1、图3)。
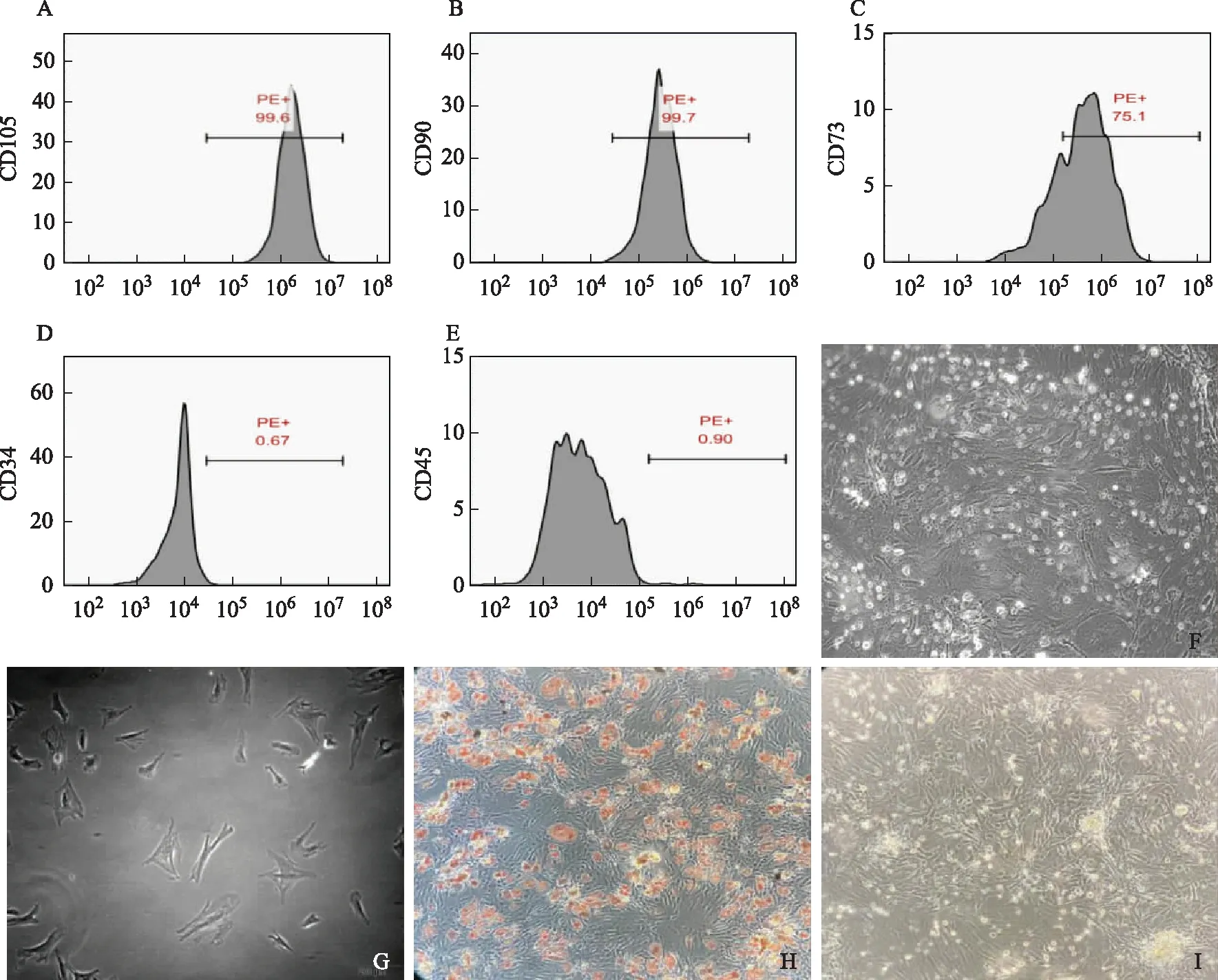
A:CD105;B:CD90;C:CD73;D:CD34;E:CD45;F:原代ADMSCs(×100);G:3代ADMSCs(×200);H:成骨诱导培养3周茜素红染色(×100);I:成脂诱导培养3周油红O染色(×100)
表1 三组卵巢组织HE染色后卵泡数比较(-±s)
注:与正常对照组比较,*P<0.05;与自体移植组比较,#P<0.05
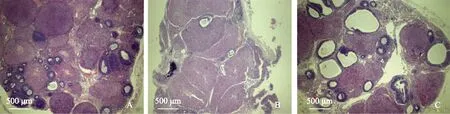
A:正常对照组(×100);B:自体移植组(×100);C:自体移植+ADMSCs组(×100);标尺=500 μm
三、细胞凋亡指数测定
Tunel荧光染色显示,3组均观察到凋亡细胞,以颗粒细胞及卵母细胞凋亡为主(图4)。正常对照组、自体移植组及自体移植+ADMSCs组凋亡指数(AI)分别为(2.8±0.3)%、(14.2±2.8)%、(7.0±0.9)%,3组间两两比较,差异均有统计学意义(P<0.05)。
四、CD31免疫组化染色
移植后28 d取卵巢组织,CD31染色发现,自体移植组CD31阳性细胞主要集中在髓质部分,而自体移植+ADMSCs组CD31阳性细胞主要集中在黄体及窦卵泡和次级卵泡的颗粒细胞层,自体移植+ADMSCs组CD31阳性细胞分布情况与对照组更加接近,而且,自体移植+ADMSCs组CD31阳性密度显著高于对照组(P<0.05)(图5)。
五、血清激素水平
术前3组大鼠血清FSH、AMH测定,两两比较无统计学差异(P>0.05);术后28 d,去势大鼠较自体移植组及自体移植+ADMSCs组大鼠血清FSH值升高,差异均有统计学意义(P<0.05),而AMH降低,差异均有统计学意义(P<0.05)。进一步比较,移植组+ADMSCs组的FSH低于自体移植组,但无统计学差异(P>0.05),自体移植+ADMSCs组AMH显著高于自体移植组(P<0.05)(表2)。

A:正常对照组(×200);B:自体移植组(×200);C:自体移植+ADMSCs组(×200)
A:正常对照组;B:自体移植组;C:自体移植+ADMSCs组;标尺=50 μm
表2 术后28 d大鼠血清FSH、AMH水平及动情周期恢复时间比较(-±s)
注:与去势组比较,*P<0.05;与自体移植组相比,#P<0.05
六、阴道涂片
阴道涂片显示,术后去势大鼠动情周期消失,而自体移植组及自体移植+ADMSCs组大鼠均出现动情周期,表明移植成功。自体移植组大鼠出现动情周期的时间为(12.0±0.8)d,而自体移植组+ADMSCs组为(10.0±0.5)d,差异无统计学意义(P>0.05)(表2)。
讨 论
卵巢组织移植在生育力保存方面有其独特优势[10],如可保存青春期前女性患者的生育功能、可随时进行而不会延迟肿瘤本身的治疗、可保存诸如乳腺癌等激素敏感性肿瘤患者的生育功能、维持女性性腺内分泌功能等[11]。卵巢自体移植过程中伴随着大量的卵泡丢失,原始卵泡数量是卵巢储备功能的主要标志,在移植过程中也有大量减少,严重缩短了移植物寿命[12]。由于移植物重新建立血供需要3~7 d时间,缺血再灌注损伤造成移植卵巢大量卵泡的丢失,因此,如何快速建立移植物血供,是移植成功的关键。
干细胞具有多向分化潜能,在缺血性疾病中应用广泛,目前的研究表明,干细胞通过促进血管形成、减轻缺血再灌注损伤,从而减少细胞凋亡而发挥作用[13-14]。ADMSCs具有来源方便、增殖力强、多项分化潜能及无免疫原性的特点,且研究表明ADMSCs不具有成瘤性,使用安全[13]。参考文献报道[15],我们在大鼠卵巢自体移植使用了最低有效干细胞数量。本研究结果显示,在大鼠卵巢自体移植过程中加入ADMSCs后,移植卵巢组织卵泡总数及原始卵泡数均较自体移植组增多,细胞凋亡减少;CD31染色提示新生血管密度增高,并且CD31阳性细胞分布与对照组更接近;血清学数据显示,自体移植+ADMSCs组及自体移植组与对照组相比,FSH降低,AMH值上升,且差异有统计学意义。并且,阴道图片结果显示,去势组周期消失,而自体移植组及自体移植+ADMSC组大鼠均观察到动情周期,表明自体移植组及自体移植+ADMSC组移植组织存活,移植成功。
总之,本研究结果表明,大鼠脂肪间充质干细胞可增加移植卵巢血管形成,减少细胞凋亡,从而减少卵泡丢失,改善移植卵巢结构和功能,提升移植效率,延长移植物寿命。

