中国明对虾(Fenneropenaeus chinensis)类围食膜蛋白基因克隆及其在WSSV感染中的表达
张广成,尹文娟,刘 芳,何孟宇,孟凡娟,王丽燕
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学天津市动植物抗性重点实验室,天津 300387)
围食膜(peritrophic membrane,PM)是在无脊椎动物肠道内摄入食物的一层半通透性膜状结构[1],主要由蛋白质和几丁质构成[2-4].其功能类似于脊椎动物消化道的黏液层,具有保护中肠上皮细胞免受食物颗粒机械损伤、阻挡病原菌接触上皮细胞造成感染、促进营养物质消化吸收等作用[5-7].围食膜蛋白(peritrophin)是构成围食膜结构的主要蛋白成分,具有一个或多个保守的几丁质Ⅱ型结合结构域(chitin-bindingdomain2,ChtBD2),也称为Peritrophin-A 结构域.围食膜蛋白最先是从昆虫的PM 中解离得到,研究发现围食膜蛋白在辅助消化食物和防控外源微生物对昆虫侵染中都发挥了巨大作用[4,8].近年来研究发现,虾类也具有同昆虫类似的围食膜结构[9-10],它在免疫防病中的功能有待深入研究.
对虾养殖业是世界性海洋生物资源的重要支柱产业,近年来病害频发,严重制约了我国对虾养殖业的可持续发展.在众多细菌与病毒引起的病害中,由对虾白斑综合症病毒(white spot syndrome virus,WSSV)引起的病毒病较为严重.自然养殖条件下,WSSV 病毒病的传播主要是由对虾残食染病对虾或尸体引起,因此,消化道是病毒感染的主要位点.WSSV 病毒分子检测结果同样证实,肠道是感染WSSV 过程中最早可检测到其核酸的组织之一[11-13].
本文通过基因克隆技术获得了中国明对虾(Fenneropenaeus chinensis)的类围食膜蛋白基因FcPT2,研究其在不同组织中的表达及其应对WSSV 感染的表达变化,进而探究类围食膜蛋白FcPT2 在对虾抗WSSV 感染中发挥的作用.研究结果将为深入开展对虾WSSV 病毒性疾病的防控提供基础数据.
1 材料和方法
1.1 材料和试剂
实验所用中国明对虾由中国水产科学研究院黄海水产研究所提供.对虾体长8 cm 左右,在23 ℃条件下,养殖于充气自然海水中,每天喂食3 次,每次喂食5 g 虾饲料.
Unizol 试剂,上海博星基因芯片责任有限公司;MMLV 反转录酶、RQ1 RNase-free DNase 和 nuclease-free water,美国 Promega 公司;DNA 回收试剂盒,生工生物工程(上海)股份有限公司;PMD-19-T 和 DH5α,天根生化科技(北京)有限公司;SYBR Green Master Mix,美国Applied Biosystems 公司.
1.2 实验方法
1.2.1 组织样品制备及WSSV 感染
对实验用中国明对虾进行随机WSSV 检测.取对虾部分鳃组织捣碎,加入90 μL 浓度为50 mmol/L 的NaOH 溶液,煮10 min 后离心取上清液.根据WSSV囊膜蛋白VP28 基因序列设计引物VP28F 和VP28R,如表1 所示,进行一步法PCR 检测.用1%琼脂糖凝胶电泳检测,将结果为阴性的样本作为无WSSV 感染的对照组.分别取5 只无WSSV 感染的对虾各个组织,包括肝胰脏、神经、心脏、鳃、中肠、精巢、卵巢、血细胞、眼柄、胃、淋巴Oka、肌肉,分别保存于液氮中,进行后续RNA 提取、基因克隆和定量PCR 实验.

表1 实验所用引物序列信息Tab.1 Primer sequences used in this study
参照文献[10,14]中的方法准备和提取WSSV.提取的WSSV 拷贝数用PBS 稀释为80 copies/μL,每只虾注射10 μL.注射感染病毒36 h 后,分离提取对虾的消化道组织作为WSSV 感染组,进行RNA 提取和Real-time PCR 实验.
1.2.2 总RNA 提取和cDNA 合成
利用Unizol 试剂提取中国明对虾各组织的总RNA,方法参照使用说明书.提取的总RNA 进行1%琼脂糖凝胶电泳,确认RNA 完整性后,用紫外分光光度计进行定量.反转录前利用RQ1 RNase-free DNase 降解总RNA 中污染的DNA.第一链cDNA 的合成按照M-MLV反转录酶说明书进行,以随机引物合成第一链cDNA,用于实时定量PCR,-80 ℃冰箱保存其余的RNA.
1.2.3 序列分析
根据本课题组所建立的中国明对虾肠道转录组信息和中国明对虾WSSV 感染前后头胸甲转录组信息,发现一条肠道类围食膜蛋白FcPT2 在WSSV 感染前后存在表达差异,利用序列在线比对软件BLASTX(http://blast.ncbi.nlm.nih.gov/blast)分析比对 FcPT2,利用在线SMART 软件(http://smart.embl-heidelberg.de/)分析FcPT2 基因编码氨基酸的结构域特征,利用Clustal W软件进行多序列分析比对.
1.2.4 实时定量PCR(real-time PCR)
以FcPT2 序列设计实时定量PCR 引物RT-FcPT2-F和RT-FcPT2-R.中国明对虾18S rRNA 作为对照基因,设计引物18S-F 和18S-R,如表1 所示.以合成的各组织cDNA 作为模板,不含RNase 的水代替cDNA模板作为阴性对照.
实时定量 PCR 反应物为 25 μL 体系,包含:1UTakara Ex taq hot start、1× Ex taq buffer(plus Mg2+)、0.2 mmol/L的 dNTP、1× SYBR Green Master Mix、0.2 mmol/L 的正向引物、0.2 mmol/L 的反向引物、1 μL cDNA 模板.反应程序设置为:94 ℃预变性 2 min,1 个循环;94 ℃变性 15 s,55 ℃退火 20 s,72 ℃延伸 20 s,40 个循环.反应完成后进行溶解曲线分析,确定只有一条特异性的PCR 产物被扩增.每个实验进行3 次重复,每个样品取自5 只对虾.
利用SPSS 11.0 软件对所得数据进行统计学分析,P<0.05 时差异具有统计学意义.
2 结果与分析
2.1 中国明对虾类围食膜蛋白序列分析
本课题组根据所得中国明对虾肠道的转录组信息,获得了FcPT2 的部分cDNA 序列,如图1 所示.通过Smart 软件在线分析得知,中国明对虾FcPT2 编码的蛋白含有3 个典型的ChtBD2 结构域.通过NCBI Blast 软件对所得基因编码的氨基酸序列进行在线搜索,结果如图2 所示.由图2 可以看出,FcPT2 与昆虫的围食膜蛋白 TcCPAP3-D2、ApCPAP3-D2 和 NvCPAP3-D2 具有较高相似性,分别为74%、74%和71%.
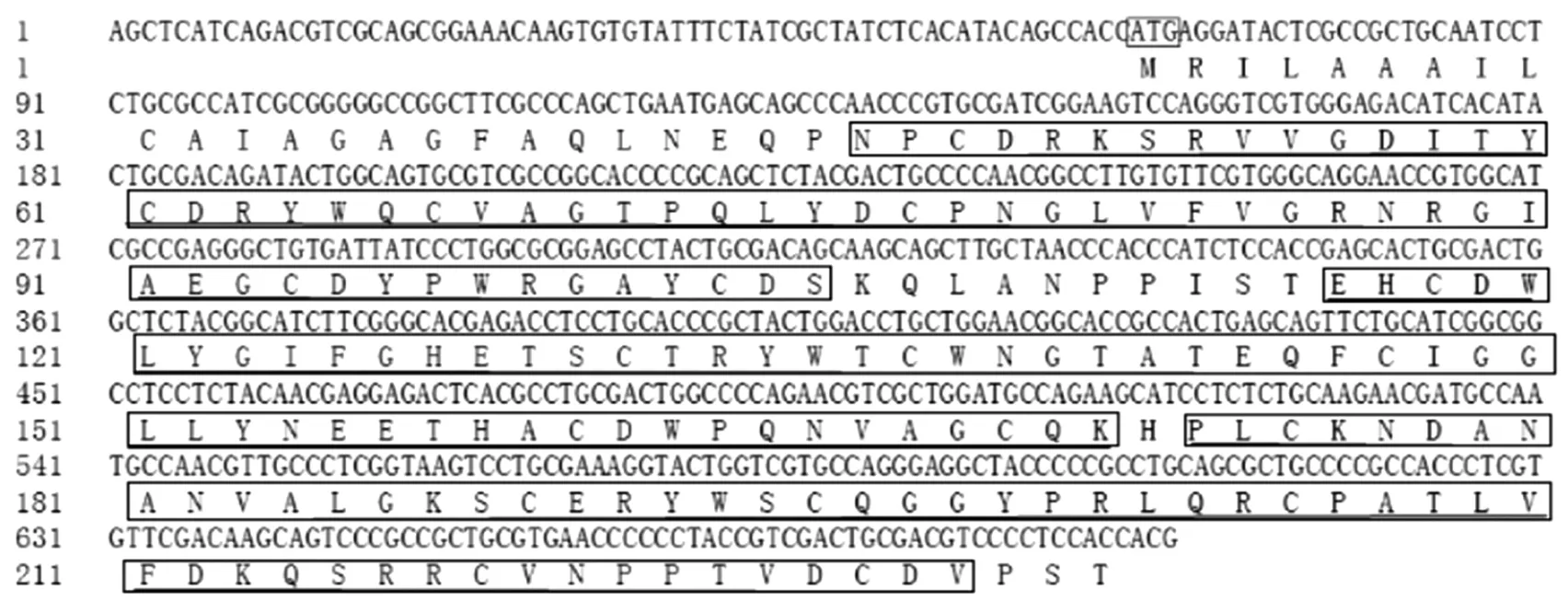
图1 中国明对虾FcPT2 部分cDNA 及其编码的氨基酸序列和FcPT2 几丁质Ⅱ型结合结构域Fig.1 Partial cDNA sequence and deduced amino acid sequence of FcPT2 gene and chitin-binding domain Ⅱof FcPT2 in F.chinensis

图2 FCPT2 与其他昆虫的CPAP3 氨基酸序列比对Fig.2 Amino acid sequence comparison of FcPT2 in F.chinensis with CPAP3 of other insects
对中国明对虾类围食膜蛋白(FcPT2)与其他虾和昆虫类围食膜蛋白的氨基酸序列进行系统进化树分析,结果如图3 所示.由图3 可以看出,对虾类的围食膜蛋白(PT)首先聚在一起,然后与昆虫围食膜蛋白CPAP3 聚类.FcPT2 与CPAP3 围食膜蛋白聚在一起,进一步说明了FcPT2 与昆虫CPAP3 围食膜蛋白具有相对较高的序列相似性.
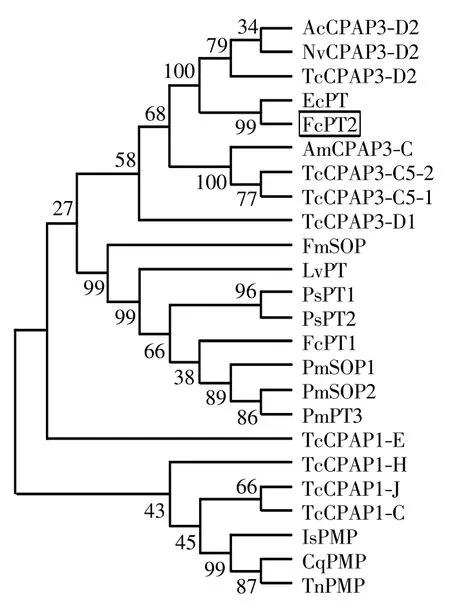
图3 FcPT2 与其他围食膜蛋白氨基酸序列的系统进化树分析Fig.3 Phylogenetic tree of FcPT2 with other peritrophins
2.2 中国明对虾类围食膜蛋白基因的表达特征
对中国明对虾不同部位的定量PCR 检测结果表明,FcPT2 主要在眼柄(eyestalk)和胃(stomach)组织中进行表达,鳃(gill)、精巢(testis)、卵巢(ovary)和血细胞(hemocyte)中也有少量表达,肝胰脏(hepatopancreas)、神经(nerve)、心脏(heart)、淋巴 Oka 和肌肉(muscle)中较少甚至无表达,如图4 所示.中国明对虾感染WSSV 后,FcPT2 在胃组织中出现明显的表达上调,如图5 所示,实验组表达量为对照组表达量的3.64 倍(P<0.05),这说明FcPT2 可能在中国明对虾抗WSSV的侵染中发挥一定的作用.
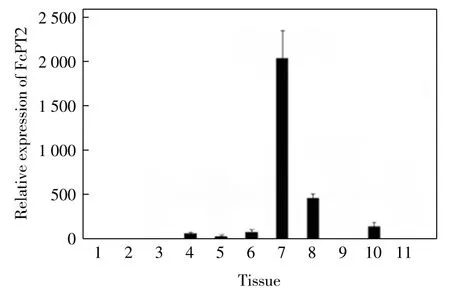
图4 FcPT2 在中国明对虾不同组织中的表达Fig.4 Expression of FcPT2 in different tissues in F.chinensis
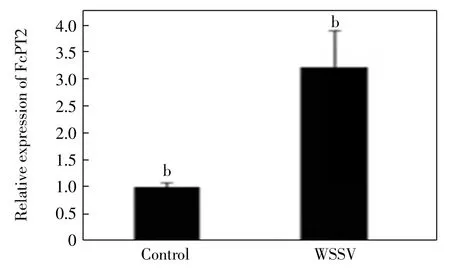
图5 WSSV 感染前后FcPT2 在中国明对虾胃组织中的表达Fig.5 Expression of FcPT2 in stomach of F.chinensis before and after WSSV infection
3 讨论与结论
围食膜蛋白最早是用强变性剂从昆虫围食膜中解离出来的,其典型特征是含有ChtBD2 结构域[8,15].Jasrapuria 等[16]根据系统树、表达和功能分析,将赤拟谷盗中含有ChtBD2 结构域的蛋白分成3 个家族:PMP(peritrophic matrix proteins)、CPAP3(cuticular proteins analogous to peritophins 3)和 CPAP1(cuticular proteins analogous to peritophins 1).PMP 家族属于肠道特异性蛋白,又称为围食膜因子(peritrophin),是围食膜结构形成的主要蛋白成分,而CPAP3 和CPAP1 家族蛋白则只是表达于表皮形成相关组织中,其功能还未知.近年来研究发现,虾类具有同昆虫类似的围食膜结构,其围食膜成分同样是由几丁质和蛋白构成[10].本文对中国明对虾类围食膜蛋白FcPT2 的研究发现,FcPT2 与昆虫CPAP3 围食膜蛋白有较高的相似性,其氨基酸序列中也具有典型的ChtBD2 结构域,但是蛋白序列差异较大.在昆虫中围食膜蛋白的种类也不同,从几种到几十种[17-18].同种昆虫中,发育时期、饵料营养等也会影响围食膜蛋白的种类.
FcPT2 的组织表达结果显示,类围食膜蛋白基因除了表达于肠道组织外,还广泛存在于其他组织中.在短钩对虾(P.semisulcatus)[19]和日本对虾(Marsupenaeus japonicus)[20]卵巢中几种类围食膜蛋白基因呈组成型高表达,由此称之为虾卵巢围食膜蛋白(shrimp ovarian peritrophins,SOPs).在昆虫围食膜蛋白研究中,Barry等[21]和 Behr 等[22]从果蝇(Drosophila melanogaster)的表皮形成相关组织中鉴定到编码ChtBD2 的基因;Nisole等[23]从云杉卷叶蛾(Choristoneura fumiferana)中克隆到一条cDNA,能够编码具有ChtBD2 结构的存在于表皮中的蛋白.本研究结果显示,FcPT2 主要表达于中国明对虾的眼柄和胃中,这2 个器官中都含有上皮,是与表皮形成相关的组织,该蛋白在鳃、精巢、卵巢和血细胞中也有少量表达.由此可知,具有ChtBD2 结构域的类围食膜蛋白不仅存在于围食膜中,在其他组织中也发挥了重要作用.
虾类围食膜蛋白呈现了多样的生物学功能:如短钩对虾中存在2 条SOP,具有在受精卵表面形成保护层的功能[19];墨吉对虾的SOP 具有抗菌肽活性[24-25];中国明对虾类围食膜蛋白PTPH 具有结合细菌和几丁质的活性[26];凡纳滨对虾类围食膜蛋白能够与WSSV 的多种囊膜蛋白相互作用[27].Hui 等[28]发现日本对虾的3种肠道类围食膜蛋白基因在WSSV 感染后出现明显的表达上调,据此提出这类围食膜蛋白在肠道免疫反应中发挥了重要作用.本研究结果显示,WSSV 感染中国明对虾后,FcPT2 在对虾胃中的表达量出现明显上调,提示该靶基因可能也在中国明对虾应答WSSV 感染过程中发挥作用.
综上所述,本研究鉴定了中国明对虾的类围食膜蛋白基因FcPT2,FcPT2 蛋白主要表达于眼柄和胃中,其编码的氨基酸序列不同于其他已报道的虾类围食膜蛋白,但与昆虫CPAP3 围食膜蛋白具有较高的同源性,因此推测FcPT2 是这类围食膜蛋白,在不同组织中发挥着不同的作用.WSSV 感染实验证明FcPT2 可能在中国明对虾应答WSSV 侵染中发挥了重要作用,具体机制有待于进一步深入研究.

