适用于转录组测序的大蒜花器官总RNA的提取方法
陈雅楠,尚云涛,范宝莉,刘晓颖,曹宝鑫,王振英
(1.天津师范大学 生命科学学院,天津 300387;2.天津师范大学 天津市动植物抗性重点实验室,天津 300387;3.天津师范大学 天津市水资源与水环境重点实验室,天津 300387)
大蒜(Allium sativum L.)是重要的经济作物之一,在葱属作物中居第二位[1],除作为调味品外,还具有很高的医用价值和保健价值[2].由于大蒜具有不育性,因此通常以鳞茎为材料进行无性繁殖,导致大蒜的遗传多样性单一且种质资源急剧退化,这成为大蒜常规杂交育种以及开展遗传学研究的瓶颈[3-6].
植物总RNA 的提取是进行下游分子生物学研究的关键步骤,高质量的RNA 是下游实验成功的保障[7],是进行RT-PCR、转录组测序等下游分子生物学操作的基础.转录组测序技术(RNA-seq)具有低成本、高通量、短周期的优势,通过转录组测序和分析可以得到特定条件下某些基因表达的信息,据此推断相应未知基因的功能,揭示特定调节基因的作用机制.转录组测序技术对RNA 的质量和产率均有很高的要求[8].大蒜各组织中含有丰富的多糖多酚类物质,成分较复杂.多糖的理化性质与RNA 极为相似,会在提取RNA 的过程中与其发生共沉淀从而严重影响RNA 的质量[9];多酚类物质被氧化后会与RNA 不可逆结合,导致RNA失去活性,也可能与RNA 结合后形成不溶性复合物,在抽提操作中致使RNA 丢失[10].因此,用常规提取方法很难分离到质量好、产率高的大蒜RNA.大蒜花器官同鳞茎等营养器官相比,生长受环境因素影响较大,再加上植物材料品质的不确定性和取材难度大,使得从大蒜花器官中提取RNA 更具挑战性.因此,获得质量好、产率高的RNA 提取方法对于大蒜花器官的分子生物学研究非常重要.
近年来,研究者们对富含多糖多酚类的植物如苹果[11]、椰子[12]、芒果[13]、新疆野苹果[14]、越桔[15]、红景天[16]等的RNA 提取方法不断进行改良,分别建立了获得高质量RNA 的提取方法,并将其用于转录组测序分析[8,17-18].关于大蒜RNA 提取方法改良的研究也有少量报道,如张爱民等[19]用3 种方法分别提取贵阳紫皮大蒜的幼嫩叶片、蒜薹和鳞茎的RNA,结果表明,从叶片中提取的总RNA 质量较好,产率较高,从蒜薹和鳞茎中提取的总RNA 的纯度不高.从大蒜花器官中提取RNA 的方法则未有专门报道.本研究先以大蒜中多糖多酚含量高的鳞茎为实验材料,分别利用2 种试剂盒方法、CTAB 法、Trizol 法以及改进酸性异硫氰酸胍法提取总RNA,对RNA 的质量、浓度和纯度进行比较分析,筛选出效果好的方法用于大蒜花器官RNA 的提取,为后续的大蒜花器官发育相关基因的研究奠定实验基础.
1 材料与方法
1.1 植物材料
宝坻大蒜“六瓣红”,取自天津师范大学生物科技园.
2018 年4—6 月份,采集大蒜花发育不同阶段的样品.从花芽开始分化至花衰老,将大蒜花器官发育分为6 个时期:大蒜抽薹前的花器官称为花芽(bud),根据花芽长度不同分为3 个时期,分别记作B1、B2、B3;大蒜抽薹后的花器官称为花蕾(flower),花蕾以花粉母细胞减数分裂阶段界定3 个时期,分别记作F1、F2、F3.每次取材时间为上午 9:00~12:00,以天气晴朗为佳.取材后将花器官组织迅速转移至液氮中,-80 ℃冰箱中保存备用.
鳞茎取鲜材,现取现用.每次取样均为5 次生物学重复,每个样品均为3 次技术重复.
1.2 主要试剂
1.2.1 试剂盒
植物总RNA 提取试剂盒分别购自普洛麦格(北京)生物技术有限公司、天根生化科技(北京)有限公司.
1.2.2 CTAB 法主要试剂
①CTAB 提取液:质量分数为2%的CTAB,质量分数为 2%的 PVP,25 mmol/L EDTA,100 mmol/L Tris-Cl(pH 值为 8.0),2.0 mol/L NaCl,灭菌后加入体积分数为2%的β-巯基乙醇;②氯仿-异戊醇(体积比为24∶1);③8 mol/L LiCl;④质量分数为0.5%的SDS.
1.2.3 Trizol 法主要试剂
①Trizol 试剂(适用于多糖多酚)购自宝生物工程(大连)有限公司;②5 mol/L NaCl;③高盐溶液:0.8 mol/L 柠檬酸钠与1.2 mol/L NaCl 混合.
1.2.4 改进酸性异硫氰酸胍法主要试剂
①去RNA 酶处理水:1 mL DEPC 原液溶于1 L超纯水中,至终质量浓度为 1 μg/mL;②Solution D 提取液:23.63 g 异硫氰酸胍溶于20 mL 灭活的去RNA 酶处理水中,65 ℃水浴助溶,溶解完全后加入1.8 mL pH值为7.0 的0.75 mol/L 柠檬酸钠,混匀后加入0.25 g 十二烷基肌氨酸钠和质量分数为2%的PVP,加去RNA酶处理水定容至50 mL,放入棕色瓶避光保存.
1.3 实验方法
1.3.1 预处理
实验所用研钵、研杵、玻璃制品经1 μg/mL 去RNA 酶处理水浸泡24 h 以上,之后包裹锡箔纸于180 ℃烘箱中高温灭菌处理.枪头、离心管等塑料制品经1 μg/mL 去RNA 酶处理水浸泡24 h 以上,之后经高温高压灭菌处理,烘干备用.
1.3.2 提取总RNA 操作步骤
试剂盒法与Trizol 法分别按照各自的说明书进行,实验重复3 遍,提取的RNA 在-80 ℃下保存备用.
CTAB 法提取大蒜总RNA 操作步骤:于65 ℃水浴中预热1 mL CTAB 提取液.称取0.1 g 植物材料,剪碎置入预冷过的研钵,加液氮研磨至粉末状.转移样品至有CTAB 提取液的离心管中,立即激烈涡旋30 s,短时放回65 ℃水浴中(约5 min).加入等体积的氯仿-异戊醇并涡旋混合,10 000 r/min 离心20 min.将上清液转移至一新离心管中,加入8 mol/L LiCl,使LiCl 的终浓度为2 mol/L,4 ℃下沉淀过夜(不超过16 h).加入1 mL 质量分数为0.5%的SDS,充分溶解后,加入等体积的氯仿-异戊醇并涡旋混合,10 000 r/min 离心20 min.冰浴 10 min 后,10 000 r/min 离心 20 min.先用 400 μL体积分数为70%的乙醇清洗沉淀,再用400 μL 无水乙醇清洗沉淀,自然干燥10 min,加入35 μL 灭活的去RNA 酶处理水室温溶解.提取的RNA 在-80 ℃下保存备用.
酸性异硫氰酸胍法[20]经改进后提取大蒜总RNA操作步骤:称取0.1 g 植物材料,剪碎置入预冷过的研钵,加液氮研磨至粉末状,加入1 mL 的Solution D 和7.2 μL 巯基乙醇,与粉末研至澄清.(以下步骤在冰上操作)倒入 5 mL 离心管中,加入 100 μL 2 mol/L 的NaAC(pH 值为4.0)颠倒数次混匀置冰上.加入等体积的水饱和酚,涡旋混合器上震荡混匀,加入200 μL 氯仿-异戊醇(体积比为 49 ∶1),用力震荡混匀,冰浴 30 min,期间颠倒数次,以不出现分层为宜.10 000 r/min 4 ℃离心20 min,取上清,加入等体积的氯仿-异戊醇(体积比为 49 ∶1),再抽提 1 次,10 000 r/min 4 ℃离心 20 min.取上清,加入等体积的异丙醇和1/10 体积的1 mol/L NaAc(pH 值为 5.2),-20 ℃ 沉淀 1 h 以上.10 000 r/min 4 ℃离心25 min,弃上清,75%乙醇清洗2 次以除去盐类和其他杂质.离心弃上清,每次10 000 r/min 4 ℃离心 5 min.自然干燥 10 min,加入 35 μL 灭活的去RNA 酶处理水室温溶解.提取的RNA 在-80 ℃下保存备用.
1.3.3 总RNA 质量检测方法
使用Nano Drop 1000 紫外分光光度计检测RNA样品的浓度及纯度,用1%的琼脂糖凝胶电泳检测RNA 的完整性.
1.3.4 RT-PCR 检测
使用M-MLV Reverse Transcriptase Protocol 试剂盒(美国 Promega 公司)进行 RT-PCR,以 2 μg RNA 为模板进行反转录,得到的cDNA 用于随后的PCR 反应.采用唐巧玲[21]设计的引物进行PCR 扩增,引物GActinF的 序 列 为 5′-GAATCCAAAGGCAAATAGA GAG-3′,GActinR 的序列为 5′-CATCACCAGAATCCAGAACAAT-3′,扩增产物为 143 bp.反应体系包括:cDNA 1 μL,上下游引物分别为 0.25 μL,Ex Taq 酶 0.25 μL,10×Ex Taq Buffer 2.5 μL,dNTPs 2 μL,ddH2O 18.75 μL.反应程序:94 ℃预变性 5 min;94 ℃反应 20 s,58 ℃反应20 s,72 ℃反应 30 s,35 个循环;72 ℃延伸 7 min.
1.3.5 基因表达谱测序
利用改进酸性异硫氰酸胍法提取的总RNA 样品经检测合格后,进行文库构建.用带有Oligo(dT)的磁珠富集真核生物mRNA,随后加入fragmentation buffer将mRNA 打断成短片段.以mRNA 为模板,用六碱基随机引物(random hexamers)合成第一链cDNA,然后加入缓冲液、dNTPs、DNA polymerase I 和 RNase H 合成第二链cDNA,再用AMPure XP beads 纯化双链cDNA.纯化的双链cDNA 先进行末端修复、加A 尾并连接测序接头,再用AMPure XP beads 进行片段大小选择.最后进行PCR 扩增,并用AMPure XP beads 纯化PCR 产物,得到最终的文库.文库构建完成后,先使用Qubit2.0荧光定量仪进行初步定量,稀释文库至1.5 ng/μL,随后使用Agilent 2100 生物分析仪对文库的insert size 进行检测,insert size 符合预期后,使用Q-PCR 方法对文库的有效浓度进行准确定量(文库有效浓度>2 nmol/L)以保证文库质量.库检合格后,将不同文库按照有效浓度及目标下机数据量的需求pooling 后进行Illumina HiSeq 测序.测序得到原始序列(sequenced reads 或者raw reads),里面含有带接头的、低质量的reads.为了保证信息分析质量,必须对raw reads过滤,得到clean reads,后续分析都基于clean reads.数据处理步骤如下:
(1)去除带接头(adapter)的 reads;
(2)去除N(N 表示无法确定碱基信息)的比例大于 10%的 reads;
(3)去除低质量reads(质量值Qphred ≥20 的碱基数占整个reads 50%以上的reads).
2 结果与分析
2.1 大蒜花发育不同阶段的解剖学观察
对大蒜花芽分化的不同阶段进行解剖学观察,结果如图1 所示.
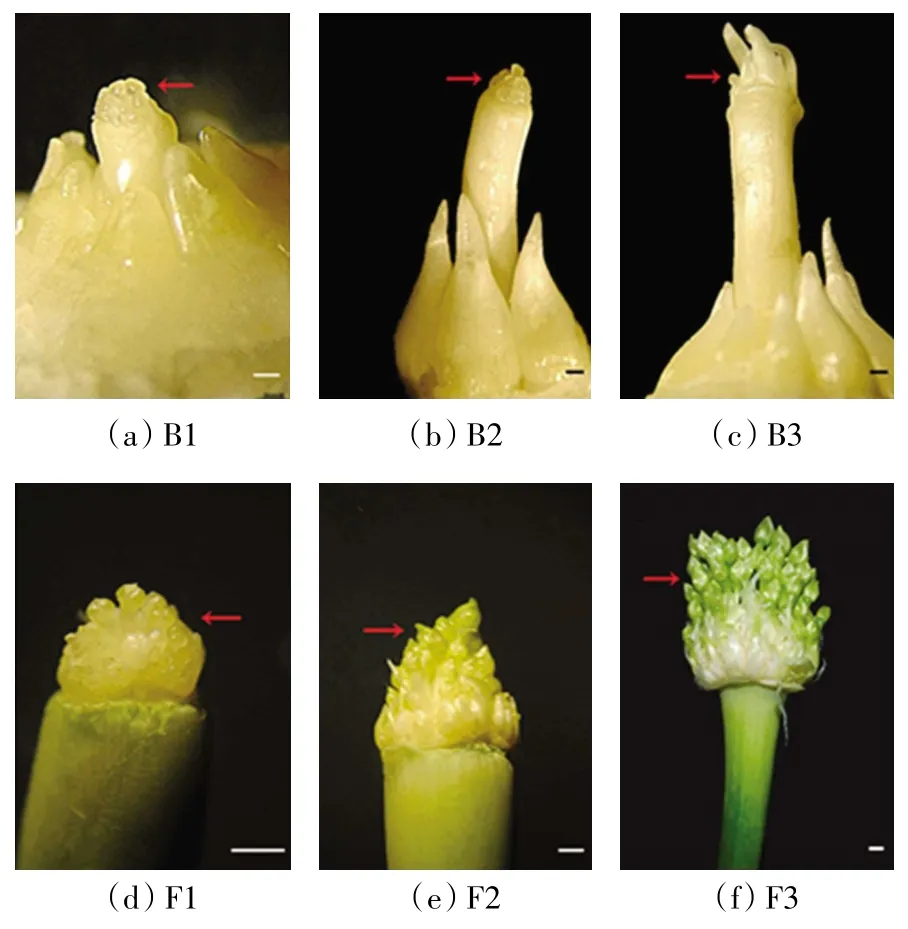
图1 不同发育时期的大蒜花器官解剖图(标尺=1 mm)Fig.1 Anatomy of garlic floral organs at different developmental stages(bar=1 mm)
根据花芽长度不同,将花芽分化分为3 个时期:花芽长度≤0.5 cm 时记作B1 期,花芽长度为0.5~2.0 cm时记作B2 期,花芽长度≥2.0 cm 时记作B3 期.随着大蒜花茎的伸长,在大蒜抽薹后,对花粉母细胞进行细胞学观察,将花粉母细胞进入减数分裂期之前记作F1 期,处于减数分裂期记作F2 期,减数分裂期之后记作 F3 期.
2.2 不同方法提取大蒜鳞茎和花器官总RNA完整性的比较
图2 为不同方法提取大蒜鳞茎总RNA 的电泳图谱.由图2 可以看出,5 种方法均能够得到28S 和18S条带.相较于普洛麦格试剂盒法、CTAB 法和Trizol法,使用天根试剂盒和改进酸性异硫氰酸胍法提取的总RNA 条带明亮,且28S 条带亮度约为18S条带亮度的2 倍,说明RNA 无降解,且无蛋白质及DNA 污染,质量较好.改进酸性异硫氰酸胍法提取的总RNA中5S rRNA 亮度显著高于其他方法,说明该方法所得RNA 的完整性更好.
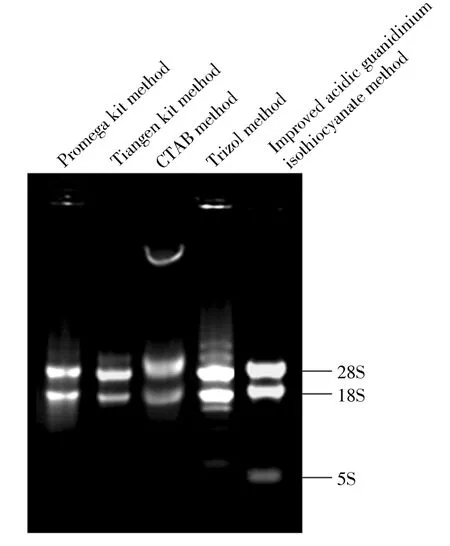
图2 不同方法提取大蒜鳞茎总RNA 的电泳检测Fig.2 Electrophoresis of total RNA extracted from garlic bulbs by different methods
用筛选出的天根试剂盒法和改进酸性异硫氰酸胍法提取大蒜不同时期花器官的总RNA,电泳检测结果如图3 所示.由图3 可以看出,2 种方法提取的大蒜不同时期花器官的总RNA 都可以得到较为明亮的28S 和18S 条带.同天根试剂盒法相比,用改进酸性异硫氰酸胍法提取的总RNA 中5S rRNA 的亮度更大,说明该方法提取的RNA 完整性更好,更适于提取大蒜花器官的总RNA.
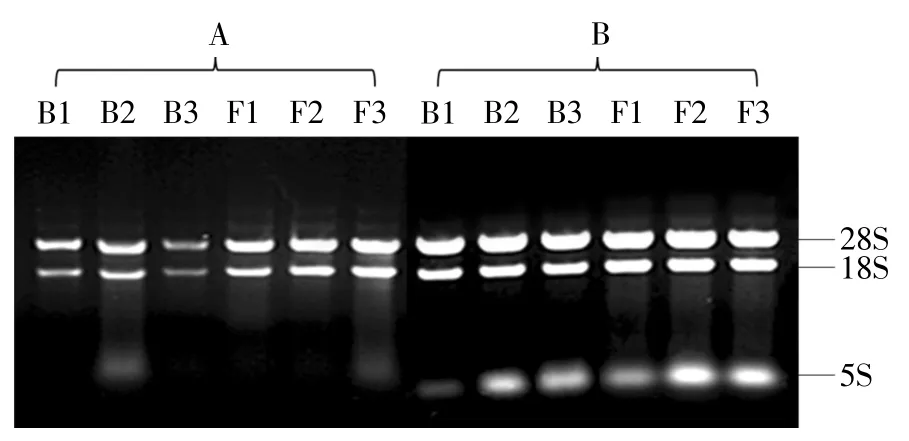
图3 不同方法提取大蒜花器官总RNA 的电泳检测Fig.3 Electrophoresis of total RNA extracted from garlic floral organs by different methods
2.3 不同方法提取大蒜鳞茎和花器官总RNA纯度和收率的比较
浓度和纯度是判断RNA 质量优劣的重要标准,OD260/OD280比值和OD260/OD230比值是衡量蛋白质污染程度的参考指标.高质量RNA 的 OD260/OD280值在1.8~2.1 之间,比值为2.0 的RNA 质量最优;OD260/OD230的比值通常在2.0 左右,比值大于2.0 说明RNA无蛋白、有机试剂或多糖多酚类杂质的污染.检测5种方法提取的大蒜鳞茎总RNA 的纯度及浓度,结果如表1 所示.

表1 不同方法提取大蒜鳞茎和花器官总RNA 的浓度及纯度Tab.1 Concentration and purity of total RNA extracted from garlic bulbs and floral organs by different methods
由表1 可以看出,5 种方法提取的大蒜鳞茎总RNA 的 OD260/OD280比值均在 1.8~2.1 之间,其中,使用天根试剂盒方法和改进酸性异硫氰酸胍法提取的总RNA 的 OD260/OD280更接近 2.0,且 OD260/OD230比值均大于2.0,说明RNA 质量好,无蛋白、有机试剂或多糖多酚类杂质污染.改进酸性异硫氰酸胍法提取的鳞茎RNA 浓度比天根试剂盒法提高了约3.5 倍.进一步将天根试剂盒方法和改进酸性异硫氰酸胍方法用于提取大蒜花器官不同发育时期的总RNA,以F1 期为例,改进酸性异硫氰酸胍法提取的花器官RNA 浓度比天根试剂盒法提高了近3 倍.由此可见,改进酸性异硫氰酸胍法提取RNA 的收率更高,且成本较试剂盒法低.
2.4 RT-PCR检测结果
为进一步检测RNA 质量,以提取的大蒜鳞茎和花器官总RNA 反转录的产物cDNA 为模板,扩增Actin 部分片段,片段长度为143 bp,电泳结果如图4所示.泳道1、2 为改进酸性异硫氰酸胍法的RT-PCR结果,同试剂盒法相比,前者能够扩增出单一且清晰的目标条带,未见非特异产物,说明提取的RNA 质量好、纯度高.
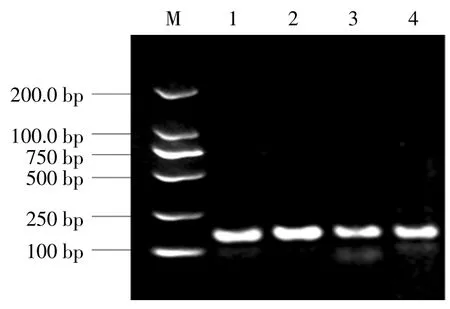
图4 大蒜鳞茎和花器官的RT-PCR 电泳检测Fig.4 RT-PCR electrophoresis of RNA extracted from garlic bulbs and floral organs respectively
2.5 RNA测序及库检结果
对改进酸性异硫氰酸胍法提取的大蒜花器官的RNA 进行测序和库检,部分检测结果如图5 所示(每个发育时期选取2 组生物学重复,图为F1 时期的2组生物学重复检测结果).Adapter related 代表因有接头过滤掉的reads 数及其占raw reads 数的比例;Containing N 代表因N 含量超过10%过滤掉的reads 数及其占raw reads 数的比例;Low quality 代表因低质量过滤掉的reads 数及其占raw reads 数的比例;Clean reads代表最终得到的clean reads 数及其占raw reads 数的比例.
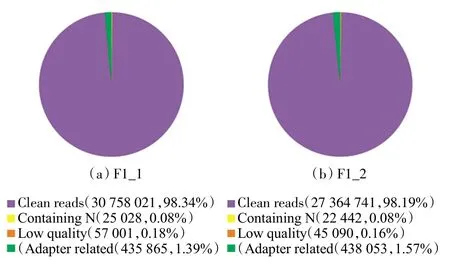
图5 测序样品的原始数据Fig.5 Raw data of sequenced samples
上述过滤掉的reads 数占raw reads 数的比例极低,得到的clean reads 均大于98%,表明使用改进酸性异硫氰酸胍法提取的总RNA 的质量能够满足RNA-seq分析的要求.
3 讨论与结论
为了获得高质量、高收率的大蒜花器官RNA 样品,本研究先以多糖多酚类物质含量高的大蒜鳞茎作为实验材料,采用 2 种试剂盒方法、CTAB 法、Trizol 法以及改进酸性异硫氰酸胍法提取RNA,筛选出了RNA 提取质量较优的天根试剂盒法和质量、收率均较优的改进酸性异硫氰酸胍法.与传统的异硫氰酸胍法相比,改良的提取方法中,在提取液solution D 中添加了2%的PVP,PVP 不仅可以去除组织中的多糖多酚类物质,还能去除一些其他色素和脂类物质,同时可以消除泡沫,保护胶体,得到更完整和纯度更高的RNA 产物[22].在异丙醇沉淀时,加入1/10 体积的1 mol/L NaAc(pH 值为 5.2),NaAc 可以沉淀糖类,有效去除组织中的多糖.通过改进酸性异硫氰酸胍法去除了DNA和蛋白质残留,有效避免了多糖多酚物质对RNA 质量的干扰,同试剂盒法相比,提取的RNA 的纯度、收率以及完整性更高.
转录组测序分析对RNA 的产率和质量有较高的要求:植物样本 RNA 质量浓度≥400 ng/μL,OD260/OD280为 1.8~2.2,OD260/OD230> 2.0,28S/18S 之值 > 1.0[8,18].本研究中,天根试剂盒法和改进酸性异硫氰酸胍法提取的大蒜花器官总RNA 的OD260/OD280均在2.0~2.1 之间,RNA 纯度较高,改进酸性异硫氰酸胍法的OD260/OD280更接近2.0,纯度较试剂盒法更高.试剂盒法提取的RNA 浓度小于400 ng/μL,即收率较少,而改进酸性异硫氰酸胍法提取的RNA 质量浓度超过了800 ng/μL.确定改进酸性异硫氰酸胍法最优体系后,将该方法应用于提取大蒜花器官的总RNA,分离得到的RNA 质量高、收率高且重复性好,测序得到的cleanreads 均大于98%,完全能够满足转录组测序分析的要求.

