对叶豆浸膏对特异性皮炎小鼠的影响
付莉慧,杨 敏,杨兴鑫,俞 捷,贺 森,黄 丰,赵荣华,顾 雯
(云南中医学院中药学院,云南 昆明 650500)
特异性皮炎(atopic dermatitis,AD)是以剧烈瘙痒为主要临床症状的慢性炎症性皮肤病,各年龄段均可发病,以儿童最常见,且近年来其发病率呈不断上升趋势,严重影响患者的生活品质[1]。最新研究显示AD 儿童具有罹患焦虑、抑郁、注意力缺陷多动障碍等精神性疾病的倾向,因此,AD 已成为世界范围内人民健康,特别是儿童健康的重大危害[2]。特异性皮炎的治疗目前大多采用口服抗组胺药和外用激素类药膏,但是长期使用这些药物存在着许多不利因素[3]。对叶豆Cassia alataL.是豆科决明属植物,又名有翅决明、非洲木通,其味辛,性温,入心、脾二经,多外用鲜品,主治神经性皮炎、牛皮癣、湿疹、皮肤瘙痒、疮疖疼痛,是傣族用于治疗皮肤病的常用药[4]。本研究通过检测对叶豆浸膏对特异性皮炎模型小鼠的药效作用,并探讨其可能作用机制,为拓宽相关应用提供理论基础。
1 材料
1.1 动物 普通级6 周龄雌性BALB/c 小鼠54 只,体质量(20±2)g,购于北京华泵康生物科技股份有限公司,实验动物生产许可证号SCXK(京)2014-0004。
1.2 药物 对叶豆浸膏由云南中医学院炮制实验中心提供。取对叶豆全叶加10 倍量90%乙醇回流提取1.5 h,滤过,滤液浓缩至稠膏;药渣以8 倍量的水煎煮1 h,滤过,滤液与上述稠膏合并,减压浓缩至相对密度为1.41~1.45,储存备用。1% 对叶豆浸膏浓度由1 g 对叶豆浸膏加入99 mL 70%乙醇配制而成,10%对叶豆浸膏由10 g对叶豆浸膏加入90 mL 70%乙醇配制而成。
1.3 试剂 复方醋酸地塞米松乳膏(湖北科田药业有限公司,批号160805);2,4-二硝基氟苯(成都西亚化工股份有限公司,批号J01010);硫化钠(西陇化工股份有限公司,批号151204);乙醇(广东光华科技股份有限公司,批号20160927);IL-4、IL-6、IL-13、IL-16、IL-33、免疫球蛋白E(Ig-E)、TNF-α、IFN-γ ELISA 检测试剂盒(杭州联科生物有限公司,批号分别为 220470431、220670535、221370512、221660641、223370513、227161244、228270625、228070225)。
1.4 仪器 SpectraMax Plus384 酶标仪[美谷分子仪器(上海)有限公司];HR/T16 M 高速离心机(湖南赫西仪器装备有限公司)。
2 方法
2.1 动物造模、分组及给药 动物经适应性饲养1 周后用于实验,在特异性皮炎模型造模方面对已有方法[5]进行了一定的改进。将BALB/c 小鼠随机分为正常组、模型组、阴性对照组(70%乙醇)、对叶豆低剂量组(1%)、对叶豆高剂量组(10%)、阳性对照组(复方醋酸地塞米松乳膏),每组9 只。实验前1 d,所有小鼠用8%硫化钠溶液进行背部脱毛(2.5 cm×2.5 cm),暴露皮肤;实验第1、2 天对除正常组以外的小鼠进行造模,即在小鼠背部已脱毛的皮肤上涂抹丙酮-橄榄油混合溶液(3∶1)配置的0.5%2,4-二硝基氟苯溶液,第3~6 天不作任何处理;第7 天开始隔天涂抹1 次0.5% 2,4-二硝基氟苯溶液,70 μL/次,共10 次,21 d 后造模完成。正常组背部已脱毛的皮肤仅涂抹丙酮橄榄油混合溶液,涂抹时间和剂量与造模组一致。造模结束后阳性对照组涂抹复方醋酸地塞米松乳膏,对叶豆低、高剂量组涂抹相应剂量浸膏,正常组和模型组涂抹丙酮-橄榄油混合溶液,阴性对照组(用来排除70%乙醇对实验结果的影响)涂抹70%乙醇,外涂药物1 次/d,给药14 d。
2.2 小鼠局部皮肤组织评价 治疗第14 天,观察各组小鼠皮炎情况并拍照记录。处死小鼠后,用直径6 mm 打孔器在相同部位取下背部脱毛处的皮肤(不含皮下脂肪)用千分卡尺单盲法测定皮肤厚度,用10%福尔马林溶液固定,石蜡包埋、切片、HE 染色后10 倍显微镜下观察组织病理改变,单盲法分别计算10 个高倍视野真皮炎性细胞数,取其平均值。
2.3 小鼠血清细胞因子水平检测 治疗第14 天摘除小鼠眼球取血,室温下静置30 min,在4 ℃下3 500 r/min 离心15 min,获取血清。使用ELISA 试剂盒,按照说明书操作,检测血清IL-4、IL-6、IL-13、IL-16、IL-33、TNF-α、IFNγ、IgE 水平。
2.4 统计学分析 采用SPSS 16.0 统计软件进行分析,实验数据以(±s)表示,采用单因素方差分析。以P<0.05为差异有统计学意义。
3 结果
3.1 对叶豆浸膏对AD 模型小鼠皮肤组织的影响
3.1.1 小鼠背部皮损情况 正常组小鼠皮肤正常,组织结构基本正常;模型组小鼠皮肤可见红斑、丘疹、结痂、糜烂样等皮肤损伤改变;阳性对照组小鼠背部皮肤光滑,可见少量的结痂;对叶豆低剂量组小鼠背部有红斑;对叶豆高剂量组小鼠背部皮肤光滑,皮肤无明显糜烂;阴性对照组小鼠皮肤有少许红斑糜烂,不光滑。见图1。
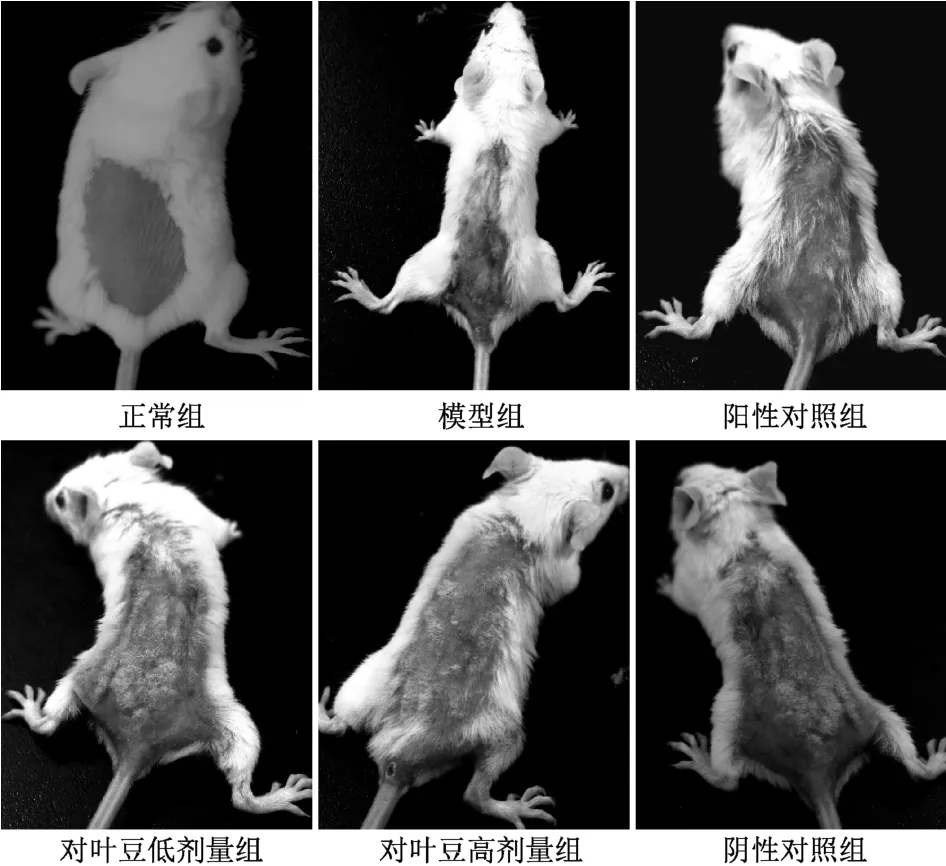
图1 小鼠背部皮损情况
3.1.2 小鼠背部皮损组织病理 正常组表皮真皮结构正常,真皮层未见血管扩张及炎症细胞;模型组角化过度,棘层肥厚明显伴灶性海绵水肿,真皮血管扩张充血较多单核炎性细胞浸润,毛囊结构减少;阳性对照组表皮各层较清晰,真皮血管扩张,炎性细胞较模型组明显减轻,毛囊结构明显增多;对叶豆低、高剂量组明显缓解了炎性细胞,但是棘层还是较厚,毛囊结构明显减少;阴性对照组表皮增厚、细胞间水肿、表皮和真皮内有单核炎性细胞浸润,且较阳性对照组及对叶豆低、高剂量组炎性浸润更严重。见图2。

图2 小鼠背部皮肤HE 染色病理形态观察(×10)
3.1.3 小鼠皮肤厚度和炎性细胞数的变化 与正常组比较,模型组皮肤真皮浸润炎性细胞增多、背部皮肤增厚(P<0.01);与模型组比较,对叶豆低、高剂量组均能降低背部皮肤真皮浸润炎性细胞数(P<0.01),说明对叶豆浸膏有一定抗炎、修复皮肤的作用。见表1。
3.2 对叶豆浸膏对小鼠血清炎症因子水平的影响 与对照组比较,模型组血清IL-16、IL-33、TNF-α、IgE、IL-4、IL-13、IL-6 水平升高(P<0.01);与模型组比较,对叶豆高剂量组IL-33、TNF-α、IgE、IL-4、IL-13、IL-6 水平降低(P<0.01),低剂量组仅IL-13、IL-6 水平降低(P<0.01)。见表2。
表1 各组皮肤厚度及真皮炎性细胞数比较(±s,n=9)
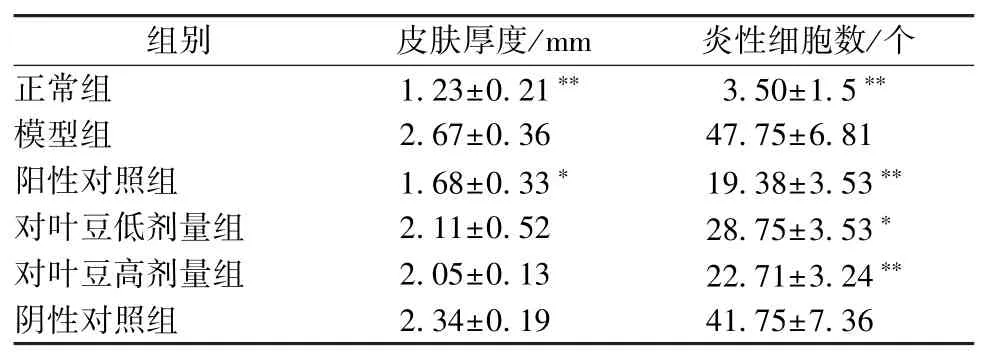
表1 各组皮肤厚度及真皮炎性细胞数比较(±s,n=9)
注:与模型组比较,*P<0.05,**P<0.01。
4 讨论
AD 是一个由Th1/Th2 免疫反应引发的双相性炎性皮肤病[6],Th1/Th2 细胞因子之间存在拮抗关系,IFN-γ 主要是Th1 分泌的细胞因子,IL-4 及IL-13 主要是Th2 分泌的细胞因子,Th1/Th2 失衡可以导致过敏性疾病,Th1/Th2 平衡状态对于保持机体正常的免疫有重要意义[7]。且目前已知胸腺基质淋巴细胞生成素、IL-25、IL-33,特别是IL-33 是激活并促进先天性淋巴细胞(innate lymphoid cells,ILC2s)释放细胞因子的主要因子,因此对AD 的发病有重要作用[8-9]。ILC2s 被激活后,分泌细胞因子IL-5、IL-9 和IL-13,其中IL-13 可诱导B 细胞产生IgE,间接活化肥大细胞(Mast cell,MC),IL-5 是嗜酸粒细胞的强趋化因子和增殖因子,而研究表明MC 在AD 患者皮损部位的数目多于非皮损部位,因此在AD 作用机制中,MC 扮演重要角色,而IL-5、IL-9 和IL-13 即是调控AD 的关键细胞因子,也对AD的发病有重要作用[8-10],国内外研究均证实AD 患者IgE 以及T 辅助淋巴细胞Th2 型细胞因子水平明显增高[11],AD患者为Th2 占优的过敏性疾病,Th2 分泌的IL-4 可促使B细胞产生IgE,Th1 分泌的IFN-γ 强烈抑制IgE 的合成[11],但不同时期及不同程度皮损的AD 患者血清中细胞因子的表达水平有差别[12],且在急性和慢性炎症皮损表达IL-4、IL-13 的细胞数显著高于正常人[13]。因此,降低AD 患者IgE 水平、抑制Th2 型细胞因子表达,逆转Th2 型免疫反应,有望成为AD 治疗的关键靶点。
表2 各组血清炎症因子水平比较(±s,n=9)

表2 各组血清炎症因子水平比较(±s,n=9)
注:与模型组比较,*P<0.05,**P<0.01。
本研究中,模型组血清中IgE、IL-6、IL-13、IL-16、TNF-α 水平、皮层厚度、炎性细胞数较正常组均升高,而IFN-γ 较正常组水平降低;与模型组相比,在给予对叶豆浸膏治疗后,血清中IgE、IL-33、IL-6、IL-13 水平、皮层厚度、炎性细胞数都有明显下调,IFN-γ 的表达量有所增加,即说明Th1/Th2 免疫反应引发的双相性炎性皮肤病,在下调了Th2 细胞的分化,同时激活了Th1 细胞。提示对叶豆浸膏治疗AD 小鼠的作用机制可能是,通过促进IFN-γ分泌,降低IL-4 水平,同时抑制IgE 合成调节,Th1 分泌的IFN-γ 和Th2 分泌的IL-4 之间的平衡,使Th1/Th2 趋于平衡而发挥治疗作用。

