东北刺人参化学成分及药理作用研究进展
康杰尧,李世杰,王 艳,孟永海,李廷利,王艳艳
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
刺人参为五加科刺人参属刺人参Oplopanax elatus(Nakai)Nakai.的干燥根及根茎,也称刺参或东北刺人参,有补气助阳、强心利尿的功效,收载于《中国植物志》[1]。东北刺人参对生长环境的要求较为苛刻,分布区域十分狭窄,喜生长在海拔1 400~1 500 m 范围的高山地带,常见的有针阔叶林和落叶阔叶林带等土壤肥沃、排水条件良好的区域,其主要分布于我国吉林长白山脉,以及俄罗斯远东山区和朝鲜北部山区。东北刺人参主要含有皂苷、蒽醌、脂肪酸、黄酮、氨基酸、挥发油等成分[2]。该植物与人参的生物活性相似,具有很高的药用价值,在民间应用广泛,有木本人参的美誉。现代药理学研究表明,东北刺人参具有抗菌、抗炎、抗衰老、抗惊厥、抗疲劳、解热、改善睡眠、调节血压、改善生殖功能、降糖等作用,但尚未对其进行系统整理。本文对近年来东北刺人参的化学成分及药理作用研究进展进行了归纳总结,以期为该植物的深入研究和人工培育等提供参考。
1 化学成分
东北刺人参中主要含挥发油、皂苷、蒽醌、黄酮、脂肪酸、游离氨基酸、微量元素等成分[3-4]。
1.1 挥发油类 东北刺人参中含有大量的挥发油类成分。Zhang 等[5]通过蒸汽蒸馏萃取和GC-MS 和GC-IR 分析并研究了刺人参茎中挥发油的组成,茎中含有3.1%的挥发油类成分,其中α-蒎烯、辛醛、6,6-二甲基-2-亚甲基-降蒎烷和5-甲基己醛是最丰富的挥发性成分。宓鹤鸣等[6]借助GC-MS 技术,从刺人参挥发油中分离出四十余种成分并鉴定出30 种成分。胡鑫尧等[7]则是通过GC-MS 和GC-FTIR从刺人参的挥发油成分中初步确认了根皮中19 种、根中13 种、根茎中9 种、茎中13 种、叶中22 种成分。李向高等[8]经GC-MS-COMP 联用从刺人参中分离出111 种化合物,并鉴定出其中16 种。武星等[9]通过超临界提取分离和GC/MS 鉴定,从解析釜Ⅰ和解析釜Ⅱ中分别鉴定出13 种以及6 种成分。刘昕等[10]也是通过GC-MS 法分离出15 个化合物,并鉴定出14 个化合物。刘朋朋等[11]从刺人参挥发油中分离出31 种成分,并鉴定20 种。陈萍等[12]从刺人参挥发油中分离出105 种成分,并鉴定出78 种。综上,经整理统计,去除重复成分,目前在刺人参中共发现了169种挥发油:hexanal、longifilene、heptaldehyde、3-carene、carnphene、α-pinene、β-pinene、α-pentylfuran、octanal、limonene、perillen、undecene、2,6-dimethyl-heptalene、borneol、nonanal、heptanoic acid、octaroic acid、pelargonic acid、α-dodecenal、bornyl acetate、α-copanene、humulene、tetradecanal、isocaryophyllene、α-farnesene、β-farnesene、trans-β-farnesene、Z-β-farnesene、(-)-δ-cadinene、δcadinene、γ-muurolene、γ-cadinene、nerolidol、(-)-guaiol、3,7,11-trimethyl-2,6,10-dodecatrien-1-ol、torreyol、cedrol、bulnesol、farnosol、2,4-nonadienal、αcubebene、heptanal、2-nonanone、β-cadinene、βbourbonene、α-caryophyllene、β-caryophyllene、α-guaiene、alloaromadendrene、α-gurjunene、β-bisabolene、palmitic acid、methyl palmitate、ethyl palmitate、ethyl stearate、methyl linoleate、ethyl linoleate、α-phellandrene、β-phellandrene、(E)-3-nonene、β-myrcene、D-limonene、β-thujene、2-amylfuran、β-trans-ocimene、β-cis-ocimene、γ-terpinen、Ocymene、(+)-4-carene、geranylnitrile、allocimene B、(+)-ledene、(E,E)-1,3,5-undecatriene、trans-2-octenal、(+)-δ-cadinene、(+)-calarene、isosativene、caryophyleine-(I3)、α-bulnesene、longifolene-(V4)、αamorphene、elixene、α-bergamotene、α-muurolene、(E,E)-2,4-decadiena、γ-elemene、hexanoic acid、δ-cadinol、caryophyllene oxide、(-)-spathulenol、trans-nerolidol、cubenol、di-epi-α-cedrene、copaene、(E)-2-nonenal、(-)-terpinen-4-ol、(+)-sativen、globulol、(+)-aromadendrene、(2E)-2-nonen-4-one、(4Z)-9-methyl-4-undecene、α-cadinol、α-caryophyllene、α-elemol、gelemene、τ-cadinol、hedycaryol、γ-spathulenol、αspathulenol、τ-muurolol、10,12-octadec-adiynoic acid、falcarinol、trans-α-elemol、spathulenol、(+)-spathulenol、(3E)-ocimene、(-)-germacrene D、hexanol、bicyclo[2.2.1]heptan-2-ol,1,7,7-trimethyl-,2-acetate、germacra-1(10),4,7(11)-triene、1-hydroxy-1,7-dimethyl-4-isopropyl-2,7-cyclodecadiene、1(5)-guaien-11-ol、(+)-rosifoliol、(-)-cubenol、T-cadinol、(-)-α-cadinol、α-terpineol、camphene、7-acetyl-2-hydroxy-2-methyl-5-isopropylbicyclo[4,3,0]nonane、甲基环丙烷、2-甲基-1-丙烯、3-甲基-2-丁烯醛、3-甲氧基-1,2-丁二烯、1.1 一二丁氧基乙烷、(E,E)-2,4-己二烯醛,α-芫荽醇-2-戊醇-4-酮、1-乙基-1,3-二甲基-顺-环己烷、2,2-二甲基-3-丙基环氧乙烷、4-甲基-4-乙基-2-环己烯-l-酮、3-甲基戊醛、(Z)-2-庚烯醛、(E)-2-十二烯醛、trans-2-decenal,(2E,4E)-2,4-癸二烯醛、斯巴醇、4,7-二甲基-1-异丙基-10-羟 基-2,3,5,6,9,10-五氢萘、十九杜松醇、(9Z)-9,17-十八二烯醛、(1Z,9E)-1,9-十七二烯-4,6-二炔-3-醇、1,3,4,5,6,9-六氢-苯并环庚烯-2-酮、[S-(Z)]-3,7,11-三甲基-1,6,10-十二三烯-3-醇、6-甲基-4-异丙基-1-亚甲基-2,3,7,8,9,10-六氢萘、7-癸烯醇乙酸酯、十三醇、2,7-二甲基-4-羟基-喋啶、3,7-二甲基-1,3,6-辛三烯、7-甲基-3-亚甲基-1,6,-辛二烯、6,6-二甲基-2-亚甲基原蒎烷、3-甲基戊醇、1-乙酰氧基-2-甲基-5-异丙烯基环己烷、过庚酸、7,11,-二甲基-3-亚甲基-1,6,10-十二碳三烯、甲 基-4-亚甲基-1-异丙基-1,2,3,4,4α,5,6,8α-八氢萘、1,2,5,8,9,10-六氢-4,7-二甲基-1,-异丙基萘、香叶醇、11,14-十八碳二烯酸甲酯、1,2,3,4,7,8,9,10,-八 氢-1,6,-二甲基-4-异丙基-1-羟 基萘、3-乙基-4-甲基-3-戊烯-2-酮、4,7-环氧三环[4.1.0.0(3,5)]庚烷。
1.2 皂苷类 皂苷类是东北刺人参中的另外一类典型成分,具有多种生物活性。其中,王广树[13-15]、徐小平等[16]从刺人参中分离出了25 种皂苷成分,3 个为已知化合物,分别为glycoside Ⅲ、glycoside Ⅱ、glycoside Ⅳ,其余22 个为新型化合物(齐墩果烷型的为14 种,羽扇豆烯型为8种)并分别命名为刺人参苷A-V,结构见图1。此外,本课题组在前期实验中发现,东北刺人参根60%乙醇提取物中总皂苷含有量为17.43%,显著高于茎中皂苷含有量。

图1 皂苷类成分结构
1.3 蒽醌和黄酮类 许颂等[17]等经理化性质和光谱分析分离鉴定出4 个蒽醌化合物,分别为 chrysophanol、physcion、emodin、aloe-emodin。王广树等[18]在刺人参中分离鉴定出2 个黄酮类化合物,分别为山柰黄素-3-O-β-D-吡喃半乳糖基-(1→2)-β-D-吡喃葡萄糖苷、槲皮素-3-O-β-吡喃半乳糖基-β-D-吡喃葡萄糖苷,结构见图2。
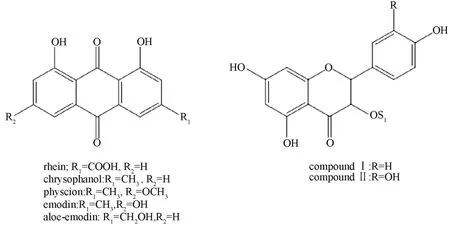
图2 蒽醌和黄酮类成分结构
1.4 脂肪酸类 张宏桂等[19]在刺人参茎中进行总脂肪酸提取与甲酯化,用GC-MS 分离出35 个化合物,鉴定出18个脂肪酸类化合物,其中,主要成分为6,9-十八碳二烯酸。刘金平等[20]对刺人参根进行分离鉴定,发现14 个脂肪酸类化合物,其中,主要的成分为异油酸、壬二酸和3-羟基十六烷酸。见表1。结果表明刺人参根、茎中有4 种脂肪酸是共有的,分别是为羊脂酸、天竺癸酸、2-癸烯酸和花生酸。

表1 脂肪酸成分
1.5 游离氨基酸类 吴广宣等[21]对刺人参各部位游离氨基酸的成分与含有量进行了分析与比较,检测出天门冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸等18 种氨基酸。汪树理等[22]采用氨基酸自动分析仪和原子吸收分光光度计对东北刺人参中氨基酸的含有量进行测定,结果显示刺人参茎和根的氨基酸总含有量分别为3.61%、3.29%,必需氨基酸约占氨基酸总量的40%。
1.6 微量元素 刘建国等[23]用原子吸收光谱法测定东北刺人参中有Cu、Fe、Zn、Mn、Cr、Sr、Ag 和Al 等微量元素,且8 种微量元素在刺人参中的总含有量高于人参。汪树理等[22]采用了原子吸收分光光度计对刺人参根、茎中微量元素Zn 和Cu 进行了含有量测定,根中Zn、Cu 含有量分别为355.45、62.64 mg/kg,茎中Zn、Cu 含有量分别为250.79、40.73 mg/kg。
1.7 其他 许颂等[24]从刺人参中分离出7 个化合物,经理化性质和光谱分析鉴定为syringin、stigmasterol-3-O-β-Dglucopyranoside、stigmasterol、β-sitosterol、sitosterol-3-O-β-D-glucopyranoside、behenic acid、tetracosanoic acid。刘金平等[25]从东北刺人参根的提取物中分离并鉴定出6 个化合物,分别是surcose、daueosterol、L-rhamnose、glucose、β-sitosterol、heptacosanal。王海静等[26]经过一系列分离纯化操作,鉴定出3-O-caffeoyl quinic acid、rhein、1-O-caffeoyl quinic acid。Huang 等[27]对刺人参采用了各种层析分析分离技术,分得单体并鉴定为oploxyne A、oploxyne B、oplopandiol、falcarindiol。邵莉等[28]利用大孔树脂,正、反相硅胶柱及制备HPLC 色谱方法分离纯化,根据理化性质和波谱数据鉴定了11 个酚苷化合物,其中7 个化合物为首次从该属植物中分得,分别为(E)-sinapic acid-4-O-β-D-glucopyranoside、3-hydroxyphenethyl alcohol 4-O-β-D-glucopyranoside、homovanillyl alcohol 4-O-β-D-glucopyranoside、dihydrosyringin、(+)-isolariciresinol-9′-O-β-D-glucopyranoside、(+)-isolariciresinol-4-O-β-D-glucopyranoside、(+)-5,5′-dimethoxylariciresinol 9′-O-β-D-glucopyranoside。结构见图3。

图3 其他类成分结构
2 药理作用
东北刺人参的传统功效为补气助阳、强心利尿,现代药理学研究发现,刺人参具有广泛的药理作用,包括抗菌、抗炎、抗衰老、抗惊厥、抗疲劳、解热、改善睡眠、调节血压、改善生殖功能和降糖等。刺人参在临床上被用于治疗慢性疲劳综合症、神经衰弱、心血管疾病、糖尿病、风湿病、胃肠道功能紊乱等多种疾病[2]。
2.1 抗菌 东北刺人参具有显著的抗菌作用,其有效成分主要为挥发油类。宓鹤鸣等[6]研究表明,刺人参对五种真菌均有明显的抑杀作用,最小抑菌浓度均为0.062 5%,但对白色念珠菌无明显抑杀作用。付爱华等[29]采用试管内药基法,对东北刺人参挥发油进行抗真菌实验研究,结果显示其具有很强的抗真菌活性,对常见皮肤癣菌有抑菌和杀菌作用,用1%刺人参挥发油配制的霜剂对皮肤无刺激性,治疗皮肤癣菌病有效率达90%。张宏桂等[30]发现野生东北刺人参茎挥发油对红色毛癣菌等7 种皮肤癣菌抗菌活性。刘兵等[31]研究表明水溶性大的组分抗真菌活性强。通过连续稀释法在固体营养培养基上体外评估刺人参精油的抗真菌活性,针对小孢霉菌,紫色毛癣菌和絮状表皮癣菌的菌丝体均表现出了抑菌效果[32]。
2.2 抗炎 野生东北刺人参和人工培植东北刺人参不定根均具有抗炎作用。张树臣等[33]用刺人参茎40%醇提取物,按10 g/kg 剂量给大鼠灌胃,能够明显地抑制其甲醛性、蛋白性、右旋醣酐性关节炎的产生以及炎性肉芽肿的形成,然而对切除肾上腺大鼠的右旋醣酐性关节炎则无作用。曲淑岩等[34]研究发现,刺人参挥发油对角叉菜胶引起的正常大鼠和切除肾上腺大鼠的足肿胀有抑制作用,对组胺或PGE2引起的大白鼠足肿胀有抑制作用,能降低炎症组织渗出液中组胺和PGE2的含有量,并对组胺或PGE2引起的毛细血管的通透性增加、对白细胞游走及大白鼠棉球肉芽肿均有抑制作用。李贺等[35]研究表明2 种东北刺人参不定根提取物中总酚和总黄酮含有量有很大差异,诱导子处理的不定根水提物中总酚含有量是诱导子未处理不定根水提物的3.2 倍,而总黄酮含有量是2.7 倍,因此,今后在进行抗炎相关产品生产中,可利用在生物反应器培养中经诱导子处理的东北刺人参不定根作为原材料。
2.3 延缓衰老 东北刺人参延缓衰老的作用与其抗氧化作用有关。傅颖新等[36]给小鼠连续灌服刺人参根及根茎醇提取物0.5 mL/25 g,可延长实验小鼠持续游泳的时间,提高小鼠耐缺氧及耐低温的能力;对糖代谢紊乱所致的小鼠亚急性衰老模型症状有逆转作用,与人参呈现相似的抗衰老作用。孙仓等[37]发现用刺人参醇水提取物可延长小鼠持续游泳的时间83.28%,小鼠耐缺氧能力提高64.08%,可使糖代谢紊乱所致的小白鼠亚急性衰老病理模型的衰老症状逆转。李慧娟[38]用酚和多糖的提取液进行抗氧化活性测定,两者对DPPH 自由基的消除率,不定根明显高于栽培2 年生和5 年生的东北剌人参植株的根和茎,酚和多糖提取液的DPPH 自由基消除率最高分别达到94%、88%。
2.4 抗惊厥 东北刺人参油乳剂对戊四氮引起的惊厥或电惊厥有拮抗作用。采用戊苯四唑诱导小鼠的癫痫发作,小鼠的垂直活动增加了88%,刺人参挥发油可保持动物安静,温顺,并且不具有运动活性。。
2.5 改善睡眠 本课题组对东北刺人参改善睡眠作用的有效部位和作用机制进行研究,初步确定东北刺人参改善睡眠的有效部位为60%乙醇洗脱组分,有效成分主要为皂苷类成分[39]。曲淑岩等[40]腹腔注射0.67 mL/kg 刺人参油乳剂时可使小鼠安静、驯服、自主活动减少;对戊巴比妥钠、水合氯醛和氯丙嗪、眠尔通有协同作用。李廷利等[41]、许雷[42]选择ICR 种属的小鼠,利用戊巴比妥钠所致小鼠睡眠时间的实验方法,以睡眠潜伏时间和睡眠持续时间为观察指标,开展了刺人参的有效部位改善睡眠作用的量-效与时-效关系的研究,发现刺人参有效部位改善睡眠的作用与中枢神经递质调节机制和一氧化氮调节机制有关。
2.6 调节血压 研究发现,东北刺人参对大鼠血压的影响具有双向调节作用,其主要有效成分为皂苷类。王广树等[43]用刺人参叶皂甙静脉注射,使大鼠平均动脉压升高,此作用可被α 受体阻断剂妥拉苏林对抗,但不被β 受体阻断剂普萘洛尔阻断;减少剂量,可使动脉压降低。陈霞等[44]观察了刺人参皂苷(CRS)静脉注射对大鼠血压等的作用,CRS(10 mg/kg)静脉注射可使大鼠平均动脉压下降,而CRS(30、100 mg/kg)则可引起大鼠MAP 明显升高,此作用可被妥拉苏林对抗;同时测定血浆单胺类物质浓度的结果表明,给予CRS(30 mg/kg)后,大鼠血浆中NA 含有量明显升高。何晓燕等[45]给用戊巴比妥钠麻醉的动物本品酊剂(10~50 mg/kg),可使动物血压轻度升高,剂量增加(100~200 mg/kg)反使动脉血压下降,同时出现呼吸兴奋作用。许镇等[46]研究表明,刺人参皂苷对大鼠血压产生双向调节的作用,并初步说明升压作用可能与α受体有关。
2.7 促进造血 何晓燕等[47]采用眼眶静脉取血法制造失血性贫血小鼠模型,然后用0.5、1.0、2.0 g/mL 东北刺人参水煎液对小鼠进行灌胃处理后,小鼠外周血红细胞数、白细胞数及血红蛋白含有量均有不同程度的升高,其中1.0 g/mL 东北刺人参水煎液对失血性贫血小鼠的补血作用最显著。
2.8 对心脏的影响 何晓燕等[45]发现20 mg/kg 东北刺人参总苷可使麻醉家兔动脉压轻度降低和呼吸兴奋,给麻醉猫80~100 mg/kg 总苷,使心肌收缩幅度增加20%~30%,心律减少5~10 次,亦可增加大鼠在体心跳幅度。Turova等[48]发现,刺人参的纯化糖苷在低剂量(10~50 mg/kg)时对猫的心率无影响,但增加到80~100 mg/kg 时心脏收缩幅度显着升高20%~30%,心率减少5~10 次/min。
2.9 增强肾上腺皮质能 《长白山植物药志》记载,给大白鼠茎的40%醇浸出物10 g/kg 可使大鼠两侧肾上腺内维生素C 的含有量明显降低,当垂体切除后本品的上述作用则消失,表明刺人参兴奋肾上腺皮质功能是通过垂体或垂体以上部位进行的,预先注射戊巴比妥钠不能阻止刺人参上述兴奋作用,但能被预先注射氯丙嗪加戊巴比妥钠所阻滞。40%乙醇提取物(10 g/kg)对大鼠的口服给药导致完整大鼠肾上腺抗坏血酸的显着消耗,而在垂体后叶切除的大鼠中没有观察到效果提示刺人参对垂体-肾上腺系统有刺激作用。
2.10 解热 曲淑岩[40]发现刺人参可降低动物体温。王广树等[43]发现刺人参挥发油的油乳剂可以减轻化学性物质引起的疼痛,对啤酒酵母引起的人工发热有明显的缓减作用,并有降低大白鼠正常体温的作用。
2.11 适应原样 东北刺人参被认为具有与人参类似的适应原样作用,具有显著的耐缺氧和抗疲劳作用,在中国、俄罗斯和韩国,它被用于治疗慢性疲劳综合症。单次口服10%乙醇提取物5 mL/kg 后,小鼠力竭游泳时间比对照增加了36%。在青蛙中观察到酊剂(10~200 μg)的兴奋作用[48]。皮下注射酊剂(5 mL/kg)15~20 min 后小鼠运动能力显着增强,持续30~40 min。然而,刺人参的纯化糖苷(25~50 mL/kg)对小鼠的刺激作用持续了2 h[48]。在耐缺氧实验中,低压缺氧和缺氧伴高碳酸血症的小鼠,连续7 d 给与刺人参根提取物(2.5 g/kg),模型小鼠幸存率分别增加了42%/34%[49]。胡彦武[50]用不同剂量东北刺人参茎给正常小鼠连续灌胃14 d,测定其负重游泳时间、耐缺氧时间、血乳酸含有量,结果显示,东北刺人参茎5.2、2.6、1.3 g/kg 剂量组能延长小鼠的耐缺氧时间和负重游泳时间,且能降低小鼠血乳酸含有量。
2.12 降糖 东北刺人参脱醇酊剂具有一定的抗糖尿病作用。用脱醇酊剂(2.5 g/kg)口服预处理四氧嘧啶诱导的糖尿病小鼠,MDA 水平显著降低34%,与对照组相比血糖水平降低了16%。在注射四氧嘧啶48 h 后小鼠开始口用酊剂(2.5 g/kg,6 d),与对照组相比,导致肝脏中的糖原增加45%,而葡萄糖水平趋于降低。肾上腺素诱导的高血糖大鼠在灌胃给与东北刺人参酊剂后,其血糖水平下降了18%。在用酊剂预处理的大鼠中升高的血糖水平降低了18%,并且伴随着肝脏中糖原的增加。
2.13 促进性功能 东北刺人参根10%乙醇提取物可以影响小鼠生殖道的成熟。研究发现,雌性青春期前小鼠连续口服0.25 mg/kg 剂量的提取物24 d,90%小鼠已经过发情期,完成它们的第1 次发情周期。而对照组只有50%小鼠达到这一点[45]。这些数据提示了刺人参提取物对雌性大鼠生殖道成熟的刺激作用。
2.14 增强免疫功能 胡彦武[51]采用环磷酰胺造模法制作小鼠免疫抑制模型,观察东北刺人参茎对其免疫器官脏器指数、碳粒廓清能力、迟发型超敏反应的影响,结果东北刺人参茎提取物5.2、2.6、1.3 g/kg 剂量组均能显著提高小鼠免疫脏器指数、单核巨噬细胞的吞噬功能及小鼠迟发型超敏反应。
3 小结及展望
通过整理近20 年国内外学者对东北刺人参化学成分和主要药理作用的研究发现,在化学成分方面,东北刺人参主要以挥发油和皂苷类成分为主,其次是脂肪酸、蒽醌、黄酮、甾醇及其氨基酸类等成分。另外东北刺人参具有广泛的药理作用,包括类似人参的适应原样作用、抗糖尿病、抗真菌、抗炎、抗氧化活性,以及对血压和生殖功能的影响。在中国,东北刺人参被用于治疗神经衰弱、心血管疾病、糖尿病和风湿病等;在韩国,它被用于治疗慢性疲劳综合症、糖尿病、胃肠道功能紊乱等[2]。尤其是东北刺人参安全性高,无不良反应,早在上世纪的苏联时期已被正式批准作为补品和抗糖尿病药物用于治疗轻度糖尿病。由于该植物对生长环境的要求较为苛刻,目前东北刺人参是长白山区最珍贵的濒危药用植物之一,为国家二级重点保护植物[52]。随着科学技术的发展,利用以植物组织培养技术为基础的生物反应器不定根培养方法,可快速获取大量东北刺人参不定根作为新植物材料[53-54]。此外,朱俊义等[55]、于丹等[56]开发了以东北刺人参带叶柄的叶片为外植体,用培养基对愈伤组织诱导、增殖、分化、生根及种质保存以及利用生物反应器大量生产东北刺人参技术。值得注意的是近年来对东北刺人参的化学成分的研究鲜有报道,药代动力学几乎为空白,由于代表性成分无法确定,导致科学、合理的质量评价体系尚未建立。因此,为了进一步保护资源并开发其药用价值,有必要进一步加强东北刺人参的基础和临床应用研究。

