人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道菌群的影响
张世洋,刘美辰,唐 飞,王 晶,敖 慧
(成都中医药大学药学院,四川 成都 611137)
慢性萎缩性胃炎是一种常见的消化系统疾病,具有病因多、病程长、反复发作、易生癌变等特点[1]。中医认为,慢性萎缩性胃炎属于“胃脘痛”“痞满”“吐酸”“嘈杂”等范畴,脾胃气虚为其基本病机[2]。人参、白术是临床常用的健脾益气相须药对,主治脾胃气虚诸证[3],临床研究表明,以人参、白术为核心药对的方药(如四君子汤等)治疗慢性萎缩性胃炎效果确切[4],且多数方中两者比例为1∶1,如四君子汤、参苓白术散等,其中人参的主要活性成分为人参皂苷和人参多糖,白术的有效成分为白术多糖和白术挥发油。课题组前期证实,人参、白术有效组分群能有效缓解慢性萎缩性胃炎[5],但其机制尚未完全揭示。
随着“人类微生物组计划”进行到第二阶段[6],菌群对于人类健康的影响越来越受到人们的重视,研究菌群对机体的作用也逐渐成为近年来的热点。相关研究发现,菌群可影响宿主的发育、生理功能、免疫功能、能量代谢、营养状态等[7-9]。慢性萎缩性胃炎作为一种消化系统的疾病,常伴有泛酸、呕吐的症状,会对肠道及口腔的菌群产生影响,目前相关文献较少,主要集中于舌苔及胃内[10-12],未见同时对口腔及肠道菌群的研究。本研究采用16S rDNA 探究人参白术有效组分群对慢性萎缩性胃炎大鼠口腔及肠道菌群的影响,从菌群的角度探讨人参白术有效组分群治疗慢性萎缩性胃炎的作用,为进一步开发人参、白术药对提供科学依据。
1 材料
1.1 动物 SPF 级SD 大鼠,雌雄均有,体质量180~220 g,购自四川省医学科学院实验动物研究所,实验动物生产许可证号SCXK(川)2013-15。实验程序严格按照动物管理章程。
1.2 试剂与药物 白术、人参购于成都国际商贸城,由成都中医药大学药学院陈璐副教授鉴定分别为五加科植物人参Panax gingsengC.A.Meyer 的干燥根、菊科植物白术Atractylodes macrocephalaKoidz.的干燥根茎。1-甲基-3-硝基-1-亚硝基-胍(东京化成工业株式会社,批号NH8JH-DR);羧甲基纤维素钠(成都市科龙化工试剂厂,批号2014033101);无水硫酸钠(成都市科龙化工试剂厂,批号2015051801)。无水乙醇(成都市科龙化工试剂厂,批号2016082501);水为纯水。
1.3 仪器 HX-200 型高速中药粉碎机(浙江省永康市溪岸五金药具厂);Sartorius BP211D AG 电子天平(德国赛多利斯公司);ZDHW-1000 电热套(北京中兴伟业仪器有限公司);K850 临界点干燥仪(英国Quorum 公司);E-1045 离子溅射装置(日本株式会社日立高新技术事务所);Inspect 扫描电子显微镜(美国FEI 公司);Illumina HiSeq 测序平台。
2 方法
2.1 人参、白术有效部位提取
2.1.1 人参皂苷提取 称取900 g 人参粉末,加8倍量60%乙醇回流提取3 次,2 h/次,合并3 次滤液,回收乙醇至无醇味,过大孔吸附树脂柱,用水洗脱至流出液无颜色后,70%乙醇洗脱至流出液无颜色为止,收集流出液,减压浓缩至无醇味,80 ℃下烘干得粗品。
2.1.2 人参多糖提取 称取900 g 人参粉末,加10 倍水回流提取3 次,2 h/次,合并3 次滤液,低温冷置12 h,滤过,浓缩,加95% 乙醇至含醇量达60%,低温冷置12 h,离心,取沉淀,加适量水后进行2 次醇沉,烘干得粗品。
2.1.3 白术多糖提取 称取900 g 白术粉末,按“2.1.2”项下方法操作。
2.1.4 白术挥发油提取 称取900 g 白术粉末,装入水蒸气蒸馏提取器中,加入8 倍量蒸馏水,用电热套加热至微沸,提取8 h,收集蒸馏液,加入适量无水硫酸钠,除去下部蒸馏水得油状提取物,密封后置于4 ℃冰箱中保存。
2.1.5 药物制备 计算各有效部位提取物的生药量,根据人参、白术在四君子汤中各9 g 的剂量,将配伍比例设定为1∶1。按生药量比例进行折算,分别称取人参皂苷30 g、人参多糖35.17 g、白术多糖20.77 g、白术挥发油3.17 mL,溶于含0.1%羧甲基纤维素钠的蒸馏水中,配制成每1 mL 含0.15 g 人参生药、0.15 g白术生药的混合液备用。
2.2 造模、分组及给药 取SD 大鼠,随机分成空白组、模型组、给药组。除空白组外,用主动免疫法复制脾虚慢性萎缩性胃炎模型[13],以蒸馏水配制166.67 mg/L 1-甲基-3-硝基-1-亚硝基-胍替代饮用水,自由饮食,在造模第50、70 天随机抽取模型大鼠,进行胃组织病理学检测,判定模型复制情况。造模70 d 后,给药组给予每1 mL 含0.15 g 人参生药、0.15 g 白术生药的混合液,大鼠给药体积为1 mL/100 g,1 次/d,连续60 d,末日处死大鼠,取胃组织、口腔唾液及粪便保存。
2.3 胃黏膜组织病理学检查 胃组织以10%福尔马林溶液固定,进行常规石蜡包埋、切片、HE 染色,按炎症活动性程度分为0 分,正常;1 分,少量淋巴细胞和浆细胞浸润,累及固有膜浅层上1/3;2 分,多灶性炎细胞浸润,炎症累计固有膜以下达2/3;3 分,大量炎细胞浸润,呈灶性分布达2/3;4 分,弥漫性炎细胞浸润,甚至脓肿形成达2/3,伴肠化水肿。以萎缩性程度(黏膜固有层固有腺体的减少)作为评分指标,每项分为0 分,正常;1~2 为轻度,1 分,仅胃窦部表层有少量腺体变形,细胞变小,2 分,胃窦部浅层腺体呈局灶性萎缩,减少,达腺体上1/3,大小弯腺体正常;3 分为中度,胃窦及大小弯腺体均有萎缩减少,达腺体中2/3;4 分为重度,胃窦部大部分萎缩减少,仅残留少数原有腺体,大小弯腺体萎缩或黏膜显著变薄,原有腺体完全萎缩、消失,代之以化生腺体。
2.4 胃黏膜扫描电镜检查 胃组织用PBS 洗涤2次,5 min/次,用4%蔗糖溶液洗涤1 次,时间为5 min,酒精脱水(30%、50%、70%、80%、90%、95%、100%,每梯度10 min)。将样本轻轻粘在导电胶上,临界点干燥,真空喷镀,最后在镜下选择合适位置,适当倍数进行观察。
2.5 菌群样本DNA 的提取及16SrDNA 测序 采用SDS 方法对样本的基因组DNA 进行提取,利用琼脂糖凝胶电泳检测DNA 的纯度和浓度,取适量样品DNA 于离心管中,无菌水稀释至1 ng/μL,以稀释后的基因组DNA 为模板,PCR 扩增16S rRNA 基因V3-V4 区(341 正向5′-ACTCCTACGGGAGGCAGCAG-3′,806 反向 5′-GGACTACHVGGGTWTCTAAT-3′),PCR 产物使用2%琼脂糖凝胶进行电泳检测;根据PCR 产物浓度进行等量混样,充分混匀后使用1×TAE 2%琼脂糖胶电泳纯化PCR 产物,剪切回收目标条带。使用Ion Plus Fragment Library Kit 48 rxns 建库试剂盒进行文库的构建,经过Qubit 定量和文库检测合格后,使用Ion S5TMXL 进行上机测序。
以Shannon 指数和ACE 指数对菌群多样性及丰度进行描述。Shannon 指数用来估算样品中微生物的多样性指数,计算公式为其中S表示总的物种数,Pi表示第i个物种占总数的比例;ACE 指数是生态学中估计物种总数的常用指数之一,计算公式为其中Sabund是样本中出现超过10 次的物种的数目,Srare是出现不多于10 次的物种的数目,CACE表示所有低丰度(出现≤10 次)的物种中非单个种类的比例,Fi为含有i条序列的OTU 数目为变异系数。
2.6 统计学分析 采用SPSS 21.0 软件进行统计学分析,计量资料以(±s)表示,微生物多样性、丰度和菌群门、属水平上的差异均采用单因素方差分析,两两比较采用SNK 法;等级资料数据组间比较采用Kruskal-Wallis 检验分析,相关性分析采用Spearman Rank 检验。以P<0.05 为差异有统计学意义。
3 结果
3.1 胃黏膜层组织病理改变 空白组胃黏膜腺管排列整齐,形状大小一致,呈单柱状;壁细胞、主细胞界限清楚,壁细胞体积较大,胞浆嗜酸性,核小而圆;主细胞呈锥状或柱状,核圆;壁细胞固有层内胃腺体排列紧密整齐,未见或少见炎性细胞,黏膜下层无水肿。模型组黏膜层厚度较正常变薄,黏膜固有层腺体松散,体积减小,数量减少,细胞成分趋向单一,壁细胞、主细胞等明显减少;间质成分相对增多,累及黏膜全层的炎细胞浸润,以淋巴细胞和浆细胞为主。与模型组比较,给药组病理结果均有改善,腺管排列趋向整齐,黏膜固有层腺体数量增加,固有层炎症细胞数目减少,见图1。与模型组比较,给药组可抑制胃黏膜腺体萎缩,等级分布下降,胃组织病理学检查评分降低(P<0.05,P<0.01),见表1。
表1 各组大鼠慢性萎缩性胃炎病理评分(±s,n=8)Tab.1 Pathological scores for rats of chronic atrophic gastritis among various groups(±s,n=8)

表1 各组大鼠慢性萎缩性胃炎病理评分(±s,n=8)Tab.1 Pathological scores for rats of chronic atrophic gastritis among various groups(±s,n=8)
注:与模型组比较,*P<0.05,**P<0.01。
3.2 胃扫描电镜观察 胃黏膜扫描电镜结果显示,空白组大鼠胃黏膜上皮细胞紧密相连,被纵横交错的小沟分隔成许多胃小区,呈网眼状,胃小凹排列整齐,大小均匀一致。模型组大鼠胃黏膜出现皱襞隆起,表面粗糙,腺腔间黏膜变宽,胃小凹变形,大小不一,小凹壁上皮细胞萎缩,上皮广泛破溃、脱落。与模型组比较,给药组胃小凹形状大小趋向规则,萎缩程度得到缓解,有少量破溃。见图2。

图1 各组大鼠胃组织病理学变化(HE,×100)Fig.1 Histopathological changes of rat stomach among various group(HE,×100)

图2 各组大鼠胃黏膜扫描电镜观察(×1 000)Fig.2 Scanning electron microscopic observation of gastric mucosa of rats among various groups(×1 000)
3.3 人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道微生物多样性的影响 慢性萎缩性胃炎大鼠口腔、肠道微生物多样性具有同样的变化趋势,与空白组比较,模型组Shannon 指数下降(P<0.05);与模型组比较,给药组Shannon 指数上升(P<0.05)。与空白组比较,模型组大鼠口腔、肠道微生物均出现多样性减少,给予人参、白术有效组分群治疗后其口腔、肠道微生物多样性得到一定程度恢复。见图3。
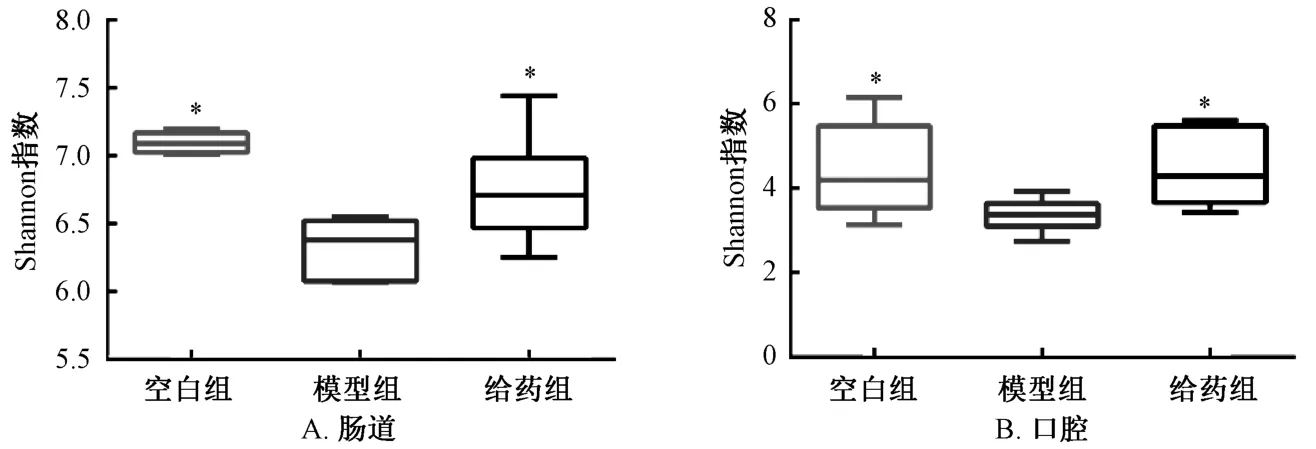
图3 人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道菌群Shannon 指数的影响(n=6)Fig.3 Effects of key effective components of GRAMR on Shannon index in oral and intestinal flora of rats with chronic atrophic gastritis(n=6)
3.4 人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道微生物丰度的影响 慢性萎缩性胃炎大鼠口腔、肠道微生物菌群丰度具有同样的变化趋势,与空白组比较,模型组 ACE 指数下降(P<0.05);与模型组比较,给药组ACE 指数上升(P<0.05)。与空白组比较,模型组大鼠口腔、肠道微生物均出现菌群丰度减少,给予人参、白术有效组分群治疗后其口腔、肠道微生物菌群丰度得到一定程度恢复。见图4。
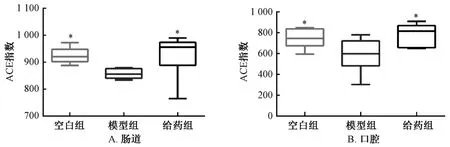
图4 人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道菌群ACE 指数的影响(n=6)Fig.4 Effects of key effective components of GRAMR on ACE index in oral and intestinal flora of rats with chronic atrophic gastritis(n=6)
3.5 人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道菌群门水平的影响 3 组大鼠肠道菌群序列主要分属于拟杆菌门、厚壁菌门和变形菌门;与空白组比较,模型组拟杆菌门、螺旋体门的比例下降,厚壁菌门、变形菌门、梭杆菌门的比例升高,给药组以上菌群门比例逆转(图5A)。3 组大鼠口腔菌群序列主要分属于变形菌门、厚壁菌门、拟杆菌门、梭杆菌门;与空白组比较,模型组变形菌门、放线菌门、酸杆菌门的比例下降,梭杆菌门的比例升高,给药组以上菌群门比例逆转(图5B)。与模型组比较,给予人参、白术有效组分群治疗后,口腔、肠道梭杆菌门的比例降低(P<0.05),见图6。

图5 人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道菌群门水平的影响(n=6)Fig.5 Effects of key effective components of GRAMR on phylum levels of oral and intestinal flora in rats with chronic atrophic gastritis(n=6)

图6 人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道梭杆菌门的影响(n=6)Fig.6 Effects of key effective components of GRAMR on oral and intestinal fusobacteria of rats with chronic atrophic gastritis(n=6)
3.6 人参、白术有效组分群对慢性萎缩性胃炎大鼠口腔、肠道菌群属水平的影响 在肠道菌群中,与空白组比较,模型组普雷沃氏菌属_9、普雷沃氏菌科_UCG-001 的比例下降,给药后上升;模型组普雷沃氏菌科_UCG-003、厌氧螺菌属、罗斯氏菌属的比例升高,给药后下降,以普雷沃氏菌科_UCG-003 更明显(P<0.05)。见图7A、图8A。
在口腔菌群中,与空白组比较,模型组叶杆菌属、奈瑟氏菌属、拟杆菌属、普拉梭菌属、普雷沃氏菌科_UCG-003 的比例下降,给药后上升;模型组不动杆菌属、梭杆菌属的比例升高,给药后下降,以梭杆菌属更明显(P<0.05)。见图7B、图8B。

图7 人参、白术有效组分群治疗慢性萎缩性胃炎大鼠后其口腔、肠道菌群属水平比较(n=6)Fig.7 Effects of key effective components of GRAMR on genus levels of oral and intestinal flora in rats with chronic atrophic gastritis(n=6)

图8 人参、白术有效组分群治疗慢性萎缩性胃炎大鼠后其口腔、肠道菌群属水平比较(n=6)Fig.8 Effects of key effective components of GRAMR on genus levers in oral and intestinal flora in rats with chronic atrophic gastritis(n=6)
3.7 人参、白术有效组分群治疗慢性萎缩性胃炎作用与口腔、肠道菌群相关性 大鼠炎症活动性程度和萎缩性程度与口腔和肠道菌群的丰度、多样性,以及门、属水平上的差异菌相关。见表2。

表2 大鼠慢性萎缩性胃炎病理评分与菌群相关性Tab.2 Correlation between pathological score and microflora of rats with chronic atrophic gastritis
4 讨论
慢性萎缩性胃炎属于胃癌前病变的一个重要阶段[14],多年来一直是消化道疾病领域研究热点。本实验通过主动免疫法复制大鼠慢性萎缩性胃炎,发现在病变过程中胃黏膜腺体出现萎缩,炎症浸润明显,电镜扫描表明模型组大鼠胃小凹变形,胃黏膜皱襞隆起;经人参、白术有效组分群治疗后,胃黏膜的萎缩程度及炎症程度得到显著改善,说明该有效部位群治疗慢性萎缩性胃炎疗效确切。
本研究通过16S rDNA 高通量测序技术对大鼠口腔、肠道菌群进行了测定,16S rDNA分子大小适中、突变率小,序列具有保守性和普遍性,是细菌系统分类学研究中最常用的手段[15],可克服传统体外分离培养技术种群丢失、种群结构不清等局限[16]。相关性分析结果显示,大鼠病理学炎性评分与其口腔和肠道菌群的丰度、多样性,以及门、属水平上的差异菌相关。与空白组比较,慢性萎缩性胃炎大鼠口腔、肠道菌群的多样性及丰度均显著降低;经人参、白术有效组分群治疗后均显著升高,提示它可恢复大鼠口腔、肠道菌群的多样性及丰度。
与空白组比较,在门水平上模型组大鼠口腔、肠道中的梭杆菌门均上升,人参、白术有效部位群治疗后下降;模型组大鼠口腔菌群中梭杆菌门的比例升高,而经人参、白术有效部位群治疗后下降。在属水平上,模型组大鼠肠道菌群中普雷沃氏菌科_UCG-003的比例升高,人参、白术有效部位群治疗后下降。模型组大鼠口腔、肠道菌群与空白组比较,菌群结构发生了变化,经人参、白术有效部位群治疗后得到一定恢复。梭杆菌中具核梭杆菌是口腔常见细菌,最初被认为是益生菌,现代研究表明其具有很强致病性,能引起多种口腔疾病,如牙周炎、牙髓炎、根尖周炎等[17-19];在消化道方面,具核梭杆菌被证明与肠道癌症密切相关,可在结直肠肿瘤中高度富集[20],并随结肠肿瘤的扩散而迁移[21],还可通过与肿瘤细胞表面的特定抗体结合的方式提高结直肠癌的复发率[22]。另外,普雷沃氏菌的升高则被证明与强直性脊柱炎有关[23]。由此推测,人参、白术治疗慢性萎缩性胃炎的机制可能与降低这些致病菌的比例相关。
综上所述,人参、白术有效组分群可显著改善大鼠胃黏膜萎缩程度及炎症水平,对慢性萎缩性胃炎具有缓解作用,并在一定程度上逆转口腔、肠道菌群下降的丰度和多样性,减少肠道、口腔中致病菌。本实验为人参、白术药对治疗慢性萎缩性胃炎的临床应用提供了科学依据,并证实其药效与其改善肠道、口腔微生态有一定关系。

