碱提桑黄菌丝体多糖的抗氧化活性
,*
(1.黄河水利职业技术学院环境工程学院,河南开封 475000;2.江苏大学食品与生物工程学院,江苏镇江 212013)
桑黄菌(Phellinuslinteus)属担子菌亚门(Basidiomycotina)、多孔菌科、木层孔菌属(Phellinus),是一种珍稀的药用真菌,有“森林黄金”之美称[1]。现代药理学研究证明,桑黄菌具有免疫调节、抗肿瘤、抗炎、抗过敏、抗血管生成和抗氧化等多种生理活性[1]。其中,多糖是其主要生物活性成分之一[2-4]。由于受自身生物特性和外界环境的影响,野生桑黄菌子实体稀少,人工栽培周期长,无法满足人们对珍稀桑黄菌资源的广泛需求,对桑黄菌进行人工发酵培养以获取桑黄菌丝体为其产业化开发提供了可能,且发酵周期短,不受季节和环境的限制,发酵所得菌丝体多糖与子实体多糖功效相当[1]。
目前,国内外研究桑黄多糖还主要以水提物或水提多糖为研究对象探究其抗氧化活性,对于涉及其他提取介质如酸、碱制备的多糖及其生物活性的研究也多以体外活性评价为主,限制了桑黄活性多糖的深度开发及应用[5-7]。如Kozarski等[6]通过热水提取和乙醇沉淀得到桑黄粗多糖,多糖含量为62.6%,在0.1~10 mg/mL浓度范围内,桑黄粗多糖的DPPH自由清除率为77.9%~86.9%。同样地,Luo等[7]通过热水提取和乙醇沉淀得到P.baumiiPilát菌丝体多糖(PBMP),多糖含量为61.82%,灌胃400 mg/kg BW的PBMP能够提高D-半乳糖诱导衰老小鼠血清中抗氧化酶活性和总抗氧化能力。由此可见,以往的研究大多采用水提醇沉的方法来制备桑黄多糖。
研究揭示[8-9],不同溶剂(如热水、酸、碱)提取对多糖的得率、理化性质、结构特征、生物活性及功能特性均有着重要影响。其中碱性溶液在提取过程中能够更好地破坏细胞壁中纤维素和半纤维素之间的氢键,这样使不溶性多糖从细胞壁当中释放出来,转化为可溶性多糖[10],能够使多糖的提取率明显提升,已被科技工作者广泛应用。张俐娜等经过多年研究建立了一种以1.25 mol/L NaOH/0.05% NaBH4碱性溶液提取香菇子实体多糖的新方法,并证实该方法具有高质、高效、低成本的优点,且提取的香菇多糖具有三螺旋结构[11]。因此,在前期研究基础上,为了进一步明确1.25 mol/L NaOH/0.05% NaBH4所制备多糖的功能活性,本文以液体发酵桑黄菌丝体为原料,采用1.25 mol/L NaOH/0.05% NaBH4为溶剂进行桑黄菌丝体多糖(PL-N)的提取与制备,分析PL-N的化学组成及基本理化性质,研究其体外清除自由基能力和对过氧化氢损伤神经细胞的保护作用;在此基础上,建立D-半乳糖诱导的小鼠衰老模型,评价PL-N的体内抗氧化活性,为充分利用桑黄资源、开发桑黄活性多糖类功能性食品或医药保健品提供理论依据。
1 材料与方法
1.1 材料与仪器
桑黄菌丝体 江西康道生物科技有限公司;液体发酵所用桑黄(P.linteus)菌株(菌株编号:KCTC 6190) 韩国模式培养物保藏所;雌性ICR种小白鼠60只(SPF级、6~8周龄、体重(20±2) g 江苏大学试验动物中心,动物许可证号:UJS-LAER-2017032201;1,1-二苯基-2-三硝基苯肼(DPPH)、过氧化氢(H2O2)、胎牛血清(FBS) 美国Sigma公司;超氧化物歧化酶(SOD)、谷胱甘肽-过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)及总抗氧化能力(TAOC)等试剂盒 南京建成生物工程研究所;抗坏血酸(VC)、D-半乳糖 国产分析纯,国药集团化学试剂有限公司。
SECURA124-1CN分析天平 赛多利斯科学仪器(北京)有限公司;HH-A恒温水浴搅拌器 江苏金坛市中大仪器厂;DL-5C离心机 上海安亭科学仪器厂;TGL-16高速台式冷冻离心机 长沙湘仪离心机仪器有限公司;101-3型电热恒温干燥箱 金坛市医疗仪器厂;LRH-250生化培养箱 上海恒科技有限公司;UV-1601紫外/可见分光光度计 北京瑞利分析仪器公司;Synergy HT多功能酶标检测仪 美国Bio-Tek公司。
1.2 实验方法
1.2.1 碱提桑黄菌丝体多糖的提取与制备 桑黄菌丝体粉末通过石油醚回流处理6 h,去除脂类及色素,自然干燥12 h,备用。预处理的桑黄菌丝体粉末(100 g)按体积比1∶10 (W/V)加入1.25 mol/L氢氧化钠/0.05%硼氢化钠溶液,常温提取3 h,2次。提取结束后,提取液用36%的乙酸中和至pH7.0,离心(4000×g,20 min),弃去沉淀。上清液减压浓缩,加入4倍体积95%乙醇沉淀,4 ℃静置过夜,离心(4000×g,20 min),取沉淀溶于水,Sevag试剂法脱蛋白9次,蒸馏水透析(截留分子量:8~14 kDa)48 h,冷冻干燥,得到碱提桑黄菌丝体多糖,记为PL-N[11]。
1.2.2 多糖基本理化性质测定 采用苯酚硫酸法测定总糖含量[12];采用硫酸咔唑法测定糖醛酸含量[12];采用考马斯亮蓝染色法测定蛋白质含量[12];采用酸降解联合气相色谱进行单糖组成分析[12]。
1.2.3 清除DPPH自由基活性的测定 清除DPPH自由基试验方法参考Konwarh等[13]的方法。不同质量浓度(0.05、0.1、0.5、1.5、2.0 mg/mL)的样品液3 mL分别加入1 mL 0.1 mmol/L DPPH乙醇溶液中,放置暗处室温反应30 min,于517 nm条件下测定其吸光值,VC作为阳性对照。按式(1)计算DPPH自由基清除率:
清除率(%)=[1-(A1-A2)/A0]×100
式(1)
式中,A0、A1、A2分别是空白对照(去离子水+DPPH溶液)、样品和DPPH、样品和乙醇溶液的吸光值。
1.2.4 清除羟自由基活性的测定 清除羟自由基试验参考闫景坤、Delattre等[12,14]的方法。向0.2 mL不同浓度(0.05、0.1、0.5、1.5、2.0 mg/mL)的样品中加入0.2 mL 5 mmol/L FeSO4,混匀后再加入0.2 mL 1%(v/v)H2O2,混匀后置室温下反应60 min。反应完成后,再加入1 mL去离子水,于510 nm处测定其吸光值,VC作为阳性对照。按式(2)计算羟自由基清除率:
清除率(%)=[(A0-A)/A0]× 100
式(2)
式中,A0、A分别是去离子水代替样品和样品的吸光值。
1.2.5 细胞保护试验 体外细胞保护试验参考Li等[15]的方法。多糖样品预先用0.1 mol/L PBS溶解成10 mg/mL的浓度,用0.1 mol/L PBS新鲜配制100 mmol/L过氧化氢,备用。SH-SY5Y神经细胞用含10%胎牛血清(FBS)的RPMI 1640培养液在37 ℃含CO2的培养箱中进行常规培养。将细胞以5×104个/孔细胞悬液接种到96孔板中,加入不同浓度的多糖溶液(10~80 μg/mL)预孵育24 h。随后,加入终浓度为80 μmol/L H2O2培养24 h,以正常细胞作为阳性对照,以未添加多糖氧化损伤的细胞作为阴性对照。细胞存活率通过MTT法测定,以百分比表示,如式(3)所示:
细胞存活率(%)=[(A1-A0)/(A2-A0)]× 100
式(3)
式中,A0、A1、A2分别是阴性对照、氧化损伤及多糖处理、阳性对照的吸光值。
1.2.6 动物饲养与试验设计 健康雌性ICR小鼠饲养在环境温度(23.0±0.5) ℃、相对湿度55%±5%、具有12 h白昼、12 h黑夜的昼夜循环周期的试验动物房中,试验期间小鼠自由摄食和饮水。适应性饲养3 d以后,将60只小鼠随机分为6组,每组10只,分别设定为第 Ⅰ 组,正常对照组:每天腹腔注射生理盐水(10 mL/kg BW)、灌胃生理盐水(25 mL/kg BW);第Ⅱ组,模型对照组:每天腹腔注射D-半乳糖(100 mg/kg BW)、灌胃生理盐水(25 mL/kg BW);第Ⅲ组,阳性对照组:每天腹腔注射D-半乳糖(100 mg/kg BW)、灌胃维生素C(VC,100 mg/kg BW);第Ⅳ组、第Ⅴ组和第Ⅵ组,分别为PL-N低剂量组、PL-N中剂量组和PL-N高剂量组:每天分别腹腔注射D-半乳糖(100 mg/kg BW)、灌胃PL-N低、中、高剂量(100、200、400 mg/kg BW),每三天禁食称重一次,连续饲养40 d[16]。
1.2.7 试样采集与制备 试验小鼠末次给药后禁食12 h,称重并断头处死,收集血液于1500×g离心10 min制备小鼠血清;取肝脏和肾脏称重用小剪刀将肝脏和肾脏样品剪碎,在研钵中倒入适量的经过冰浴的生理盐水快速充分研磨,然后用生理盐水配成10%的组织匀浆液,4000×g离心10 min,取匀浆上清液分别测定有关生化指标[16]。
1.2.8 脏器指数的测定 将取出的肝脏、脾脏和胸腺用生理水洗净,擦干,称重,按照下面公式计算小鼠的各个脏器指数:
肝脏、脾脏和胸腺指数(mg/g BW)=脏器质量/小鼠体重量
1.2.9 血清、肝脏匀浆中的抗氧化指标检测 肝脏匀浆中蛋白质含量以及血清和肝脏匀浆中的谷胱甘肽过氧化物酶(GSH-Px)活力、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)含量以及总抗氧化能力(TAOC)等指标采用南京建成生物工程研究所研制的抗氧化试剂盒,按试剂盒说明书要求检测。
1.3 数据处理
试验中所有数据都是三次测定的平均值(Mean)±标准偏差(SD),方差分析(ANOVA)用来评价各参数的显著性。
2 结果与讨论
2.1 碱提桑黄菌丝体多糖的基本理化性质
通过研究表明,碱提桑黄菌丝体多糖的总糖和糖醛酸含量分别为84.92%±0.51%、16.92%±0.40%,且不含蛋白质。Kim等[17]用碱溶液提法从裂褶菌中提取出来的水溶性多糖具有较高的多糖含量,与本研究具有一致性。单糖组成分析研究发现,PL-N 主要由D-阿拉伯糖、D-木糖、D-葡萄糖和D-半乳糖组成,其分子摩尔比为5.5∶7.8∶1.8∶1。这些结果表明通过1.25 mol/L NaOH/0.05% NaBH4提取得到的PL-N为酸性为杂多糖,这和Kozarski等[6]和Wang等[18]得出的结论一致。
2.2 碱提桑黄菌丝体多糖的体外抗氧化活性
2.2.1 清除DPPH自由基能力 PL-N和VC的清除DPPH自由基能力如图1所示。从图1中可以看出,PL-N显示出明显的清除DPPH自由基能力,且呈剂量依赖关系。当浓度为2.0 mg/mL时,PL-N的DPPH自由基清除率为72.1%,显示出良好的清除DPPH自由基能力,但是低于VC(0.1 mg/mL,94.1%)。Wang等[19]通过热水提取和柱层析分离从桑黄(P.nigricans)菌丝体中得到3个多糖组分(PNMP1、PNMP2和 PNMP3),研究发现,含有硫酸基团的PNMP2和PNMP3比中性多糖PNMP1具有较高的DPPH自由基清除能力。同样地,PL-N为含有羧基的酸性杂多糖,也显示出良好的DPPH自由基清除能力。多糖的清除自由基能力与它们的供氢能力有关,基团高活性的能力意味着更强的供氢能力,多糖中糖醛酸、硫酸基团的存在能够激活异头碳上的氢原子,进而显示出突出的清除自由基能力[19]。
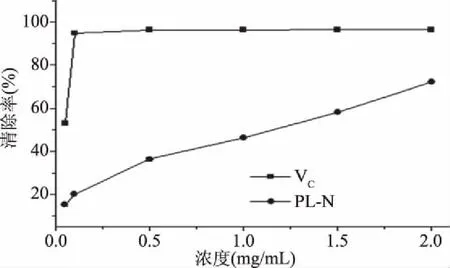
图1 PL-N的DPPH自由基清除能力Fig.1 DPPH free radical scavenging capacity of PL-N
2.2.2 清除羟自由基(·OH)能力 PL-N对羟自由基清除能力的试验结果如图2所示。从图2中可以发现,随着样品浓度的增加,PL-N的·OH清除能力呈增加趋势,在测定的浓度(0~2 mg/mL)范围内呈现明显的剂量依赖关系。在同样的浓度下,VC显示出很强的清除·OH能力,且在0.5 mg/mL时,达到最大清除率为91.2%。当样品浓度为2.0 mg/mL时,PL-N的·OH清除率为83.3%,说明PL-N桑黄菌丝体多糖具有良好的清除·OH活性,这与清除DPPH自由基的作用是一致的。谢丽源等[20]考察了桑黄粗多糖(SH)、纯化多糖组分(P-47000、P-8700)的体外清除自由基活性,研究表明,P-8700对羟自由基具有良好的清除效果,在浓度5.0 mg/mL时清除率达到53.42%,且高于SH和P-47000,但远低于PL-N的(83.3%,2.0 mg/mL)。这可能是由于通过1.25 mol/L NaOH/0.05% NaBH4提取分离得到的PL-N具有较高的总糖和糖醛酸含量,糖醛酸含量的高低与清除自由基能力及抗氧化活性有着直接关系[12]。此外,多糖的单糖组成、分子量、结构及其链构象也对清除自由基能力起到一定作用。

表2 PL-N对衰老小鼠血清中抗氧化酶活性和丙二醛含量的影响Table 2 Effect of PL-N on the activities of antioxidant enzymes and the content of MDA in serums of senile mice

图2 PL-N的羟自由基清除能力Fig.2 ·OH scavenging capacity of PL-N
2.2.3 细胞保护作用 图3为不同浓度的PL-N对H2O2诱导的SH-SY5Y细胞的保护作用。与正常细胞相比,H2O2诱导的神经细胞活性极显著降低(P<0.01),但是用不同浓度(10~80 μg/mL)的PL-N进行预处理后其细胞活性出现了显著提高(P<0.05)。在浓度为80 μg/mL时,用PL-N进行预处理后的细胞存活率为88.7%。结果表明,PL-N具有良好的细胞保护作用,从而显示了其突出的抗氧化活性。这与前面的清除DPPH和羟自由基试验具有很好的一致性。
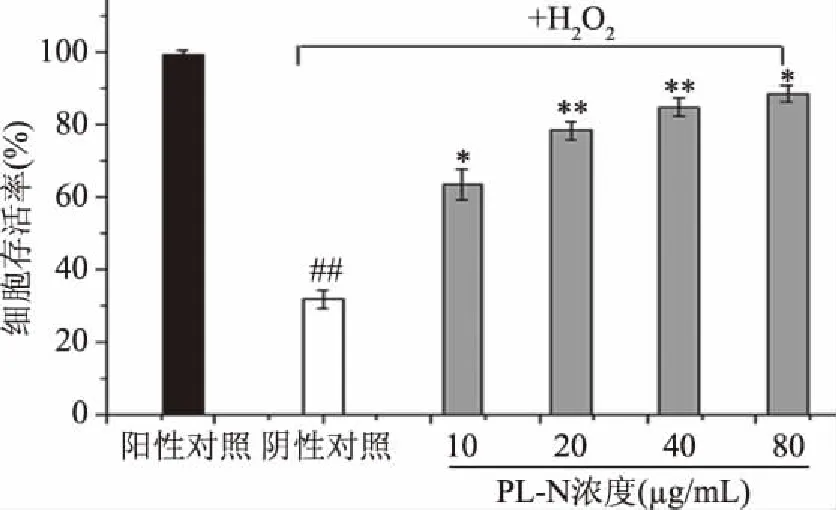
图3 不同浓度PL-N对过氧化氢诱导的 SH-SY5Y细胞损伤的保护作用Fig.3 Cytoprotective effects of different concentrations of PL-N on H2O2-induced SH-SY5Y cell injury注:与阴性对照相比,*表示显著(P<0.05), **表示极显著(P<0.01);与阳性对照相比, ##表示极显著(P<0.01)。
2.3 碱提桑黄菌丝体多糖的体内抗氧化活性
2.3.1 PL-N对模型小鼠脏器指数的影响 各组小鼠肝脏、胸腺、脾脏指数结果如表1所示,和正常组相比,D-半乳糖处理的模型组小鼠的三种脏器指数显著降低(P<0.05);与模型组对比,阳性对照(VC)组、PL-N处理组的三种脏器指数均有不同程度的提高,中剂量和高剂量PL-N处理组显著性提高(P<0.05),且均呈现一定的浓度依赖关系。总的来讲,D-半乳糖处理的模型组的肝脏、胸腺和脾脏重量降低,功能衰退,灌胃不同剂量的PL-N对以上三种脏器的衰老均有一定程度的抑制作用,从而对机体的免疫器官起到保护作用。

表1 PL-N对D-半乳糖诱导衰老小鼠脏器指数的影响Table 1 Effect of PL-N on organ index of D-galactose-induced senile mice
注:与模型对照组相比,*表示显著(P<0.05),**表示极显著(P<0.01),***表示高度显著(P<0.001);表2、表3同。
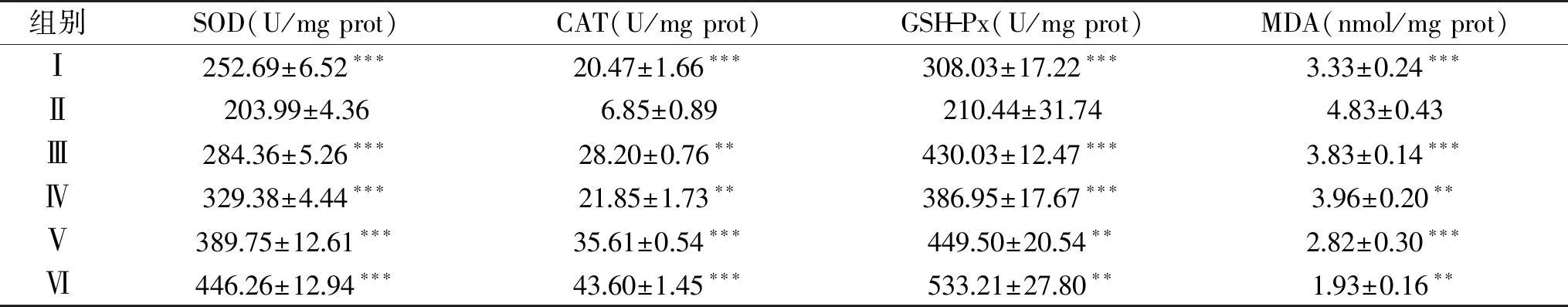
表3 PL-N对衰老小鼠肝脏中抗氧化酶活性和丙二醛含量的影响Table 3 Effect of PL-N on the activities of antioxidant enzymes and the content of MDA in livers of senile mice
碱提桑黄菌丝体多糖PL-N对衰老小鼠血清和肝脏中抗氧化酶活力的影响如表2和表3所示。从表2、表3中可以看出,与正常对照组相比,D-半乳糖诱导模型组衰老小鼠的血清和肝脏中抗氧化酶(SOD、CAT、GSH-Px)活性显著减小(P<0.05),说明模型建造成功。与模型对照组相比,阳性对照组的抗氧化酶活力均极显著提高(P<0.01);碱提桑黄菌丝体多糖PL-N各处理组小鼠血清和肝脏中抗氧化酶活力均显著提高(P<0.05),其中PL-N高剂量组的效果最佳。这些结果表明,PL-N能够提高D-半乳糖所致的氧化损伤小鼠体内的SOD、CAT和GSH-Px活力,增强其体内自由基清除能力。
通过测定丙二醛(MDA)量能够反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度[24]。如表2和表3所示,正常对照组小鼠血清和肝脏中MDA含量均低于模型对照组,差异显著(P<0.05),说明D-半乳糖致小鼠衰老模型建模成功。阳性对照组、PL-N低剂量、PL-N中剂量和PL-N高剂量组的小鼠血清和肝脏中MDA含量与模型对照组相比差异极显著(P<0.01),且呈一定的剂量效应关系。这些结果表明,碱提桑黄菌丝体多糖PL-N能够显著降低衰老小鼠血清和肝脏中的MDA含量,抑制生物膜脂质过氧化反应,具有明显的抗氧化作用。
2.3.3 PL-N对模型小鼠肝脏中总抗氧化能力的影响 各组小鼠肝脏中的总抗氧化能力(TAOC)如图4所示,与正常对照组相比,模型对照组小鼠肝脏中的TAOC能力极显著降低(P<0.01),表明在D-半乳糖的诱导损伤下,小鼠机体的总抗氧化能力明显削弱;与模型对照组相比,阳性对照组的TAOC能力高度显著提高(P<0.001);灌胃不同浓度PL-N后,与模型对照组相比,PL-N各处理组小鼠肝脏中的TAOC明显增加。表明 PL-N能明显抑制或者治疗D-半乳糖诱导引发小鼠TAOC的降低,并能提高肝脏组织的TAOC水平。经统计学处理,均有高度显著性差异(P<0.001),且呈明显的剂量效应关系。结果表明PL-N能够显著增强机体总抗氧化能力的活性。

图4 肝脏中的总抗氧化能力Fig.4 TAOC in liver注:与模型对照组相比,**表示极显著(P<0.01), ***表示高度显著(P<0.001)。
近年来,国内外研究者通过建立D-半乳糖诱导的小鼠模型来评价不同桑黄菌来源和不同提取分离方法所得到的不同结构特征的桑黄多糖的体内抗氧化活性,并揭示其构效关系,为功能性食品开发提供理论指导。Luo等[7]研究了桑黄菌丝体(P.baumiiPilát)多糖PBMP的理化性质和体内抗氧化活性,研究发现,PBMP主要由葡萄糖、半乳糖、岩藻糖、甘露糖和鼠李糖组成的杂多糖,灌胃PBMP能够明显且呈剂量依赖地增加D-半乳糖诱导衰老小鼠的体内抗氧化酶活性,降低血清和肝脏中丙二醛含量。同样地,Yan等[25]通过热水提取和柱层析分离从桑黄菌丝体(P.linteus)得到一高分子量(~290000 kDa)的水溶性杂多糖(PLP1-1),体内抗氧化研究表明,PLP1-1能够明显地提高血清和肝脏中抗氧化酶(SOD、GSH-Px和CAT)活性,降低丙二醛含量。以往报道的研究结果均略低于本研究PL-N的,这可能是因为PL-N具有较高的多糖和糖醛酸含量,此外,通过该方法提取得到的多糖或许具有较为有序的链构象,这也将有助于其高抗氧化活性的发挥。
3 结论
碱提桑黄菌丝体多糖PL-N的总糖和糖醛酸含量分别为84.92%±0.51%和16.92%±0.40%,且不含蛋白质;PL-N主要由D-阿拉伯糖、D-木糖、D-葡萄糖和D-半乳糖组成,其分子摩尔比为5.5∶7.8∶1.8∶1。体外清除自由基和细胞实验研究表明,PL-N能够明显地清除DPPH和·OH自由基的能力和对过氧化氢损伤的神经细胞的保护作用,揭示其具有良好的体外抗氧化活性。利用D-半乳糖所致的小鼠亚急性衰老模型,综合评价PL-N的体内抗氧化活性。研究发现,PL-N灌胃40 d后,小鼠(胸腺、脾脏、肝脏)脏器指数,血清和肝脏中的SOD、GSH-Px、CAT活性均显著增加(P<0.05);MDA含量极显著降低(P<0.01);小鼠肝脏中TAOC高度显著提高(P<0.001),且呈剂量依赖关系。这些结果揭示 PL-N 具有明显的体内抗氧化活性,可作为功能性食品应用于膳食、理疗中。

