FOLFOX联合靶向药物治疗K-ras野生型晚期大肠癌患者的疗效分析
马红兵,党 明,刘志刚,奚 颖,石宗林,王 超,杨 洋,杨得振,熊宗恒
1.陕西省安康市中医医院肿瘤科,陕西安康 725000;2.陕西省肿瘤医院胸外科,陕西西安 710000;3.陕西中医药大学附属医院肿瘤内科,陕西咸阳 712000;4.陕西中医药大学附属医院肿瘤外科,陕西咸阳 712000
大肠癌是目前消化系统最常见的恶性肿瘤,近年来我国大肠癌的发病率逐年上升[1]。目前,氟尿嘧啶类药物联合奥沙利铂(FOLFOX)或伊立替康(FOLFIRI)是晚期大肠癌患者最主要的治疗方案,但临床研究发现单纯采用这些化疗药物对患者的生存期改善并不明显[2]。而近年来,靶向药物如西妥昔单抗和贝伐珠单抗等在晚期肿瘤的治疗中效果不俗,使得晚期肿瘤患者生存期得以延长[3]。有研究表明,西妥昔单抗联合FOLFOX方案对于晚期大肠癌患者的治疗具有协同性[4]。基于此,本研究将西妥昔单抗与FOLFOX化疗方案联合应用于鼠类肉瘤病毒癌基因(K-Ras)野生型的晚期大肠癌患者治疗,现报道如下。
1 资料与方法
1.1一般资料 选取安康市中医医院(以下简称“本院”)2016年1月至2017年1月收治的80例K-Ras野生型晚期大肠癌患者为研究对象,采用随机数字表法将这些患者分为研究组与对照组,每组40例。研究组男22例,女18例;年龄40~79岁,平均(57±2)岁。对照组男24例,女16例;年龄38~78岁,平均年龄(58±3)岁。本研究内容均告知患者及家属,并且签署知情同意书。本研究经本院伦理委员会审批通过。两组患者的年龄、性别、原发灶部位、转移灶数目等一般资料比较,差异均无统计学意义(P>0.05)。见表1。
1.2纳入标准与排除标准 本研究所选取病例均需符合以下标准:(1)所有患者均经病理学和影像学确诊为大肠癌[5];(2)所有患者原发肿瘤组织均经K-Ras基因检测为野生型;(3)所有患者的肿瘤病灶均不可切除;(4)预计生存期>3个月。排除标准:(1)严重的心、肝、肾等其他系统疾病患者;(2)糖尿病患者;(3)癌灶导致消化道梗阻者;(4)近期有活动性出血或凝血功能障碍者;(5)对FOLFOX化疗方案不耐受者。
1.3方法 对照组患者采用FOLFOX化疗方案进行治疗,具体治疗方案如下:以mFOLFOX6方案给予患者治疗4个疗程,治疗完成后评估其疗效,效果显著者继续应用该方案治疗,无效或加重患者采用mFOLFIRI6方案继续治疗。mFOLFOX6方案如下:奥沙利铂100 mg/m2,加入生理盐水中静脉滴注,3 h内完成,以上方法维持1 d;亚叶酸钙400 mg/m2,加入生理盐水中静脉滴注,2 h内完成,以上方法维持1 d;氟尿嘧啶2 400 mg/m2,加入生理盐水中静脉滴注,持续46 h,以上方案两周为1个疗程。mFOLFIRI方案如下:伊立替康180 mg/m2,加入生理盐水后静脉滴注,1.5 h内完成;四氢叶酸钙400 mg/m2,加入生理盐水后静脉滴注,2 h内完成;氟尿嘧啶2 400 mg/m2,加入生理盐水中静脉滴注,持续46 h,以上方案两周为1个疗程。
研究组患者在对照组患者的基础之上加用靶向药物治疗:贝伐珠单抗注射液(注册证号:S20120068)15 mg/kg静脉滴注,每月两次(由Roche Pharma Ltd.生产,F.Hoff-mann-La Roche Ltd.公司分装);西妥昔单抗注射液(注册证号:S20110009)每周250 mg/m2(德国Merck KGaA生产,德国默克公司分装);维克替比注射液9 mg/kg(美国Amgen公司生产),每周1次。

表1 两组患者一般资料比较
1.4评价指标 比较两组患者的肿瘤标志物、临床疗效、生存率以及不良反应发生情况。肿瘤标志物主要包括高尔基体蛋白73(GP73)、缺氧诱导因子(HIF-1α)、高迁移率族蛋白B1(HMG B1),对上述标志物采用酶联免疫吸附(ELISA)法检测。疗效判定按照RECIST提出的大肠癌伴肝转移疗效判定标准将治疗效果分为4个层次,分别为:完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),总有效率=(CR例数+PR例数)/本组病例数×100%。两组患者统计1、2年生存率。

2 结 果
2.1两组患者治疗前后血清肿瘤标志物水平比较 研究组与对照组患者的血清肿瘤标志物水平比较,治疗前差异无统计学意义(P>0.05)。治疗后,两组肿瘤标志物水平与治疗前相比,差异均有统计学意义(P<0.05);治疗后研究组肿瘤标志物水平与对照组相比,差异有统计学意义(P<0.05)。见表2。
2.2两组患者临床疗效对比 研究组和对照组总有效率比较,差异有统计学意义(χ2=4.856,P=0.023)。见表3。
2.3两组患者生存率比较 研究组和对照组患者1、2年生存率对比,差异均有统计学意义(P<0.05)。见表4。
2.4两组患者不良反应发生情况比较 治疗后1~5 d,两组中均有部分患者出现不同程度的发热、恶心呕吐、肝区疼痛等,经对症处理后均在两周内恢复。两组患者的不良反应发生率差异无统计学意义(P>0.05)。
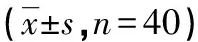
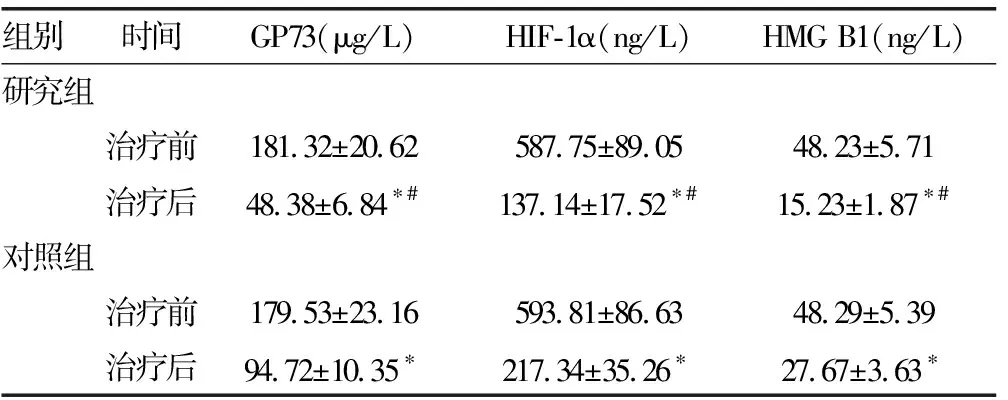
组别时间GP73(μg/L)HIF-1α(ng/L)HMG B1(ng/L)研究组治疗前181.32±20.62587.75±89.0548.23±5.71治疗后48.38±6.84∗#137.14±17.52∗#15.23±1.87∗#对照组治疗前179.53±23.16593.81±86.6348.29±5.39治疗后94.72±10.35∗217.34±35.26∗27.67±3.63∗
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
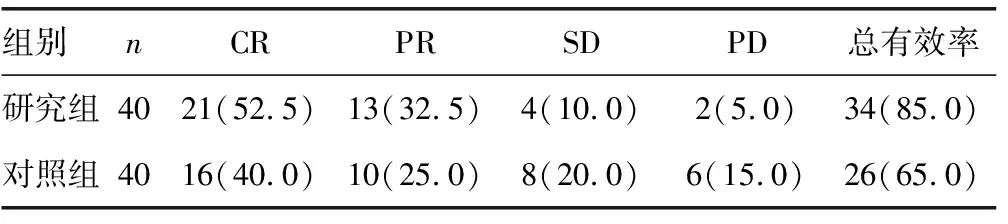
表3 两组患者临床治疗效果比较[n(%)]
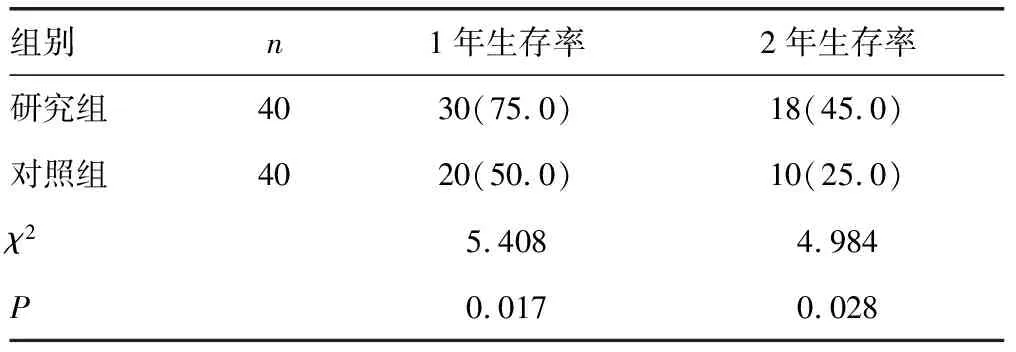
表4 两组患者生存率比较[n(%)]
3 讨 论
大肠癌为消化道常见的恶性肿瘤,就其发病率而言,仅次于胃癌[6]。近年来,大肠癌的发病率呈逐年上升趋势。目前对于大肠癌的治疗仍以手术为主,国内大肠癌患者的手术切除率为50%~70%,然而,部分患者确诊时已出现转移,70%~80%转移性结直肠癌患者不能进行根治性手术,即便手术也不能完全避免复发。且术后仍有30%~40%的患者复发,并最终因肿瘤远处转移或相关并发症而死亡[7-9]。因此,晚期肿瘤患者的生存预期较短且患者的生活质量较差。
化疗对于大肠癌晚期患者的治疗具有较为重要的意义。目前常用的化疗方案是FOLFOX化疗方案,国内外已有研究证实FOLFIRI方案用于晚期大肠癌患者疗效确切,有助于延长患者生存期[10]。但是随着近年来贝伐珠单抗、西妥昔单抗、维克替比等靶向治疗药物在肿瘤中的应用,人们发现FOLFOX化疗方案联合这些靶向药物的治疗有效率更高,对于提升化疗疗效具有更好的效果。KOSHIYAMA等[11]研究发现上述靶向治疗药物中,贝伐珠单抗对血管的表皮生长因子具有明显的抑制作用,可有效抑制肿瘤组织的血管生长;西妥昔单抗能够促进肿瘤细胞内凋亡基因的激活,使失去调控的肿瘤细胞的凋亡程序得到恢复,另外还能抑制酪氨酸激酶的活性,阻断细胞内信号转导途径,从而抑制癌细胞的增殖,诱导癌细胞的凋亡[12-13]。目前,靶向治疗已经成为除外科手术、放射治疗和化疗之外的第4种大肠癌治疗方法。但随着靶向药物的逐步应用,人们发现上述靶向药物治疗只对K-Ras基因野生型患者有效。K-Ras 基因是一个编码表皮生长因子受体(EGFR)信号转导通路Ras蛋白的基因[14],在K-Ras野生型肿瘤中,该蛋白受到严格调控,EGFR靶向药物西妥昔单抗可有效阻断其下游信号的传导,抑制肿瘤生长;然而在K-Ras突变的肿瘤中,Ras蛋白持续活化,不再依赖上游EGFR信号,从而对EGFR靶向药物不敏感。
为探讨靶向药物联合mFOLFOX6方案对K-Ras野生型大肠癌的效果,笔者选取了80例K-Ras野生型晚期大肠癌患者,对其采用单纯mFOLFOX6化疗方案或mFOLFOX6化疗联合靶向药物治疗,发现采用mFOLFOX6化疗联合靶向治疗的研究组患者,其治疗后肿瘤标志物水平明显降低,且与采用mFOLFOX6化疗的对照组相比,下降更明显(P<0.05)。在临床疗效对比上发现,研究组患者更佳(P<0.05),在远期疗效(生存率)的对比上,研究组患者的生存率明显优于对照组患者(P<0.05)。而两组患者的不良反应发生情况比较,差异无统计学意义(P>0.05)。
综上所述,采用mFOLFOX6化疗方案联合靶向治疗较单纯采用mFOLFOX6化疗方案效果更好,能够有效地延长患者生存期,不良反应可耐受,值得临床工作中借鉴应用。

