染色体病的分子诊断
程 伟
重庆医科大学附属第一医院临床分子医学检测中心,重庆 400016
1 染色体病的分子基础
染色体数目或者结构的变化,可以使某个或多个基因增加或者缺失,从而导致基因表达改变,进而引起机体的形态、结构和功能发生变化,在临床上表现为一组特定的疾病症状群,称为染色体病。染色体异常的类型可以分为染色体数目异常及染色体结构异常[1]。
1.1染色体数目异常与疾病 染色体数目异常包括染色体组以倍数增加或减少的整倍性数目异常、单个或数个染色体增减的非整倍性数目异常及嵌合体3种类型。整倍性数目异常是指体细胞含有的染色体组倍数超过2倍(2n)。非整倍性数目异常是指正常的染色体组中,丢失或增加了一条或几条完整的染色体。常见的染色体数目异常疾病见表1。
1.2染色体结构异常与疾病 由于物理、化学、生物、遗传和母亲年龄等因素的影响,体细胞中染色体结构会发生一定程度的异常改变,被称为染色体结构异常或染色体畸变。导致染色体结构异常的基础是染色体断裂和断裂后的异常重接。临床上常见的结构异常类型有缺失、重复、倒位、易位以及等臂染色体和环状染色体等。图1是染色体结构异常的常见类型。
2 染色体病的分子诊断策略
2.1荧光原位杂交(FISH)技术 FISH技术是20世纪80年代末在放射性原位杂交技术的基础上以荧光标记取代同位素标记而建立起的一种新的原位杂交方法,见图2。其基本原理是将核酸探针直接标记荧光或间接标记报告分子(生物素、地高辛等),依照碱基互补配对的原则与待测标本中的染色体或DNA纤维切片上的靶核酸序列进行杂交,使用荧光显微镜观察荧光信号,实现对待测标本中的靶核酸序列定位、定性及相对定量分析[2]。

表1 常见染色体数目异常疾病
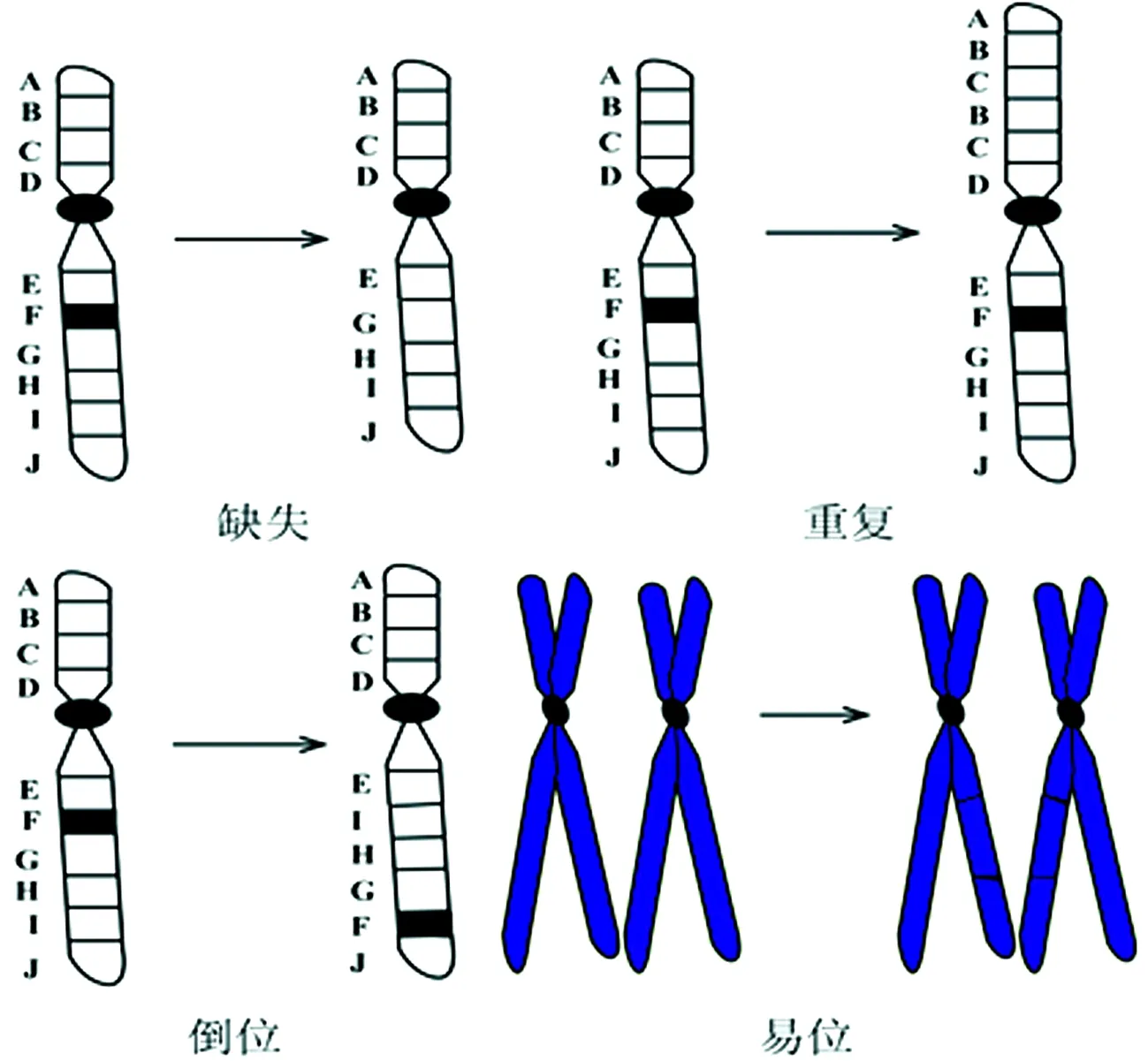
图1 染色体结构异常的常见类型

图2 FISH原理
FISH的检测过程主要包括玻片标本的制备、标本的预处理、探针和标本的变性、原位杂交、杂交后洗涤、复染和荧光显微镜观察信号及分析,一般在24 h内完成检测。FISH探针的类型有很多,在目前的染色体FISH分析中,直接、多色荧光标记的DNA探针逐渐成为临床检验工作者的首选,其可以在同一标本中同时检测出多种染色体异常。相较于传统染色体核型分析,FISH技术有快速、无需组织培养的优势。其可直接采用绒毛、羊水、脐带血的间期细胞,进行染色体非整倍体及结构异常的快速检测,见图3。研究证实将FISH技术应用于快速产前诊断,其准确性高、特异性强,对涉及13、18、21号染色体,以及X和Y染色体数目异常的检出率与“金标准”——染色体核型分析结果一致。临床上对血液肿瘤的FISH检测主要集中在对染色体易位形成的融合基因进行检测,如针对bcr/abl易位的DNA探针、针对t(15∶17)的DNA探针等,有助于血液肿瘤的诊断及预后判断。FISH技术还被广泛应用于乳腺癌、膀胱癌、宫颈癌、肺癌等实体肿瘤的辅助诊断,可检测石蜡切片标本中间期细胞的染色体易位、基因扩增或缺失等改变。

图3 FISH用于13、18、21三体的产前诊断
2.2微阵列比较基因组杂交(Array-CGH)技术 Array-CGH技术将芯片技术和比较基因组杂交(CGH)技术相结合。无需染色体的培养,只需一次杂交即可实现对标本细胞整个基因组的全套染色体或DNA拷贝数量异常的全面检测,同时也可以对异常位点进行初步的染色体定位[3],见图4。检测过程包括微阵列制备、待检DNA和对照DNA探针制备、杂交、数据处理和图像分析。微阵列分为DNA克隆微阵列和cDNA微阵列,采用专门的设备,按照在染色体中的分布或cDNA的基因确定靶点的排列顺序,将DNA克隆片段或cDNA逐个点样在特定材料的芯片上。寡核苷酸-CGH芯片是目前最新、分辨率最高的CGH芯片,无需点样,可直接在芯片上合成核酸靶序列。
近年来,许多产前诊断实验室利用Array-CGH技术对遗传性疾病所伴随的染色体异常进行了全面、系统的分析,获得了与G显带、FISH技术相一致的结果,且具有更好的分辨率和灵敏度,能够大规模、高通量地一次性检测所有染色体位点的异常,并能够自动分析结果,既简便又快速。除此之外,Array-CGH技术还在一些核型分析、FISH技术无法确诊的病例中识别出一系列新的染色体异常位点,提示Array-CGH技术在人类遗传性疾病的研究中起着越来越重要的作用。
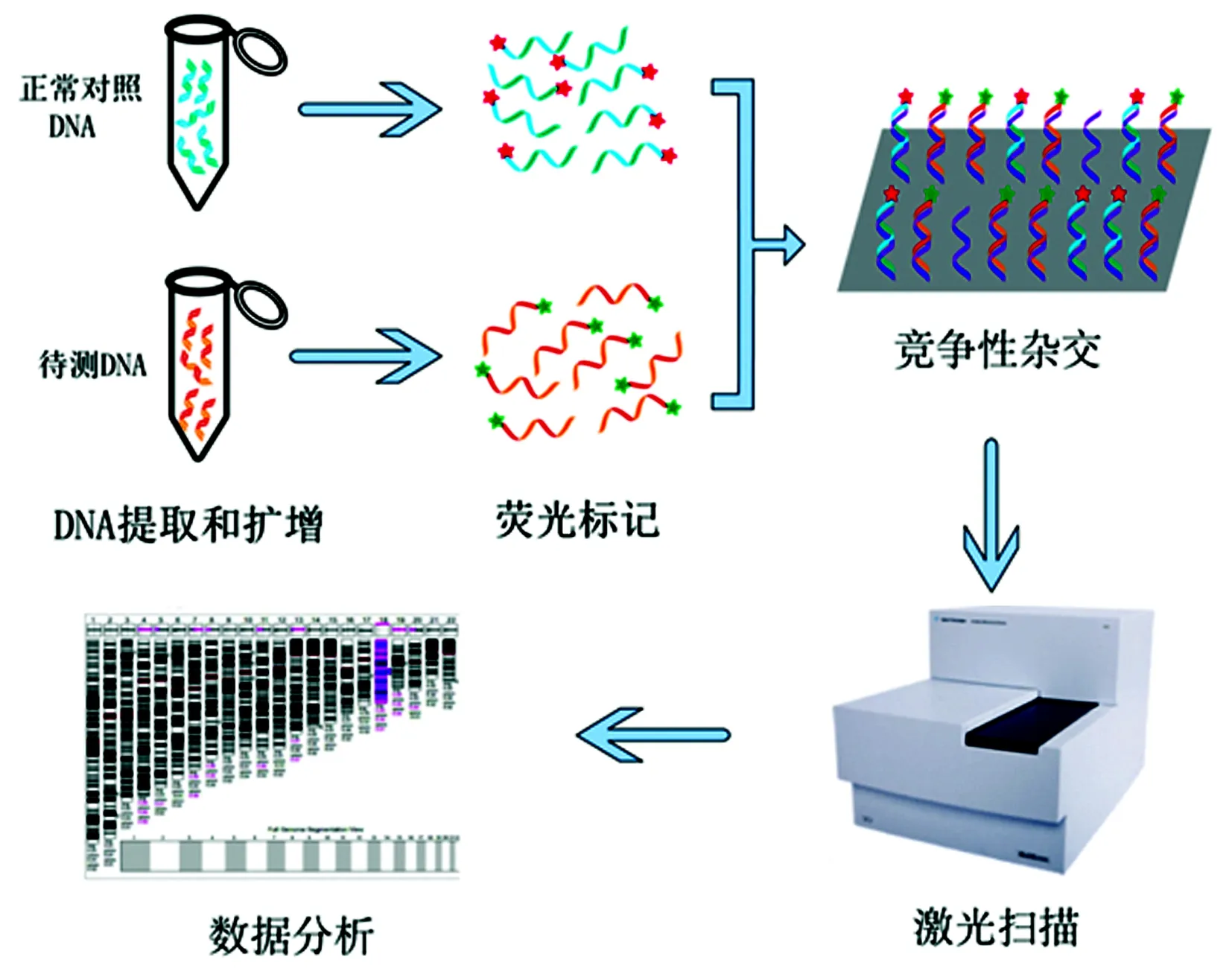
图4 Array-CGH的检测原理
2.3多重连接依赖性探针扩增(MLPA)技术 MLPA技术最早由荷兰学者SCHOUTEN等于2002年提出,近年来发展为一种可针对待检DNA序列进行定性和半定量分析的新技术。MLPA的基本流程包括探针和靶序列DNA杂交,之后采用连接酶连接、PCR扩增,产物通过毛细管电泳分离及数据收集分析。每个MLPA探针包括两个荧光标记的寡核苷酸片段,一个由化学方法合成,一个由M13噬菌体衍生法制备,每个探针都包括一段引物序列和一段特异性序列。如果检测的靶序列出现点突变或发生缺失、扩增突变,那么相应探针的扩增峰便会缺失、降低或增加。因此,根据扩增峰的改变就可判断靶序列是否存在拷贝数的异常或点突变[4]。
MLPA技术目前已经应用于多个领域、多种疾病的检测研究。针对常见的13、18、21号及X/Y染色体检测,首先寻找多个管家基因进行特异性探针设计,然后通过杂交、连接及PCR扩增,将获得的产物进行毛细管电泳分析,最后根据特定基因拷贝数的改变情况确定染色体的数目是否发生异常。MLPA的结果与传统核型分析方法相吻合,且大大缩短了诊断时间。同时,MLPA技术具有高通量、低成本、自动化及结果不受技术人员主观判读干扰等明显优于FISH技术的特点,可作为染色体非整倍体产前诊断的重要方法。对于亚端粒在内的染色体基因重排和染色体微缺失/微重复综合征,针对每一个染色体的亚端粒,MLPA技术都设有特异性探针,以实现经济、高效、快速检测亚端粒的基因重排和微缺失/微重复。
2.4胎儿染色体病无创产前筛查(NIPT)技术 1997年,卢煜明教授在孕妇血浆中发现胎儿游离DNA(cffDNA)片段,从而为NIPT技术提供了理论基础[5]。cffDNA来源于胎盘的滋养层细胞,见图5、6,其在母体血浆总游离DNA中的比例会随妊娠时间的不同而发生变化,可最早于妊娠后第4周被检测出。胎儿游离DNA片段为75~250 bp,在血液中的半衰期仅为16 min,出生2 h后即不能测出。2008年,全基因组大规模平行测序开始应用于检测母体外周血中胎儿染色体非整倍体[6-7],证明了将高通量测序应用于无创产前检测的可行性。此后,高通量测序开始广泛应用于胎儿染色体病的无创产前检测,包括染色体数目异常和染色体结构异常的检测。
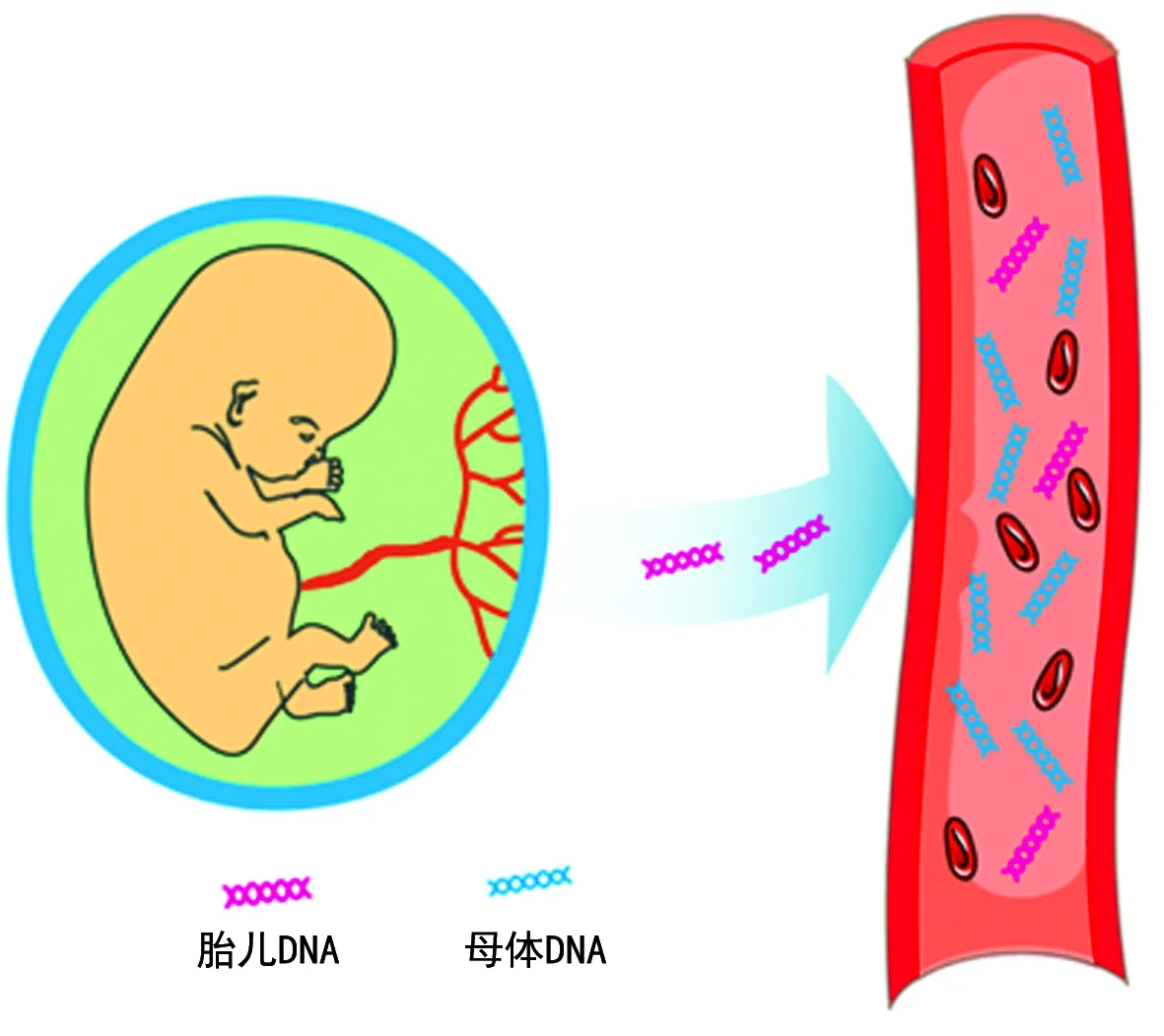
图5 cffDNA进入母体外周血示意图
目前采用高通量测序检测胎儿染色体非整倍体的原理有3种:全基因组大规模平行测序(MPS)[8]、靶向测序[9]及单核苷酸多态性(SNP)测序[10],以上方法检测的均为血浆中母体和胎儿的总游离DNA。其中MPS应用最为广泛。MPS是对基因组所有区域进行检测,将测序结果与参考基因组序列进行生物信息学分析,从而推算胎儿染色体异常风险。相较于全基因组测序,靶向测序是对目标基因或目标区域进行高深度测序,从而提高了罕见变异或疾病相关基因检测的灵敏度和特异度,也降低了数据分析量和检测时间。

图6 正常胎儿和异常胎儿母体总游离DNA中21号染色体DNA片段数量差异
NIPT检测流程包括检测前遗传咨询与知情同意,标本采集、运送、接收、保存,核酸提取,文库构建,上机测序,统计学分析,结果报告及检测后遗传咨询。检测前遗传咨询应保证孕妇是在知晓各种信息、权衡利弊之后,自愿进行检测。同时应告知孕妇NIPT只是一种筛查试验,检测结果阳性不能直接诊断胎儿异常,需要进行有创产前诊断以确认。对于NIPT检测,标本的采集、运送、接收和保存的核心是为避免血液中cffDNA降解以及白细胞裂解释放人基因组DNA,从而导致cffDNA水平降低。目前高通量测序检测系统主要以Illumina、Ion Torrent和Complete Genomics三大检测平台为主。运用检测系统相匹配的软件进行原始数据的质量控制、数据比对、数据比对后处理、变异识别、变异注释及变异过滤。
NIPT的假阳性率为0.1%~0.2%,与生物学因素有关的假阳性原因有染色体拷贝数差异[11]、母体嵌合[12]、限制性胎盘嵌合(CPM)[13]、双胎消失综合征[14]及孕妇患有恶性肿瘤[15]等,其中染色体拷贝数变异是造成假阳性结果的较常见因素,而cffDNA水平过低、嵌合体则有可能导致假阴性结果。
3 常见染色体病的分子诊断
3.1染色体数目异常的分子诊断 临床上80%~90%的常染色体数目异常发生在13、18、21号染色体,其中最典型的有21三体综合征、18三体综合征和13三体综合征。临床上较常见的性染色体数目异常疾病包括先天性卵巢发育不全综合征、先天性曲细精管发育不全综合征、X三体综合征、XYY综合征。
传统的胎儿染色体病筛查主要检测母体血清生化标志物妊娠相关蛋白(PAPP-A)、 β-hCG等指标,结合颈项透明层厚度(NT)超声检测进行筛查。筛查结果风险高的孕妇通过羊膜穿刺或绒毛取样(CVS)等有创检测进行胎儿细胞染色体核型分析。但是,传统的筛查方法不但漏检率高,而且假阳性率高,导致原本不需要接受羊水穿刺的孕妇数量明显增加。羊水穿刺不但有流产的风险,而且给孕妇带来了严重的心理负担。目前基于高通量测序的NIPT技术已广泛应用于胎儿染色体病的筛查。这一技术在高风险人群筛查中的灵敏度、特异度、阳性预测值及阴性预测值远远优于传统的筛查方法,从而减少了很多不必要的介入性检查。因此,对21、18和13三体综合征等非整倍体的产前筛查,NIPT在临床上已逐渐取代传统筛查方式。但是NIPT只是一种筛查方法,而不是诊断方法,检测结果呈阳性时仍需有创产前诊断进行确认。
核型分析是目前产前诊断的“金标准”,可以准确检测出胎儿染色体的结构和数目异常。但是该方法需要进行羊水和绒毛细胞培养,而且制片与核型分析的流程较长,整个产前诊断的过程需要2~4周,并且对操作人员的技术要求高。而应用FISH技术进行染色体数目异常的检测,可以避免以上问题,采用外周血中的淋巴细胞或羊水细胞作为标本,选择相应疾病基因关键区带的特异性序列作为探针,进行FISH杂交检测,可以准确定位染色体异常区域,进一步提高对数目异常染色体病检测的精确性。荧光定量PCR检测选用染色体上的特征性序列作为检测目标,该方法检测染色体数目异常疾病的灵敏度非常高。MLPA检测染色体数目异常作为一种高准确性、低成本和高通量的辅助技术,在染色体数目异常疾病的诊断中具有非常广阔的前景。目前临床应用的MLPA染色体非整倍体检测专用试剂盒可覆盖常见染色体数目非整倍体异常的各种类型。与荧光定量PCR相比,MLPA能够消除由于引物不同造成扩增效率不同而带来的误差,从而极大地提高了结果的准确性。同时,应用已经成熟的商品化试剂盒保证了MLPA结果的稳定性和可靠性,也相应降低了应用的技术难度。
并不是所有的染色体异常都会出现有缺陷的患儿,也有一些核型属于正常变异。所以,有效的遗传咨询不仅能够降低遗传病患儿的出生率,且能促进家庭幸福、社会安定。胎儿染色体数目异常的遗传咨询总体原则如下:(1)对常染色体数目异常者建议终止妊娠;(2)对性染色体数目异常者,医生应告知其风险,并结合夫妇双方的实际情况判断,让夫妇进行知情选择。
3.2染色体结构异常的分子诊断 人类各组染色体中均发现存在不同的结构异常核型,根据严重程度不同会表现为流产、胎儿先天畸形、生长发育迟缓和智力低下等。且部分染色体的结构异常属于携带者异常,可以是父母遗传的,也可以是新突变的。临床常见的染色体结构异常疾病包括5p-综合征、22q11.2微缺失综合征、脆性X染色体综合征。
NIPT不仅可用于21、18和13三体综合征等非整倍体的产前筛查,还可用于胎儿染色体结构异常的产前检测,如性染色体异常、染色体微重复微缺失等。但必须强调的是,只有当临床分析得到的有效性数据充分具备,并充分进行遗传咨询后,在一定临床用途的前提下,对特定的人群(如有家族史的高风险人群)才可以进行临床应用。同时NIPT只是筛查技术,而非诊断技术。
近年来,随着Array-CGH技术分辨率的不断提高,通过对不明原因的智力低下、发育迟缓患儿进行全基因组拷贝数变异的筛查,发现其存在大量以前未发现的拷贝数变异,可根据这些变异鉴别出一系列新的微缺失或微重复综合征。作为分辨率和灵敏度更高的精细分析手段,Array-CGH技术在一些核型分析和FISH技术无法确诊的病例中,以及在出生遗传缺陷的分析和验证中,正发挥着越来越重要的作用。MLPA技术检测人类基因组内发生的拷贝数变异,具有较高的稳定性和可靠性,所以对于检测基因组内拷贝数变异所引发的疾病具有较高的应用潜力。
对于染色体结构异常的携带者,虽无任何临床症状,但在生殖细胞减数分裂过程中可产生遗传物质缺失或重复的不平衡配子,从而导致自然流产、胚胎停育、死胎、死产、新生儿死亡、生育染色体异常儿等一系列结果。因此,对染色体结构异常携带者进行产前诊断能有效预防染色体异常患儿的出生。染色体病的遗传咨询可根据是否存在平衡结构异常(即遗传物质是否缺失或重复)以及是否有遗传性来决定妊娠结局,其总体原则如下:非平衡性结构异常因多伴有严重畸形,故建议终止妊娠;平衡性遗传性结构异常因胎儿的核型遗传自夫妇之一,当夫妇一方有染色体异常时,再次妊娠时流产和生育畸形儿的风险依然较高,所以建议患者继续妊娠。平衡性非遗传性结构异常大多数情况下为表型正常的携带者,但少数情况下有合并先天畸形的可能。因此,医生应告知其可能出现的后果,结合患者的实际情况让其知情选择。染色体病的诊断、产前筛查、产前诊断必须遵循特殊流程并按照遗传性疾病的规律进行遗传咨询。
4 结 论
染色体病是由于先天性的染色体数目异常或结构异常引起机体的形态、结构和功能的改变,在临床上表现为一组特定症状群的综合征。常见的染色体数目异常疾病包括13、18、21三体综合征,先天性卵巢发育不全综合征,先天性曲细精管发育不全综合征,X三体综合征,XYY综合征等。常见染色体结构异常疾病包括脆性X染色体综合征等。基于高通量测序的NIPT已常规用于13、18、21三体综合征的产前筛查,其灵敏度、特异度、阳性预测值及阴性预测值均远远优于传统的筛查方法。但是NIPT作为一种筛查而并非诊断方法,检测结果阳性不能直接诊断胎儿异常,需要进行有创产前诊断加以确认。FISH、荧光定量PCR、MLPA、Array-CGH技术也广泛应用于临床。这些新的分子诊断技术与染色体核型分析互为补充,不断提高染色体病的实验室诊断水平。

