麸皮曲发酵条件的优化
邢晓轲
(许昌职业技术学院 园林与食品工程学院,河南 许昌 461000)
0 引言
曲是粮食或粮食加工副产品时通过培养微生物制成的一种含有大量活菌体及其酶类的发酵剂。酒曲是酿酒生产过程中糖化、发酵、酒化和生香等工艺所用的试剂,其品质对出酒率和酒质有极大影响[1]。如果麸曲在酿造过程中不被分解利用,其残渣会污染环境[2]。为了降低成本,减少环境污染,应用纯种微生物来制取麸皮曲就成为研究热点。
麸皮是小麦面粉厂的主要加工副产品,含有丰富的淀粉酶系、蛋白质、碳水化合物、维生素和矿物质等,每年产量可达2亿 t以上,但大多数都没有进行深加工和利用,麸皮中的各种营养成分有助于微生物及大曲中根霉的生长。因此,以麸皮为主要原料,蒸熟后接入纯种霉菌,可以在人工控温条件下培养麸皮曲且麸皮曲不论生料或熟料的酶活性都远高于其他原料。常采用经蒸煮灭菌后接入曲种熟料的方法制得麸皮曲,该方法具有糖化发酵力强、原料利用率高、生产周期短等特点[3]。与纯种霉菌制成的麸皮曲相比,采用混合麸皮曲酿酒能显著改善酒的品质[4]。为了提高麸皮曲中酶的活力,本文利用响应面法对麸皮曲的配方进行优化,为麸皮曲的进一步开发应用奠定基础。
1 材料与方法
1.1 材料与试剂
麸皮、稻壳:市售。马铃薯葡萄糖培养基、蛋白胨购自杭州天和微生物试剂有限公司。磷酸二氢钾、硫酸镁、葡萄糖、可溶性淀粉、磷酸二氢钠、3,5—二硝基水杨酸均为分析纯,购自天津市大茂化学试剂厂。
1.2 仪器与设备
YP30002电子天平,上海佑科仪器仪表有限公司;T6新悦可见分光光度计,北京普析通用仪器有限责任公司;DK-8D电热恒温水浴锅,常州普天仪器制造有限公司;LDZX-75KBS立式压力蒸汽灭菌器,上海审安医疗器械厂;SPX-25-Z恒温培养箱,上海博泰试验设备有限公司;JBZL-D8恒温振荡培养箱,常州普天仪器制造有限公司;SW-CJ-2FD净化工作台,苏州净化设备工程有限公司。
1.3 葡萄糖标准曲线的绘制
准确称取2 g葡萄糖(干燥至恒重),用蒸馏水溶解后,置于1 000 mL容量瓶中定容。取6支试管分别编号,在每支试管中加入葡萄糖原液和蒸馏水,并在各试管中加入1.5 mL 3,5—二硝基水杨酸溶液摇匀,于沸水浴中加热5 min,常温晾置,然后加入10 mL蒸馏水,在540 nm波长下依次测定吸光度。以葡萄糖的梯度溶液为横坐标,以吸光度为纵坐标,绘制标准曲线[5]。
1.4 麸皮曲的制作
按每100 kg麸皮拌入5~10 kg稻壳和30~32 kg水的比例,拌匀后放入蒸料罐,通汽加热至罐内压力达0.1 MPa时开始计时,持续30 min,停止加热,排汽出料。
1.5 接种
将熟料出罐后摊晾至35~40 ℃,按照每50 kg麸皮拌入20 g菌种的比例进行接种,先接入部分熟料拌匀,然后继续撒熟料并掺拌均匀,最后打碎料块,移入曲池。
1.6 通风培养
曲料入池后,摊平,在4~5 h内保温保湿,不用通风。4~5 h后,曲料温度上升至34~35 ℃,通风降温,间歇开停。10~12 h以后,曲料开始结块,空气通透性差,连续通风,或适当打开冷风门,以保持曲料温度在36~38 ℃,防止曲料失水过快。18~20 h以后,菌丝生长缓慢,此时应注意降低曲料温度,并提高室温,保持曲料温度在35~38 ℃,以利于酶的形成和积累,便于成曲存放。
1.7 成熟摊晾
成熟的麸曲即可用于制醅发酵。如有剩余,可放在洁净阴凉干燥处,摊成5 cm左右的薄层,晾干备用。
曲料入池时,要松散均匀,以利于曲霉孢子发芽和通风。当曲料温度过高时,要及时采取降温措施,防止烧曲。在前期间断通风阶段,要做到兼顾降温保湿;在中期连续通风阶段,要注意控制曲料温度不高于36~38 ℃;在后期,要提高室温排除潮气,使成曲水分保持在30%以下。由于成曲不易储存,所以最好边生产边使用。成曲含水分较多,容易升温,导致酶丧失活力,所以即使是干曲也不宜久存。
1.8 糖化酶活力
糖化酶是一种外切型糖苷酶,是白酒微生物的主要代谢产物之一,其活力是衡量麸曲质量的重要指标[6]。取1 mL质量分数为1.33%的可溶性淀粉溶液,在60 ℃水浴中先预热5 min,加入1 mL酶液(取1 g绝干曲稀释30倍,静置30 min),然后在60 ℃下水浴反应10 min,立即加入1.5 mL 3,5—二硝基水杨酸溶液,沸水水浴5 min,冷却后加10 mL蒸馏水,摇匀后在540 nm波长处测吸光度。干曲的糖化酶活力值的计算公式为:
(1)
式(1)中,C为由葡萄糖标准曲线查得的葡萄糖含量(mg/mL);V为糖化原料总体积(mL);N为酶液稀释倍数;M为干曲质量(g);t为糖化时间(h)。
1.9 响应面法优化麸皮曲配方
1.9.1Plackett-Burman实验设计
种子培养时间、麸皮曲培养时间、培养温度、稻壳量、接种量、加水量等都会对微生物的种群数量和酶的活性有影响。因此,本文采用以上因素2水平部分因子设计方法,即Plackett-Burman实验(PB实验)[7]。
1.9.2最陡爬坡实验
响应面拟合方程只有在考察的紧接领域才能充分接近真实情形,所以要想建立有效的响应面拟合方程,就必须先接近最佳值区域,因此本实验采用最陡爬坡法[7]。
1.9.3响应面分析法
为了进一步研究相关变量之间的交互作用,并最终确定最优点,采用响应面分析法进行直观分析。将没有显著性影响的自变量设为零,观察具有显著性影响因素间的交互作用[8],然后采用中心复合实验,对评价指标和因素间的非线性关系进行评估。
2 结果与分析
2.1 PB实验
研究发现影响麸皮曲酶活力大小的因素有6个,分别为:种子培养时间、麸皮曲培养时间、培养温度、稻壳量、接种量、加水量。设计Plackett-Burman实验,实验次数N=12,对上述6个因素进行观察,每个因素分2个水平,响应值为麸皮曲的酶活力值。
Plackett-Burman实验设计及响应值见表1。利用软件对实验各因素的主效应进行分析,Plackett-Burman实验因素水平及其主效应分析见表2。由Minitab软件对PB实验的设计结果进行主效应分析,Plackett-Burman实验因素水平及其主效应分析结果如图1所示。由此可以看出,麸皮曲培养时间和种子培养时间对麸皮曲的酶活力值的影响最为明显。因此,以这2个主要影响因素为基础进行下一步实验。
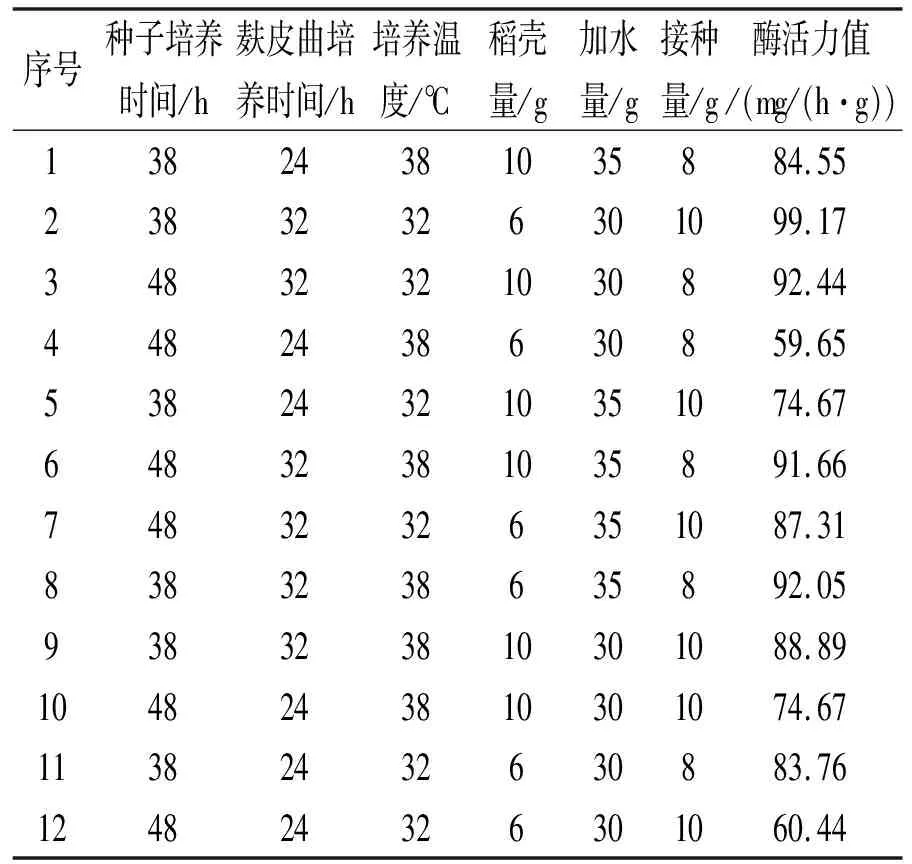
表1 Plackett-Burman实验设计及响应值(N =12)

表2 Plackett-Burman实验因素水平及其主效应分析

图1 Plackett-Burman实验因素水平及其主效应分析结果
2.2 最陡爬坡实验
以Plackett-Burman实验结果为基础进行最陡爬坡路径实验。表2中的麸皮培养时间具有显著的正效应,种子培养时间具有显著的负效应。按照这2个因素的效应比例设定变化方向和步长,其他4个因素分别取各自的低水平进行实验。最陡爬坡实验设计及结果见表3。由表3可以看出,最佳因素条件处于第3组和第4组之间,所以将第3组条件作为后续实验的中心点进行响应面分析。
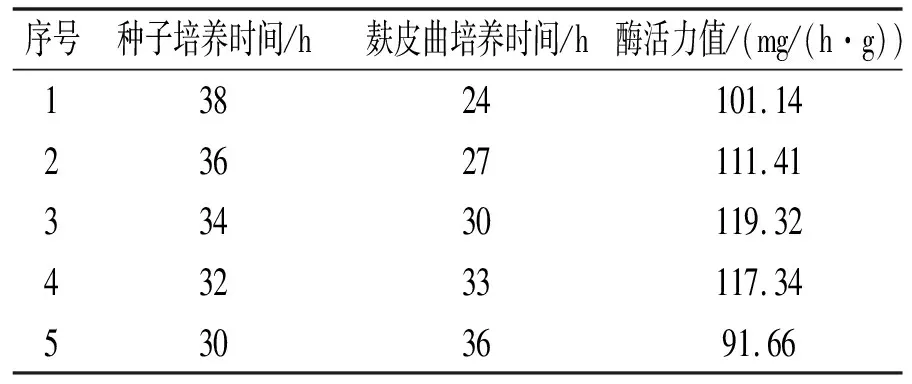
表3 最陡爬坡实验设计及结果
2.3 响应面分析实验设计筛选重要因素的最优浓度水平
通过Plackett-Burman实验确定了影响麸皮曲酶活力值的主要因素,然后利用最陡爬坡实验确定接近响应值区域的影响因素浓度,最后进行响应面分析。重要因素水平及实验设计见表4,其他4个因素分别取各自的低水平进行实验。

表4 重要因素水平及实验设计
通过响应面法绘制分析图,考察所拟合的相应曲面的形状。酶活力值与麸皮曲培养时间、种子培养时间的响应面等值线图如图2所示,相应的响应面立体分析图如图3所示。由图2~3可以看出,响应面存在稳定点,即极大值;经过岭嵴分析获得极大值,即种子培养时间和麸皮曲培养时间的最佳时间分别为33.685 7 h和30.128 6 h,此时麸皮曲的酶活力值达到最大,为127.814 2 mg/(h·g)。
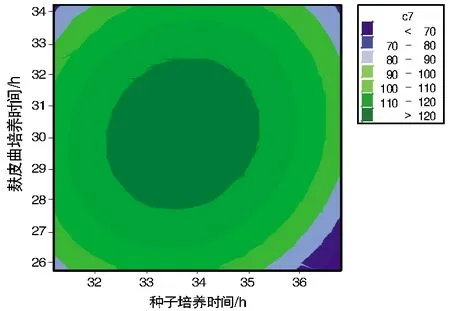
图2 响应面等值线图
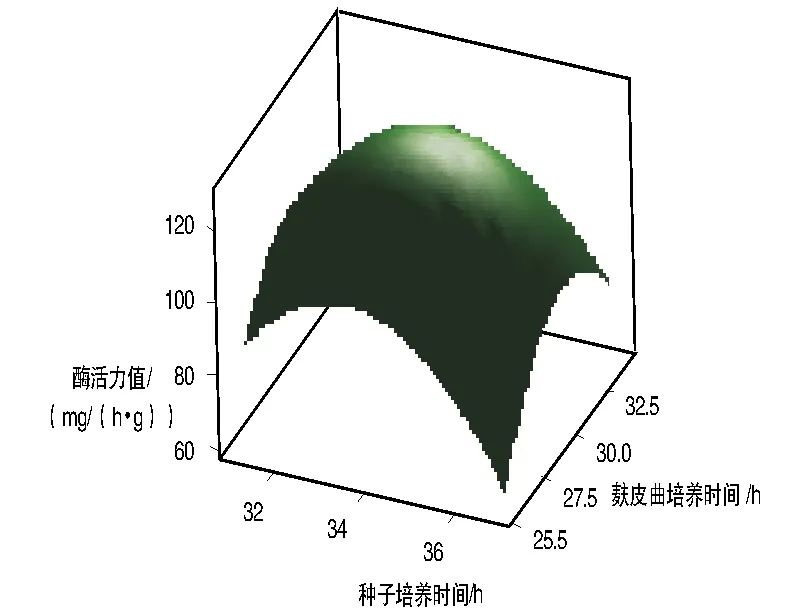
图3 响应面立体分析图
2.4 验证实验
以种子培养时间和麸皮曲培养时间为主要因素,软件分析出响应面存在的稳定点,以得出的麸皮曲的最优配方做验证实验,进行3次平行实验,研究结果发现,麸皮曲酶活力值分别为130.58 mg/(h·g),133.42 mg/(h·g),122.35 mg/(h·g),3次结果的平均值为128.78 mg/(h·g),与预测值127.81 mg/(h·g)非常接近,且与原始麸皮曲酶活力值99.17 mg/(h·g)相比,提高了29.9%。
3 结论
利用响应面分析法对麸皮曲配方进行优化,首先用Plackett-Burman法确定出种子培养时间和麸皮曲培养时间为主要影响因素;然后通过最陡爬坡实验逐步改变二者数值,逼近最佳响应面区域;最后用中心复合实验及Minitab软件分析出主要影响因素的最优数值。麸皮曲配方的最佳培养条件为:种子培养时间为33.685 7 h,麸皮曲培养时间为30.128 6 h。按照此条件来培养麸皮曲,酶活力值达到了128.78 mg/(h·g),与原始麸皮曲配方相比提高了29.9%。这为大规模工业化生产麸皮曲奠定了理论基础。

