FLT3突变型急性髓性白血病的靶向治疗药物吉列替尼
朱文婷,白秋江
(泰康仙林鼓楼医院,江苏 南京 210046)
急性髓性白血病(AML)为恶性髓性造血干细胞疾病,主要特征为髓系细胞的异常增生和分化,这会导致造血功能低下的未成熟造血前体细胞的蓄积,并可能导致严重的感染、贫血或出血症状[1]。FLT3是一种跨膜酪氨酸激酶,可调节白血病母细胞存活和分化,约30%AML患者的基因存在FLT3跨膜区内部串联重复(ITD)或FLT3酪氨酸激酶结构域(TKD)突变[2]。接受传统化疗的FLT3未突变患者3年存活率为45%~55%,而接受同样治疗的携带ITD型突变FLT3患者3年存活率不到20%。之前已有数种FLT3的小分子酪氨酸激酶抑制剂用于治疗携带FLT3突变基因及有复发的或难治性AML患者,无论单独使用还是与去甲基化药物或强化治疗方案联合用药均可改善AML患者的预后[3]。但由于FLT3的激酶位点突变或配体代偿性表达上调等原因,多数FLT3抑制剂单独给药的治疗效果缺乏持续性,多数只能持续3~6个月[4]。
近年来,又涌现出多种FLT3抑制剂[5-7],但还未有被批准用于治疗携有FLT3突变的复发或难治性AML患者的FLT3靶向药物。美国食品药物管理局(FDA)于2018年11月28日批准了吉列替尼(Gilteritinib)用于治疗FLT3突变及复发或难治性AML成人患者的新药上市申请,使该药成为FDA批准用于治疗此类疾病的首个也是唯一FLT3靶向制剂。在此对吉列替尼的作用机制、药物代谢动力学特征及临床试验暴露的不良反应等进行介绍。
1 药物作用机制
FLT3是一种通常表达于造血干细胞或前体细胞的跨膜配体激活的受体酪氨酸激酶,其激活可促进细胞的存活、增殖和分化,ITD和TKD型突变可导致FLT3过度激活,并导致造血干细胞的恶性增殖[8-9]。我国中华医学会血液学分会《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)》和美国国家综合癌症网络都将FLT3-ITD基因突变检查作为AML分型和危险度分组的基础[10-11]。
吉列替尼为格列吡嗪衍生物,临床前试验结果表明,其对ITD和TKD型激活突变FLT3具有良好的选择性抑制作用,并抑制相关突变癌细胞的增殖和存活[12]。细胞试验显示,吉列替尼对野生型FLT3的半数抑制浓度(IC50)为5 nmol/L,对ITD型突变FLT3的IC50仅为0.7~1.8 nmol/L;酶谱试验证明,其对受体酪氨酸激酶Axl也有抑制作用(IC50为41 nmol/L),而Axl可调节FLT3的激活,即吉列替尼可直接或间接抑制突变型FLT3的激活。
2 药物临床疗效
2.1 药物代谢动力学
治疗复发或难治性AML时,患者空腹口服120 mg吉列替尼,达峰时间为4~6 h,高脂饮食可降低药物的吸收,并推迟达峰时间。每日1次给药,在20~450 mg剂量范围内,吉列替尼的体内暴露量(Cmax和AUC24)与剂量成正比,稳态峰值血药浓度为(374±190)ng/mL,维持服药15 d即可达到稳态血药浓度。吉列替尼的蛋白结合率为94%,半衰期为113 h,主要由CYP3A4代谢,约60%吉列替尼以原药或代谢产物随粪便排泄,16%随尿液排泄。
2.2 临床试验及评价
吉列替尼部分临床试验信息见表1。Ⅰ期合并Ⅱ期临床试验结果显示,吉列替尼具有良好的安全性,80 mg/d的剂量服用8 d以上可抑制90%以上的FLT3磷酸化,而其耐受剂量为300 mg/d。对复发或难治性AML患者的FLT3具有良好的持续性抑制作用,且之前使用其他酪氨酸激酶抑制剂的患者约37%表现出总响应,提示不同的FLT3抑制剂可克服其他FLT3抑制剂造成的药物耐受现象[7,13]。
虽然药物的Ⅲ期临床试验还未结束,但根据FDA批准文件中提前发布的结果显示,共138例携带FLT3的ITD、D835或I836突变的复发型AML患者接受120 mg/d的吉列替尼口服治疗,其中29例受试者平均在服药4.6月后完全缓解或有部分血液学恢复的完全缓解,约占所有受试者的21%。
3 药物安全性
3.1 药物不良反应
Ⅲ期临床试验表明,主要药物不良反应有发热性中性粒细胞减少症、肌痛/关节痛、转氨酶升高、疲劳/不适、发热、非感染性腹泻、呼吸困难、水肿、皮疹、肺炎、恶心、口炎、咳嗽、头痛、低血压、头晕和呕吐等。罕见的不良反应包括房室间隔,吉列替尼可延长心室复极化(QT间隔),低钾血症或低镁血症可能增加QT延长风险,吉列替尼给药前和期间应纠正低钾血症或低镁血症;胎儿毒性,动物试验显示,吉列替尼可导致胎儿死亡及畸形;脑病综合征,吉列替尼罕见导致可逆性脑病综合征(PRES)。
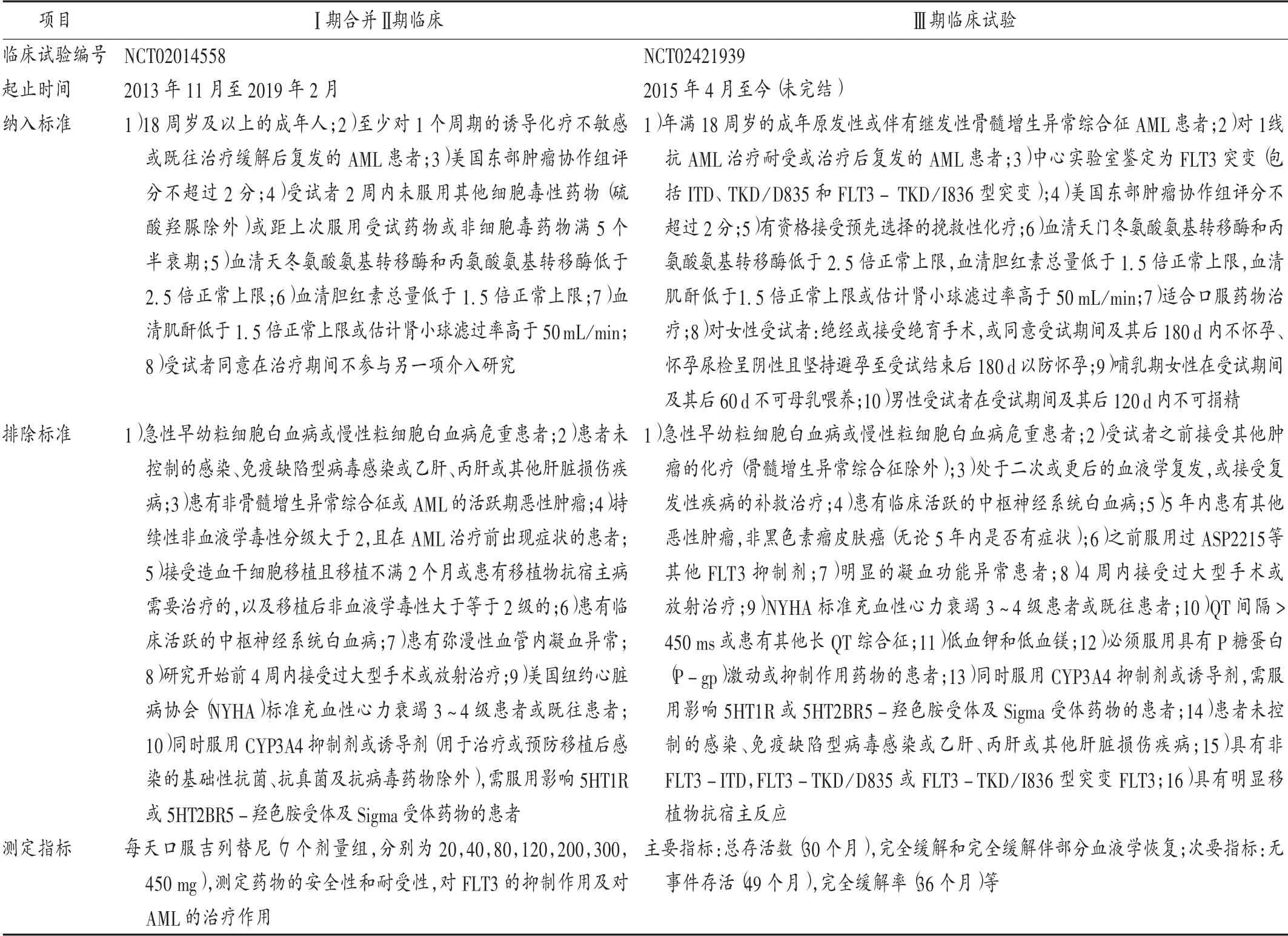
表1 吉列替尼部分临床试验基本信息
3.2 药物相互作用
其他药物对吉列替尼的影响:骨髓基质细胞的CYP3A4酶表达增加是导致FLT3抑制剂耐受的重要原因,而P糖蛋白也可影响药物进入细胞[14-15],因此应避免吉列替尼与其他可影响CYP3A4或P-qp的药物联用。如必须联用,应密切监测血药浓度及药物不良反应。
对其他药物的影响:吉列替尼的同时使用可能减低如氟西汀和舍曲林等靶向5HT2B受体或Sigma非特异性受体的药物治疗作用,非必要情况下应避免这些药物与吉列替尼同时使用。
3.3 特殊人群用药
妊娠:药物对女性妊娠的影响未知,但动物试验结果显示,给予至妊娠器官形成期大鼠0.4倍治疗剂量的吉列替尼会导致胚胎-胎儿致死,抑制胎儿生长,有致畸胎性等。因此不推荐妊娠期妇女服用该药物,在药物临床试验的排除标准中也可见端倪(见表1)。
哺乳期人群:吉列替尼可进入乳汁,因此哺乳期女性在受试期间及其后60 d不可进行母乳喂养。
生育期人群:生育期女性/男性治疗期间和吉列替尼末次服药后分别至少6个月和4个月进行有效避孕。儿童:尚未确定在儿童患者中的安全性和有效性。老人:65岁或以上年龄患者和较年轻患者间未观察到在有效性或安全性的总体差异。
4 可能导致药物耐受的机制及解决方案
虽然目前还没有关于吉列替尼产生耐药性的报道,但其他FLT3抑制剂产生耐药性的机制值得借鉴和补充。肿瘤细胞对FLT3抑制剂产生耐药性的机制包括:FLT3或其他调控FLT3活性的蛋白基因二次突变,且不同抑制剂可能导致不同且不重叠的FLT3二次突变;FLT3配体的大量表达,对抑制剂产生竞争性拮抗作用;FLT3通路下游的MAPK,PI3K,STAT5通过其他途径的过度激活,并抑制细胞凋亡;CYP3A4酶活增加,加速药物降解,使得药物实际血药浓度下降等[16-18]。
联合用药是降低肿瘤耐药性并提升抗肿瘤效果的重要手段,吉列替尼已开展5项联合用药临床试验(项目编号分别为NCT03730012,NCT03625505,NCT02752035,NCT02495233,NCT02236013),其 中NCT03625505临床试验将BCL-2抑制剂Venetoclax与吉列替尼联用。BCL-2是一种重要的凋亡抑制分子,有望拮抗PI3K和STAT5过度激活引起的凋亡抑制。FLT3抑制剂可增加FLT3在细胞膜的分布,并有望增加以FLT3为靶点的免疫疗法的效果,目前已有以FLT3为靶点的CAR-T治疗进入研究阶段,两者联用也有可能成为新选择[19-20]。NCT03730012临床试验直接将PD-1抗体Atezolizumab与吉列替尼联用,通过增加淋巴细胞的细胞毒性直接或间接增强吉列替尼的疗效。
5 结语
2017年,Rydapt获批用于化学治疗联用于FLT3突变的AML患者治疗,属于第1代FLT3抑制剂,吉列替尼的获批使其成为第2代FLT3抑制剂。吉列替尼可单独给药或联合强化化学治疗,并对之前使用过其他酪氨酸激酶抑制剂的患者也可表现出一定疗效[7],有可能将其用于对其他酪氨酸激酶抑制剂耐受患者的替代治疗。随着新的FLT3抑制剂的不断涌现[6,21-22],进一步证明了FLT3选择性抑制剂可能成为治疗复发或难治性AML的良好选择。

