沉默LIMK1抑制人胃癌MGC803细胞迁移与侵袭
(1.湖南省肿瘤细胞与分子病理学重点实验室,湖南省胃癌研究中心,南华大学肿瘤研究所,湖南 衡阳 421001;2.株洲市中心医院肿瘤科,湖南 株洲 412007)
胃癌是最常见的恶性肿瘤之一,据2018年报告,全球每年新发病例约100万,死亡78.3万,发生率与死亡率分别居于第五位与第三位[1]。我国是胃癌高发地区,发生率与死亡率仅次于肺癌而位于第二。由于胃癌患者就诊时大多已经发生侵袭与转移,治疗效果较差[2-3]。从而,探讨胃癌侵袭转移机制与治疗靶点是非常关键的问题。
LIM激酶(LIM kinase, LIMK)属于丝氨酸/苏氨酸蛋白激酶,LIMK家族有两个成员,即LIMK1和LIMK2。LIMK通过磷酸化和失活肌动蛋白解聚因子调节肌动蛋白聚合,调控肿瘤细胞增殖、细胞周期、侵袭转移等功能[4]。研究显示,LIMK1在胃癌中高表达与肿瘤大小、淋巴结转移及TNM分期有关。沉默LIMK1可抑制细胞增殖与迁移侵袭,并且,体内抑制肿瘤生长和腹膜转移,表明lIMK1可用作胃癌治疗的潜在靶点[5]。课题组人员前期工作证明,LIMK1在结肠癌中高表达,与肿瘤分化程度、肿瘤大小、淋巴结转移、TNM分期及不良预后密切相关[6]。本研究采用miR干扰技术沉默LIMK1基因后,探讨其对人胃癌MGC803细胞增殖、细胞周期与迁移侵袭的影响。
1 材料与方法
1.1 细胞培养
人胃癌MGC803细胞由本实验室保存,于含10%小牛血清的RPMI1640培养基中,37 ℃,5%CO2、饱和湿度的培养箱内传代培养。
1.2 主要试剂
LIMK1(ab39641)与β-actin(ab3280)抗体(Abcam公司)。Total RNA Kit(Omega公司),RT reagent kit(TaKaRa公司),PCR试剂盒(Promega公司)。BCA蛋白定量试剂盒(美国Pierce公司),ECL发光检测试剂盒(北京中杉金桥生物技术有限公司),pcDNATM6.2-GW/EmGFpmiR干扰质粒、LipofectamineTM2000、杀稻瘟菌素(invitrogen公司)。质粒抽提试剂盒与壮观霉素(Sigma公司)。Transwell小室(Corning公司),Matrigel(BD公司)。小牛血清(杭州四季青生物工程公司),RPMI-1640培养基(Gibco公司)。
1.3 构建稳定LIMK1基因沉默的MGC803细胞
1.3.1 构建miR-LIMK1干扰质粒 根据LIMK1(Genebank accession number:NM_002314.2)基因序列设计并合成4对miRNA oligomers,构建pcDNATM6.2-GW/EmGFpmiR-LIMK1干扰质粒,miRNA oligomers设计、干扰质粒构建和测序由invitrogen公司完成。见表1。

表1 miRNA oligomers序列
1.3.2 抽提重组质粒 在LB固体培养基上(加壮观霉素50 μg/mL)划菌,用10 μm Tip头挑选单个散在的菌落,洗脱于4~5 mL的含壮观霉素50 μg/mL的LB液体培养基,37 ℃恒温、转速为220-235,转摇菌14-16 h。根据质粒抽提试剂盒步骤提取质粒。
1.3.3 LIMK1-miRNA/MGC803转染株的筛选 人胃癌MGC803细胞1×105/mL接种于24孔培养板,37 ℃、5%CO2培养24 h。将0.8 μg的质粒(4个miR-LIMK1干扰质粒与阴性干扰质粒)加入无血清opti-MEM培养基中,最终体积为50 μm(A液)。取2 μm LipofectamineTM2 000加入48 μm无血清opti-MEM的EP管内,轻轻摇匀,放置3~5 min(B液)。将A液与B液混匀,得混合液C,放置20 min。培养箱中取出24孔培养板,弃去培养液,PBS洗2-3次,opti-MEM培养液洗2-3次,加入400 μm的无血清opti-MEM培养液。将100 μm混合液C加到24孔培养板孔内,轻摇培养板使之混匀。将培养板放回37 ℃、5%CO2培养箱培养4~6 h,将无血清opti-MEM培养液更换为10%胎牛opti-MEM培养液。48 h后将24孔培养板孔内细胞以1∶10比例传代。24 h后换成2.5 μm杀稻瘟菌素+500 μm培养基/每孔,筛选阳性克隆,每3天换液一次,2周后可见阳性克隆,倒置荧光显微镜下观察,可见细胞发绿色荧光。10 μm Tip头挑取绿色荧光的阳性单克隆细胞至24孔板,待形成阳性单克隆细胞后再挑取至24孔板,反复3-4次,最后移入培养瓶培养并冻存。
1.4 RT-PCR
RNA试剂盒提取细胞总RNA,AMV酶作用下逆转录合成cDNA。见表2。PCR反应条件:94 ℃,5 min;94 ℃,40 s,Tm,45 s,72 ℃ 1 min 20 s,28个循环;72 ℃ 10 min。5 μL的PCR产物经1%的琼脂糖电泳,溴化乙锭染色,IS1000图像分析软件读取条带灰度值,相对值以LIMK1与β-actin灰度值之比表示。
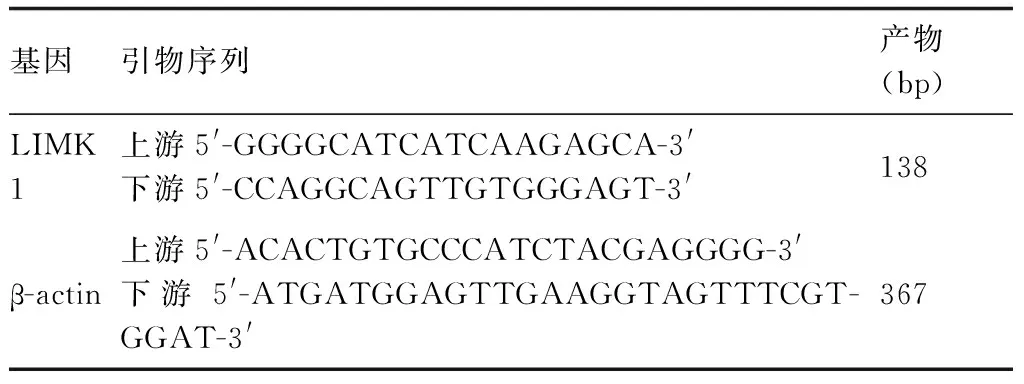
表2 PCR引物序列
1.5 Western Blot
收集细胞,提取细胞总蛋白,BCA法测定蛋白浓度,每组取等量样本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭1 h,加一抗,4 ℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,采用ECL发光法,最后X片曝光、显影、定影。
1.6 MTT检测细胞增殖
取对数生长期各组MGC803细胞,接种到96孔板,每组设置6个复孔,细胞贴壁4~6 h后进行常规培养;更换细胞培养基为150 μL RPMI-1640完全细胞培养基,加20 μL 5 mg/mL MTT溶液,培养4 h;终止培养,吸弃孔内培养上清液,加150 μL DMSO溶液,摇床上常温平摇10~15 min,使结晶物充分溶解,酶联免疫检测仪测量各孔在OD570nm处的吸光值;最后计算细胞增殖抑制率,细胞增殖抑制率=(1-实验组OD570值/对照组OD570)×100%。
1.7 流式细胞术检测
取对数生长期各组MGC803细胞,1 000 r/min离心5 min,收集细胞,预冷PBS吹打重悬,离心沉淀,重复一次。4 ℃预冷的75%乙醇固定细胞,冰盒送检。样本上机前离心洗涤,弃上清,加1 g/L碘化丙啶50 μL,振荡混匀,避光置冰箱30 min,上机检测时300目尼龙网滤过,计数10 000个细胞,进行细胞周期分析。
1.8 划痕实验
调整细胞浓度为1×106/mL,吸1 mL细胞悬液接种于6孔板,每组3个平行样本。RPMI 1640培养液37 ℃、5%CO2培养,直至形成细胞单层。用10 μL Eppendorf Tip在细胞板上划痕,无血清培养液洗3次,加新鲜的无血清培养基。显微镜下测量划痕区相对距离,实验重复3次。
1.9 侵袭实验
将基质胶稀释液铺置在Transwell小室中,100 μL细胞接种至小室上腔,取500 μL含10%胎牛血清培养液添加至下腔,37 ℃、5%CO2培养36 h后取出,擦弃小室上层细胞并用4%多聚甲醛固定10 min,0.1%结晶祡染色,PBS液洗涤,晾干。显微镜下随机选取4个高倍视野进行细胞计数,取平均值。每组细胞设3个复孔。
1.10 统计学处理
采用统计学软件SPSS13.0对数据进行统计分析:实验重复3次,所得数据采用均数±标准差,组间区别用t检验分析,P<0.05为差异有统计学意义。
2 结 果
2.1 LIMK1 pcDNATM 6.2-GW/EmGFP-miR质粒构建、抽提与筛选转染
构建人LIMK1-microRNA重组质粒pcDNATM6.2-GW/EmGFPmiR,测序结果与设计序列完全相符(图1A)。negative-miR与LIMK1-miR 1-4质粒载体的甘油菌液中提取质粒,4 μL 1%琼脂糖凝胶电泳(图1B)。将重组质粒转染MGC803细胞24 h后,倒置荧光显微镜可见绿色荧光。加杀稻瘟菌素筛选2周后,可见阳性克隆细胞(图1C),挑选克隆细胞加低剂量杀稻瘟菌素继续培养(图1D)。
2.2 RT-PCR与Western blot检测转染后LIMK1 mRNA与蛋白的变化
图2显示,转染LIMK1-miR后,LIMK1 mRNA表达明显下降,并以LIMK1-miR 4干扰效率最好(P<0.05)。LIMK1-miR1-4细胞较未转染组LIMK1表达分别下降30%、28%、72%、75%,LIMK1-miR4组最明显(P<0.05),阴性转染组与未转染组间差异无显著性(P>0.05)。根据RT-PCR与Western blot结果,LIMK1-miR4细胞作为后续实验。
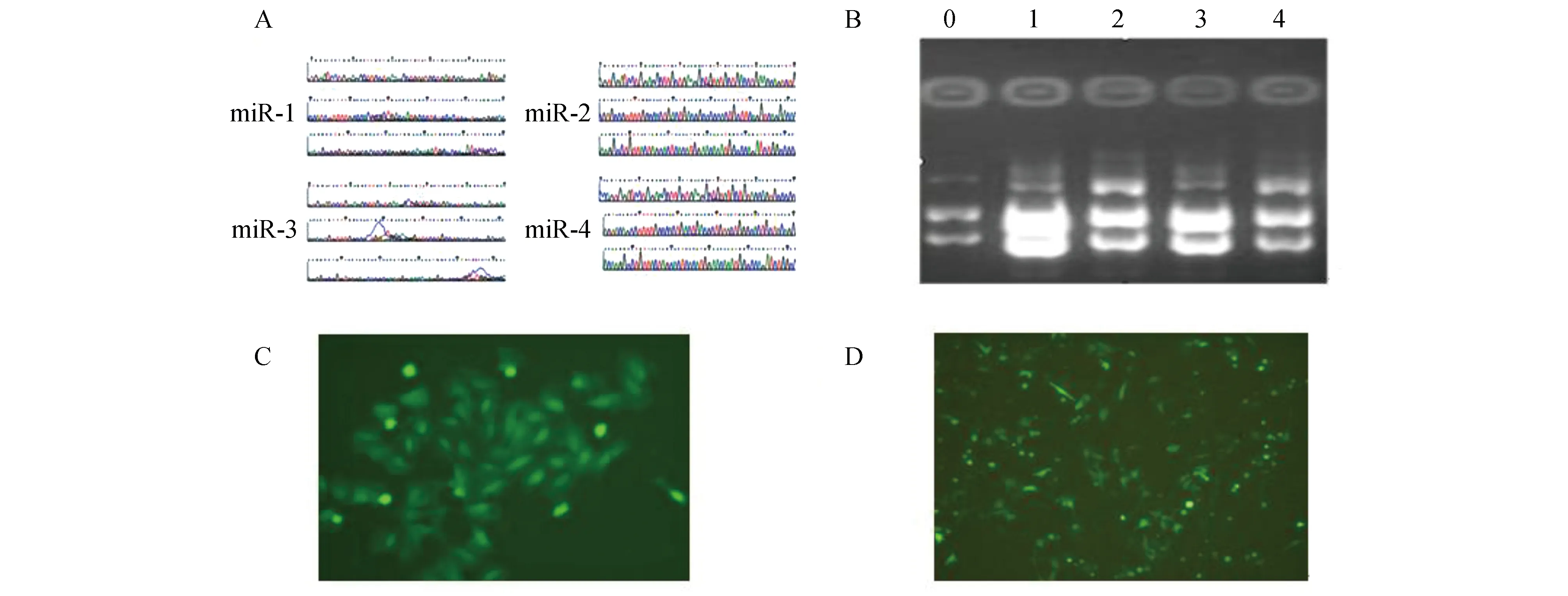
图1 稳定低表达LIMK1基因细胞系的建立A:重组质粒测序图; B:干扰质粒的抽提.0:negative-miR;1:LIMK1-miR 4; 2:LIMK1-miR 3; 3:LIMK1-miR 2;4:LIMK1-miR 1; C:荧光显微镜检测杀稻瘟菌素筛选后的阳性细胞克隆; D:荧光显微镜检测阳性细胞克隆扩增培养
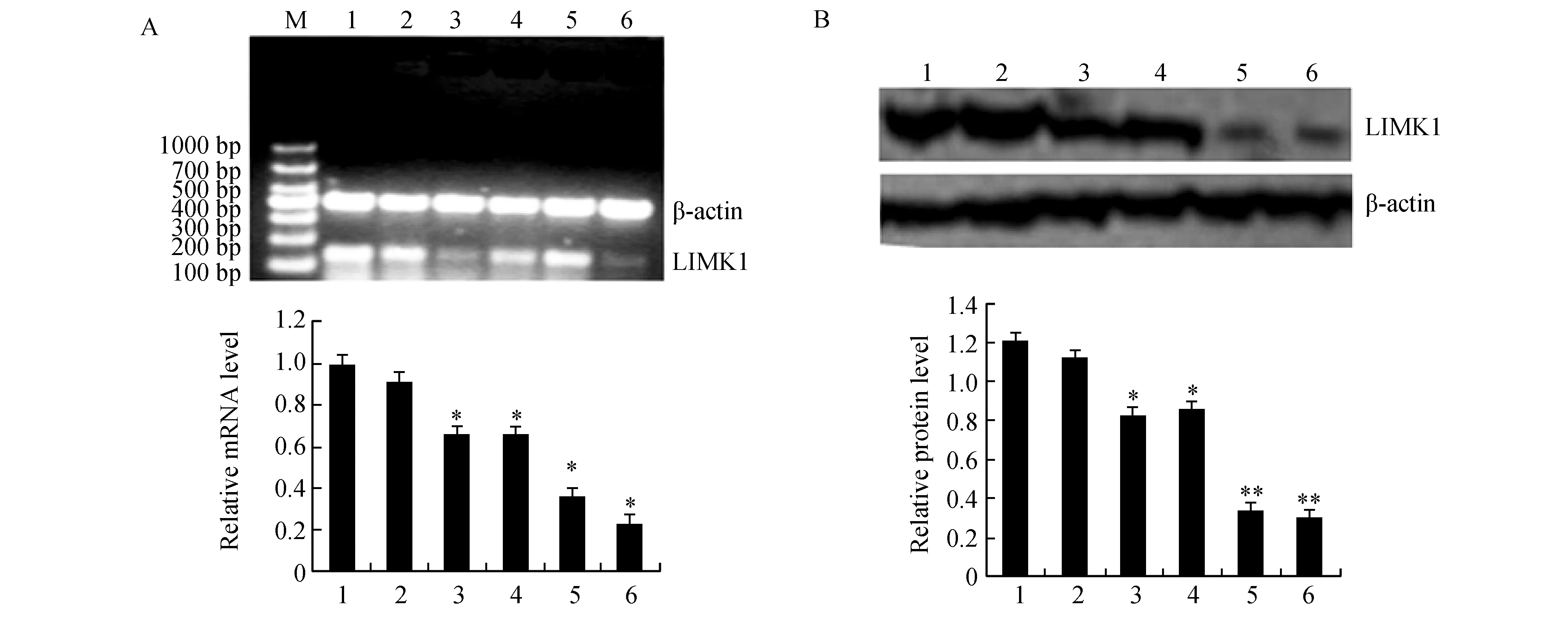
图2 RT-PCR与Western blot检测各组LIMK1 mRNA与蛋白的表达情况A:RT-PCR; B: Western blot. M: mark; 1:MGC803; 2: negative-miR; 3: LIMK1-miR1; 4: LIMK1-miR2; 5: LIMK1-miR3; 6: LIMK1-miR4与MGC803和Vector比较,*P<0.05;与LIMK1-miR1和LIMK1-miR2比较,**P<0.05
2.3 沉默LIMK1对MGC803细胞增殖及周期的影响
表3所示,LIMK1沉默组细胞在24、48、72、96 h分别较对照组与空载体组的抑制率为61.0%、36.9%、12.1%、1.6%和54.7%、46.2%、13.5%、1.5%(P<0.05)。表明沉默LIMK1可呈时间依赖性抑制MGC803细胞增殖。图3与表4所示,LIMK1沉默组G2/M期17.96%明显高于MGC803组11.45%和空载体组11.68%(P<0.05)。表明沉默LIMK1可阻滞MGC803细胞G2/M期的作用。

表3 沉默LIMK1对MGC803细胞增殖活性的影响 (OD570值)
与MGC803和Vector比较,aP<0.05

图3 沉默LIMK1对MGC803细胞周期的影响A:MGC803; B:Vector; C:miR-LIMK1

表4 沉默LIMK1对MGC803细胞周期的影响
与MGC803和Vector比较,aP<0.05
2.4 沉默LIMK1对MGC803细胞迁移的影响
图4显示,0 h时,各组划痕距离大体相同。24h后,未干扰组与阴性干扰组明显变窄(P<0.05)。干扰组划痕距离较未干扰组与阴性干扰组明显增宽(P<0.05)。表明沉默LIMK1可抑制MGC803细胞迁移。
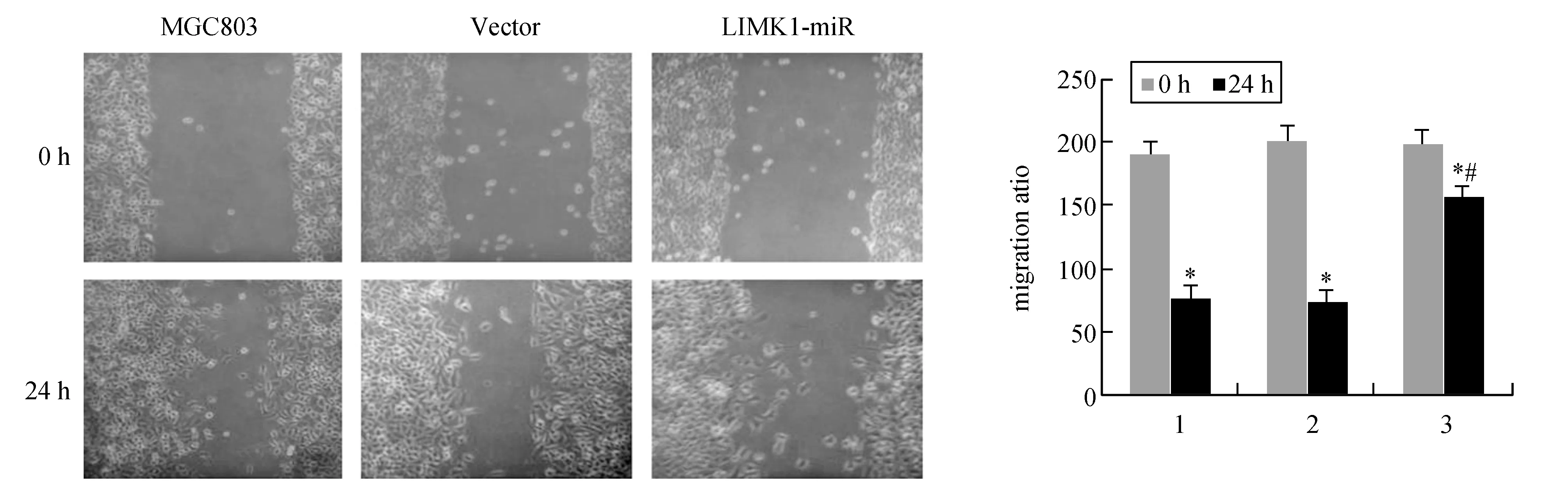
图4 沉默LIMK1对MGC803细胞迁移的影响(10×)1:MGC803;2:Vector;3:LIMK1-miR.与0 h比较,*P<0.05;与MGC803和Vector 24 h比较,#P<0.05

图5 沉默LIMK1对MGC803细胞侵袭的影响(20×)1:MGC803;2:Vector;3:LIMK1-miR与MGC803和Vector比较,*P<0.05
2.5 沉默LIMK1对MGC803细胞侵袭的影响
图5显示,24 h后,沉默组穿膜细胞较未干扰组与阴性干扰组明显减少(P<0.05)。表明沉默LIMK1可抑制MGC803细胞侵袭。
3 讨 论
大量研究表明,LIMK1在结肠癌、胃癌、乳腺癌、前列腺癌、肺癌、口腔鳞状细胞癌与食管癌等肿瘤中高表达与迁移侵袭有关[4-11]。有人发现,LIMK1和LIMK2表达不平衡在结直肠癌(CRC)进展中起重要作用,LIMK2随着肿瘤从癌前病变向晚期CRC的进展而逐渐下调,阻滞G1-S细胞周期抑制细胞增殖,并限制EMT抑制细胞转移的能力。相反,LIMK2表达减少可增强核β-catenin积累和激活Wnt信号通路,促进EMT。而LIMK1自始至终在CRC进展中高表达,担任LIMK2通过β-catenin核易位的竞争性抑制剂。因此,LIMK1和LIMK2两者的联合作用为CRC进展机制与抗癌治疗的研究提供了新的认识[4]。LIMK1在细胞浆和核高表达与肿瘤转移和患者预后不良密切相关。增强LIMK1在细胞质和细胞核表达可促进EMT与激活PI3K/Akt信号通路,显著增加细胞的增殖和迁移,促进移植瘤的生长和转移,而沉默LIMK1效果相反。表明LIMK1在亚细胞水平上促进CRC的进展起着关键作用[7]。在PC-3和DU145人前列腺癌细胞中,ROCK通过靶向LIMK1和MMP-2促进细胞增殖和迁移,而敲除ROCK可下调p-LIMK1和MMP-2,减少细胞迁移和侵袭[9]。
近年来,发现一些miRNAs的靶基因是LIMK1,在抑制肿瘤侵袭与转移中起着重要作用。如LIMK1是miR-128-3p的直接靶基因,miR-128-3p可通过下调LIMK1/Cofilin1通路抑制乳腺癌的进展[8]。LIMK1是miR-138的直接靶点。miR-138可通过靶向LIMK1/cofilin信号通路抑制NSCLC细胞的迁移和侵袭。因此,miR-138/LIMK1/cofilin可能是治疗NSCLC的潜在治疗靶点[10]。在口腔鳞状细胞癌(OSCC)组织和细胞系中,miR-106a水平显著下降,LIMK1表达显著增加。miR-106a可直接靶向LIMK1抑制OSCC细胞的增殖和EMT[11]。基于微阵列的基因表达谱显示,miR-384和Bax在食管鳞状细胞癌(ESCC)中表达较低,而LIMK1、cofilin和Bcl-2在ESCC中表达较高。miR-384靶向并下调LIMK1阻断LIMK1/cofilin通路,抑制细胞增殖、侵袭、细胞周期、LNM和肿瘤生长,促进ESCC细胞凋亡,最终抑制ESCC的发生发展[12]。
本研究结果显示,采用RNA干扰技术成功构建稳定沉默LIMK1基因的MGC803细胞,并且发现沉默LIMK1可呈时间依赖性抑制MGC803细胞增殖,阻滞G2/M期,抑制细胞迁移与侵袭。
目前,研发抑制LIMK1的有效抑制剂和小分子化合物成为抗肿瘤治疗的新途径。研究发现,小分子化合物LC-0882可通过阻断PAK4/LIMK1/cofilin信号通路显著抑制人胃癌细胞的增殖与侵袭,因此,新型化合物LC-0882可能为胃癌治疗提供一种新的化疗途径[13]。从草药分离出来的曲霉醇(Curcolonol,CCL)可降低LIMK1的活性和cofilin 1磷酸化抑制乳腺癌细胞迁移与F-actin聚合,沉默LIMK1可增强CCL的抑制作用[14]。低纳米级的LIMK1和LIMK2抑制剂通过下调p-cofilin抑制乳腺癌细胞侵袭[15]。氧化苦参碱可下调p-LIMK1和p-Cofilin抑制人胃癌细胞迁移和侵袭[16]。在三种倍半萜烯中,丝兰内酯可显著抑制LIMK1表达、cofilin1磷酸化、F-actin聚合和增殖与迁移[17]。
课题组成员前期工作证明,LIMK1与ADF分别在结肠癌中高表达,与肿瘤分化程度、肿瘤大小、淋巴结转移、TNM分期及不良预后密切相关[6]。此外,发现二烯丙基二硫(Diallyl disulfide,DADS)可通过下调LIMK1-ADF/cofilin通路抑制结肠癌细胞迁移与侵袭和移植瘤生长[6,18]。并且,DADS可通过下调TGFβ1、Rac1、βcatenin、Vimentin和上调E-cadherin抑制胃癌细胞EMT以及移植瘤形成[19]。然而,DADS是否可阻断LIMK1/cofilin通路抑制胃癌细胞迁移侵袭,尚待进一步研究。

