基于GC-MS代谢组学推断不同环境温度下窒息死大鼠的早期死亡时间
(四川大学华西基础医学与法医学院,四川 成都 610041)
死亡时间或死后间隔时间(postmortem interval,PMI)是指机体死后所经历的时间间隔[1]。早期死亡时间推断一直是法医学研究的热点和难点问题,对于认定案件事实、确定犯案时间、排查犯罪嫌疑人以及划定侦查范围有着重要的意义。在法医学实践中,死亡时间推断主要依靠尸体现象,如尸温、尸僵、尸斑、角膜变化、超生反应等,这些方法简单实用,但主观性较强,结果差异大,因此,有学者[2]认为不应将这类推断结果作为法庭证据使用。其他例如物理方法、组织生物化学方法、DNA和RNA降解相关研究及代谢组学方法均已有报道[3-5]。在死亡时间推断的研究中,环境温度是重要的影响因素之一,无论是传统方法还是新技术,均会影响推断结果的准确性[6-7]。YANG等[8]为了考察环境温度的影响,通过测量玻璃体液中钾、钠、氯等离子及腺苷三磷酸(adenosine triphosphate,ATP)、肌酐和尿素氮的浓度,结合环境温度,建立了物质浓度、环境温度、死亡时间三者相互关系的插值函数模型,用于不同环境温度下的死亡时间推断。
代谢组学是一种对体内小分子代谢物(相对分子质量<1 000)进行整体分析的方法,通过系统观察小分子代谢物整体变化情况可以推断死亡时间,而与气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)结合是常用的技术手段。虽然该方法需要对样品进行衍生化处理[9],但由于该方法分辨率高、灵敏度好、选择性好、分析时间短以及拥有诸如美国国家标准与技术研究所(National Institute of Standards and Technology,NIST)数据库等优势,被许多相关的研究所采用。近年来,已有许多利用代谢组学手段推断死亡时间的研究[10-12],其中部分学者[13-15]基于GCMS代谢组学进行大鼠窒息死以及中毒死的死亡时间推断研究,并建立了死亡时间推断的代谢组学模型。然而,这些利用代谢组学推断死亡时间的研究均将外界环境温度设定在一个恒定状态,并未探讨不同环境温度下的死亡时间推断情况。
本研究旨在通过GC-MS代谢组学技术观察不同环境温度(5℃、15℃、25℃、35℃)下机体死后内源性小分子物质的整体变化情况,结合多元统计分析筛选各环境温度下大鼠机体内与死亡时间相关的差异代谢物,并利用这些差异代谢物分别建立不同环境温度条件下大鼠的早期死亡时间(0~24h)推断模型,对大鼠早期死亡时间进行推断。
1 材料与方法
1.1 主要仪器和试剂
7890A-5975C气相色谱-质谱联用仪(美国Agilent公司),Sorvall ST16R高速冷冻离心机(美国Thermo Fisher Scientific公司),DC-24-RT防腐型氮吹仪(上海安谱实验科技股份有限公司),CTHI-250B恒温恒湿箱[施都凯仪器设备(上海)有限公司]。
L-2-氯苯丙氨酸(纯度99%)、甲氧胺盐酸盐(纯度98%)均购自北京百灵威科技有限公司,硬脂酸甲酯(纯度99.5%,美国Sigma-Aldrich公司),N,O-双(三甲基硅基)三氟乙酰胺[N,O-bis(trimethylsilyl)trifluoroacetamide,BSTFA]+1%三甲基氯硅烷(trimethylchlorosilane,TMCS)25 mL(北京索莱宝科技有限公司),乙腈(色谱纯,美国Thermo Fisher Scientific公司),吡啶(分析纯,成都科隆化学品有限公司),正庚烷(分析纯,西陇科学股份有限公司)。
1.2 实验动物
健康雄性SPF级SD大鼠132只,体质量(220±10)g,购自成都达硕实验动物有限公司。本研究获得四川大学动物伦理学委员会批准。
大鼠饲养环境:温度(25±2)℃,相对湿度45%~55%,光照/黑暗 12 h 交替(08:00—20:00/20:00—08:00),自由饮水进食。实验前适应性喂养大鼠1周。
1.2.1 实验组
将96只大鼠随机分为5℃、15℃、25℃、35℃组,每组均设置死后3 h、6 h、12 h、24 h共4个时间点,每个时间点6只,所有大鼠在处死后立即被放入设置好温度的培养箱中。
大鼠的处死方式均为:用尼龙绳打一个可活动的结扣,乙醚麻醉大鼠后,将其颈部置于结扣内,拉动结扣使其慢慢收紧,造成颈部气管受压从而引起窒息死亡。在预先设定的时间点解剖大鼠并采集心血约0.5 mL,迅速将血液样本置于液氮中冷冻后于-80℃储存。
1.2.2 对照组
取6只大鼠,于处死后立即(死后0 h)解剖并取样,作为对照组。其余处理方法同实验组。
1.2.3 预测组
另取30只大鼠作为预测组。首先将其中24只大鼠分为5℃、15℃、25℃、35℃组,每组设置死后9 h、18h两个时间点,每个时间点3只。另外6只大鼠:3只的死后环境温度设置为10℃,于死后12 h取样;3只的死后环境温度设置为20℃,于死后6h取样。其余处理方法同实验组。
1.3 样本前处理
血液样本:在已有文献[16]的基础上进行改进,将血液样本置于4℃冰箱中解冻,解冻后将样本混匀。取100μL血液样本于1.5mL微量离心管中,加入250μg/mL的L-2-氯苯丙氨酸溶液20 μL,混匀。加入-20℃冰乙腈300μL,涡旋混匀15s后于冷冻离心机中在4℃下以16099×g离心10min,取上清液100μL于另一微量离心管中,室温下氮气流挥干。残渣中加入30μL质量浓度为20 mg/mL的甲氧胺吡啶溶液,密闭涡旋15s,置于80℃烘箱中肟化15min,取出后于暗处放置冷却30min。肟化完成后,迅速加入30μL硅烷化试剂(BSTFA+1%TMCS),涡旋15s,于80℃烘箱中衍生化15min,取出后暗处放置30min冷却。衍生化完成后,加入50μL质量浓度为50μg/mL的硬脂酸甲酯庚烷溶液,涡旋15 s。冷冻离心机中4℃下以16 099×g离心10min后取上清液90μL置于装有支架的液相小瓶中进行GC-MS分析。
空白样本:取100 μL冰乙腈于1.5 mL微量离心管中,加入250 μg/mL的L-2-氯苯丙氨酸甲醇溶液20μL,其余操作同血液样本。
质量控制(quality control,QC)样本:取各温度组内的所有血液样本各30μL于2.5mL微量离心管中混匀,分别制得4个温度组的QC样本。取100 μL QC样本于1.5mL微量离心管中,加入250μg/mL的L-2-氯苯丙氨酸溶液20μL,混匀,加入300μL冰乙腈,其余操作同血液样本。
1.4 GC-MS分析
1.4.1 分析条件
色谱条件:DB-5MS毛细管柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气,流速为1.0 mL/min,进样口温度为250℃,辅助加热器温度为230℃,分流比为5∶1;起始温度为60℃,保持1 min,以8℃/min升至300℃,最后保持7min。
质谱条件:四极杆温度设置为150℃,离子源温度设置为230℃,采用电子轰击电离(electron impact ionization,EI)方式,电离能量为 70 eV,溶剂延迟为4.5min,设置为全扫描模式,扫描范围m/z 50~600。
1.4.2 进样条件和方式
检测血液样本前先进行1个硬脂酸甲酯庚烷溶液样本、1个空白样本以及3个QC样本进样,而后每8个血液样本间安插1个QC样本(每个温度组样本分析过程均进了6个QC样本)。硬脂酸甲酯用于观察各色谱峰的位置是否有较大偏移,空白样本用于排除外源性物质的干扰,QC样本用于监测整个分析过程的稳定性,并评估方法的再现性和稳定性[17-18]。
1.5 数据分析
1.5.1 预处理
整理包含样本信息、保留时间和峰面积的数据。(1)所有样本均扣除空白样本中出现的污染物色谱峰。(2)所有剩余的代谢物通过匹配NIST 14谱库,按匹配度>80%的标准进行匹配确定。(3)将所有代谢物峰面积除以L-2-氯苯丙氨酸峰面积进行校正,得到所有代谢物的相对含量。(4)计算各代谢物在QC样本上的相对标准差(relative standard deviation,RSD),当RSD>30%时[19],将该代谢物数据作为异常值剔除。将预处理好的数据制作成Excel数据矩阵。
1.5.2 统计分析
将分组后的数据制成矩阵形式分别导入SIMCAP 14.1软件(瑞典Umetrics公司),对数据进行主成分分析(principal component analysis,PCA)以及正交偏最小二乘(orthogonal partial least square,OPLS)分析,得到的得分图是PCA以及OPLS分析的可视化结果。PCA用于观察分析过程是否稳定,OPLS分析用于差异代谢物的筛选及回归模型的建立,并采用交叉验证和置换验证来验证模型的可靠性。参考以往研究[15],将本实验差异代谢物的筛选标准设定为:OPLS分析中变量投影重要性(variable importance in projection,VIP)>1,SPSS 22.0软件(美国IBM公司)中Kruskal-Wallis检验P<0.001。利用筛选出的差异代谢物建立OPLS回归模型用于死亡时间推断,该回归模型中的自变量(x)为差异代谢物相对含量的整体变化,因变量(y)为死亡时间。
模型对于预测组的预测结果与实际死亡时间之间的比较用均方根误差(root mean square error,RMSE)表示,代表预测值与真实值之间的偏差,可用于比较不同模型之间的预测能力。同时,为了考察环境温度对于推断偏差的影响,采用t检验分别对5℃模型预测其他温度(15℃、25℃、35℃)预测组样本预测结果的偏差与5℃预测组样本预测结果的偏差进行比较,检验水准α=0.05。
将4个温度组共同差异代谢物的信息导入GraphPad Prism 6.0软件(美国GraphPad Software公司)制作其相对含量变化趋势图,用于观察变化趋势。
2 结 果
2.1 代谢产物的鉴定
4个温度组的血液样本经GC-MS分析后得到的全代谢物为:5℃组67种,15℃组68种,25℃组72种,35℃组78种。这些物质包括有机酸、氨基酸、糖类、脂质以及部分其他代谢物等。
2.2 多元统计分析
2.2.1 PCA分析
PCA分析结果如图1所示,各组的QC样本聚集在一起,说明GC-MS本身以及样本在进样前、进样中和进样后都保持相对稳定,通过该仪器获得的数据也稳定可靠。

图1 4个温度组样本的PCA得分图Fig.1 PCA score plots of samples in 4 temperature groups
2.2.2 OPLS分析筛选差异代谢物
OPLS分析筛选出各温度组大鼠血液代谢物中与死亡时间相关的差异代谢物。5℃组共有18种差异代谢物,其中有机酸3种(琥珀酸、牛磺酸、4-羟基丁酸),氨基酸5种(赖氨酸、丙氨酸、5-羟脯氨酸、苯丙氨酸、异亮氨酸),糖类1种(山梨糖醇),脂质2种(磷酸甘油、甘油)以及其他类物质7种(黄嘌呤、丙二醇、丙胺、肌醇、次黄嘌呤、烟酰胺、胸腺嘧啶)。15℃组共有15种差异代谢物,其中有机酸1种(泛酸),氨基酸4种(异亮氨酸、脯氨酸、丙氨酸、缬氨酸),脂质4种(甘油、花生四烯酸、磷酸甘油、花生酸)以及其他类物质6种(黄嘌呤、乙醇胺、丙二醇、腺嘌呤、次黄嘌呤、尿酸)。25℃组共有24种差异代谢物,其中有机酸3种(泛酸、琥珀酸、4-羟基丁酸),氨基酸8种(酪氨酸、天冬酰胺、异亮氨酸、脯氨酸、缬氨酸、甲硫氨酸、氨基丙二酸、丙氨酸),糖类2种(山梨糖醇、甘露糖),脂质4种(二十二碳四烯酸、甘油、磷酸甘油、胆固醇)以及其他类物质7种(黄嘌呤、胸腺嘧啶、乙醇胺、尿嘧啶、尿酸、次黄嘌呤、烟酰胺)。35℃组共有30种差异代谢物,其中有机酸4种(泛酸、琥珀酸、4-羟基丁酸、丙酮酸),氨基酸12种(异亮氨酸、缬氨酸、酪氨酸、脯氨酸、天冬酰胺、谷氨酸、甲硫氨酸、色氨酸、丙氨酸、甘氨酸、苏氨酸、苯丙氨酸),糖类2种(山梨糖、甘露糖),脂质3种(胆固醇、甘油、磷酸甘油)以及其他类物质9种(胸腺嘧啶、尿嘧啶、黄嘌呤、丙二醇、次黄嘌呤、乙醇胺、腺嘌呤、多巴胺、肌醇)。其中,黄嘌呤、次黄嘌呤、甘油、磷酸甘油、丙氨酸以及异亮氨酸为4个温度组所共有的差异代谢物,这6种物质的相对含量随死亡时间的变化趋势见图2。

图2 4个温度组共有差异代谢物随死亡时间的变化Fig.2 Changes of common differential metabolites with postmortem interval in 4 temperature groups
2.2.3 OPLS回归模型及模型验证
利用差异代谢物建立的OPLS得分图见图3。从图中可见,5℃组大鼠死后3h与6h的分离度较差,其余各组各死亡时间点之间基本分离。在各温度组模型中,死后0 h、3 h、6 h、12 h、24 h的样本在图中分布大致为从左到右的顺序,表明分布位置与死亡时间具有一定的相关性。
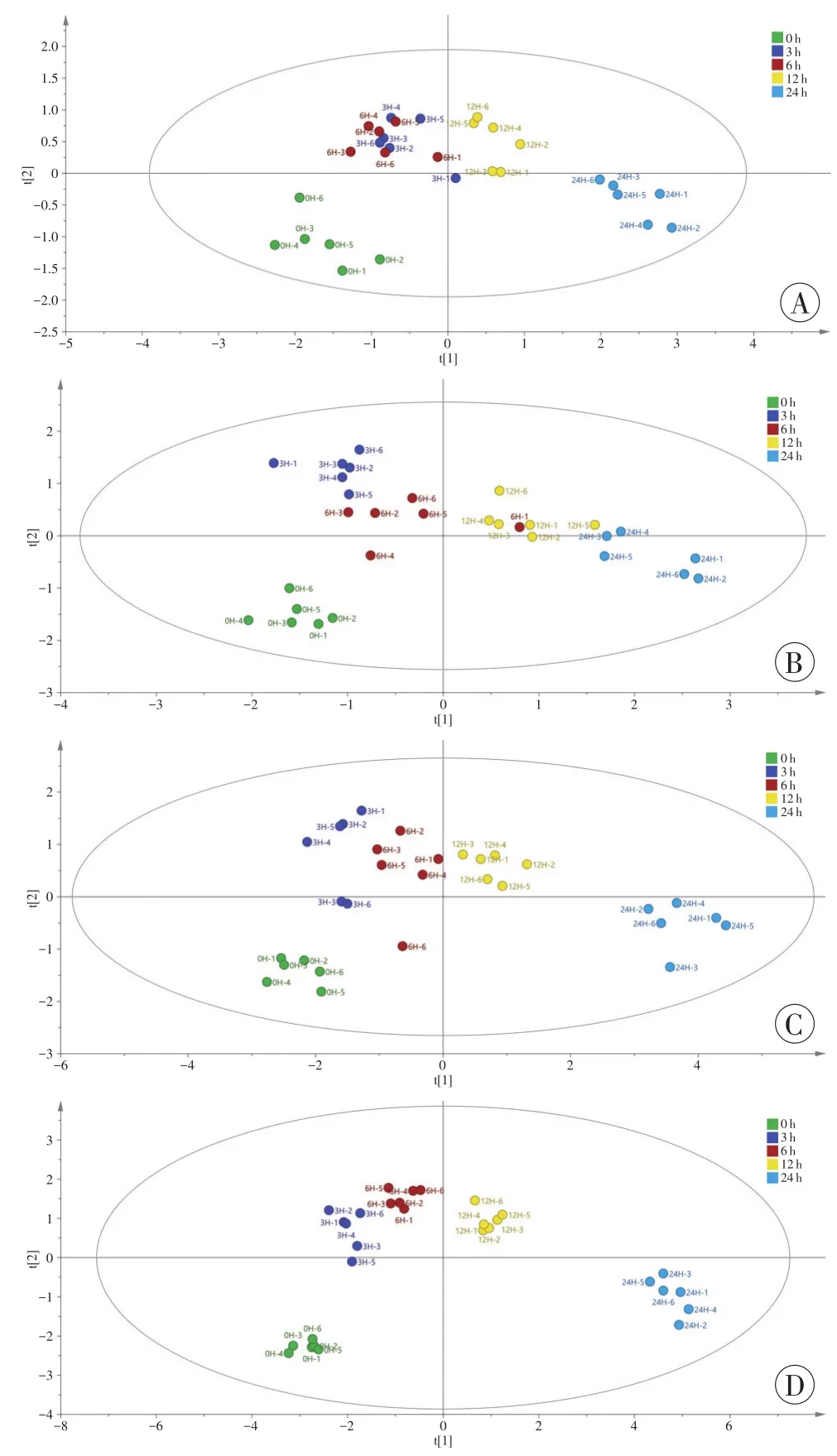
图3 4个温度组样本的OPLS得分图Fig.3 OPLS score plots of samples in 4 temperature groups
利用差异代谢物建立各温度组的OPLS回归模型方程,分别为:5 ℃,y=x+3.893×10-7(R2=0.915 4);15℃,y=x-3.623×10-7(R2=0.8943);25℃,y=x+3.149×10-7(R2=0.974 0);35℃:y=x-5.639×10-7(R2=0.992 1)。可见差异代谢物的整体变化与死亡时间之间具有一定的线性相关。
4个温度组OPLS回归模型的交叉验证以及置换验证结果见表1。结果表明,各温度组模型的拟合程度和预测能力均较好,未出现过拟合的情况。
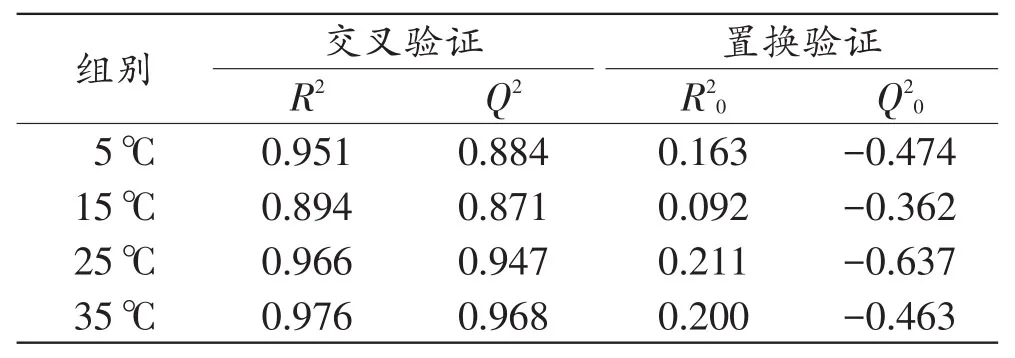
表1 4个温度组OPLS回归模型的交叉验证及置换验证结果Tab.1 Cross validation and permutation validation results of OPLS regression models in 4 temperature groups
2.3 OPLS回归模型用于预测组样本的预测结果
首先将24只预测组大鼠样本数据分别代入所建立的5℃、15℃、25℃、35℃组模型中,然后将环境温度为10℃、20℃的预测组样本分别代入与其温度最接近的模型中进行预测,即分别代入5℃组和15℃组模型进行预测,预测组样本的预测结果见表2。结果显示,5℃模型相对其他组预测偏差较大,其余各组预测结果较为理想。

表2 预测组样本的预测结果Tab.2 Prediction results of samples in prediction groups(n=3,时间/h)
为了探究温度造成的偏差与组内偏差之间的关系,将15℃、25℃、35℃预测组样本均代入5℃模型中进行预测,采用t检验分别对5℃模型预测15℃、25℃、35℃预测组样本预测结果的偏差与5℃预测组样本预测结果的偏差进行比较,结果见表3。结果表明,利用5℃组模型预测其他温度预测组样本的偏差与5℃预测组样本的偏差之间,差异均具有统计学意义(P<0.05)。

表3 5℃模型对不同温度预测组样本预测结果的偏差比较Tab.3 Error comparison of prediction results of different temperature prediction groups using 5℃model(n=3,时间/h)
3 讨 论
本研究基于GC-MS代谢组学技术结合多元统计分析,分别筛选出5℃、15℃、25℃、35℃环境温度下窒息死大鼠心血中与死亡时间相关的差异代谢物,并利用这些差异代谢物建立了4种环境温度下的OPLS回归模型用于推断窒息死大鼠的早期死亡时间,同时设置了预测组样本考察各温度组模型的预测能力。与以往利用GC-MS代谢组学技术推断死亡时间的研究[13-15,20]相比,本研究对环境温度进行了细化和分组,一定程度上提高了代谢组学推断死亡时间的准确性。在模型建立过程中,PCA分析用于观察整个过程是否稳定,结果显示,各组QC样本在PCA得分图中均聚集,说明整个分析过程稳定、可靠[14-15],排除了仪器等不稳定因素对数据造成的干扰。OPLS法由TRYGG等[21]于2002年提出,是一种多因变量对多自变量的回归建模方法,其首要特点是排除了自变量(x)与分类变量(y)无关的数据变异,使分类信息集中在一个或某几个主成分中,从而使模型变得简单、易于解释,使得各组之间的判别效果以及多元统计分析得分图的可视化效果更加明显。OPLS回归模型交叉验证结果中的R2值反映模型的拟合程度,R2值越接近1表明模型拟合性越好;Q2值反映模型的预测能力,Q2值>0.9说明模型具有很好的预测能力,并且R2值与Q2值越接近说明模型建立的效果越好,一般认为R2值与Q2值相差不能超过0.5[22]。模型置换验证结果中的R20值(R2在Y轴上的截距)及Q20值(Q2在Y轴上的截距)用于评估模型是否出现过拟合,一般认为R20<0.4和Q20<0.05,模型拟合较好[23]。本研究所建立的模型验证结果表明所建立的4个温度组模型成功、可靠,拟合程度好,未发生过拟合,说明模型的预测结果客观、可信。从OPLS得分图(图3)可以看出,各温度组各死亡时间点在图中呈现一定的从左至右的分布趋势,这反映了代谢物的整体变化呈现时间相关性。图中还可见5℃模型死后3h、6h两个组区分度较差,这可能与较低环境温度下死后尸体内相关代谢物含量变化缓慢有关,导致5℃模型推断结果准确性的下降。
本研究所设置的4个温度组模型所筛选出的差异代谢物分别为5℃组18种、15℃组15种、25℃组24种、35℃组30种,可以看出差异代谢物种类随温度升高呈增多趋势,而WU等[14]和DAI等[15]所建立的单一温度下的推断模型,差异代谢物种类分别仅为13种和20种。因此,当预测样本所处环境温度高于模型所建立条件时,模型所涵盖的代谢物信息会出现缺失,导致预测结果产生较大误差。本研究4个温度组模型中筛选出6种共有的差异代谢物,分别为黄嘌呤、次黄嘌呤、甘油、磷酸甘油、丙氨酸和异亮氨酸。黄嘌呤和次黄嘌呤是嘌呤分解代谢的中间产物,次黄嘌呤在黄嘌呤氧化酶的作用下分解产生黄嘌呤,而黄嘌呤在黄嘌呤氧化酶的作用下继续分解生成尿酸。本研究中黄嘌呤和次黄嘌呤含量的不断增高可能与机体死后细胞内核苷酸不断分解以及别嘌呤醇和黄嘌呤氧化酶活性不断降低有关,因此无法形成最终的代谢产物尿酸。同时,有研究表明,细胞的死亡是不同步的[24],特别是在低温环境下核苷酸降解较慢[25],因此,其含量变化呈现温度相关性的递进式增加。甘油是机体重要的能源物质,也是合成脂肪的主要来源。机体死后,由于合成作用停止,随着死亡时间的延长,脂肪逐渐分解成甘油和其他游离的脂肪酸。本研究中甘油含量随死亡时间的延长而逐步增加,该结果与既往死后代谢组学研究结果[26]相吻合。磷酸甘油是甘油在甘油激酶的作用下转变而来的,磷酸甘油还可以转化成磷酸二羟丙酮参与糖酵解和糖异生。磷酸甘油也是脂质合成的重要原料,因此,在死后早期其含量因脂质合成停止而相对增高,后期含量减少可能与微生物活动逐渐增强有关[13]。在死后24h内,丙氨酸和异亮氨酸的含量在不同温度下随死亡时间的延长不断增高,这与相关研究[13]报道的结果一致。在较早期的研究中,也有学者[27]发现,脑组织中的丙氨酸和异亮氨酸等氨基酸也都随着死亡时间的延长而增加,本研究进一步证明了这种氨基酸含量的变化规律。丙氨酸及异亮氨酸在大鼠死后的含量增加,可能有以下几个原因[28]:(1)死后组织、蛋白在不同细菌以及细胞自身所含有的各种酶的影响下,不断发生降解而形成丙氨酸、异亮氨酸;(2)由于机体死亡,蛋白质合成停止,导致原本存在于血液中的丙氨酸及异亮氨酸等氨基酸无法形成肽链、蛋白等;(3)随着细胞的裂解,细胞内本身含有的一些氨基酸被释放出来[29],这也包括丙氨酸和异亮氨酸。因此,丙氨酸及异亮氨酸的含量在大鼠死后一段时间内会随着死亡时间的延长而逐渐增加。从图2可以看出,不论是哪种代谢物,环境温度为35℃时,代谢物相对含量变化幅度较其他温度组大(各温度组的温度差均为10℃),可能是由于当环境温度接近体温(或更高)时,微生物的活动更加活跃,有研究[30-31]指出,体内某些氨基酸和糖类等物质含量会受到微生物活动的明显影响。
利用5℃模型对15℃、25℃、35℃预测组样本进行预测并对比后发现,5℃模型对其他温度预测组样本预测结果的偏差与5℃预测组样本预测结果的偏差之间差异具有统计学意义,且预测组环境温度与模型温度相差越大,预测结果偏差也越大。因此,当所需预测的样本所处环境温度与已建立模型的温度条件不完全相同时,可以将其代入与其温度相近的模型中进行预测,如预测样本环境温度为10℃、20℃时,可以尝试将其分别代入与其温度相近的5℃组模型以及15℃组模型中进行预测,以提高推断结果的准确性。
由于本研究还处于动物实验阶段,应用于实际工作尚有一定的难度。在未来,应当收集人血液等组织类样本建立推断模型并进行预测,达到运用于实际的目的。本研究在以往研究的基础上设立了不同的环境温度条件,纳入了新的研究因素,尝试模拟实际情况中不同的环境温度。从研究结果来看,在利用代谢组学技术推断死亡时间的研究中,进行环境温度的考察、细化并建立不同环境温度下的推断模型,有望提高死亡时间推断的准确性。

