ATP1A1基因在肿瘤中的功能及治疗应用研究进展
冯晓异,李蓉涛
1昆明理工大学生命科学与技术学院;2云南中医药大学基础医学院,昆明 650500
2018年世界卫生组织对肿瘤流行病学调查显示,全球已面临老龄化及恶性肿瘤发病率逐年上升的问题[1],人口老龄化指数越高的国家癌症发病率越高,肺癌依旧是发病率(11.6%)和死亡率(18.4%)第一的恶性肿瘤。消化系统肿瘤,如结肠癌(9.2%)、胃癌(8.2%)、肝癌(8.2%)等位居全球恶性肿瘤发生率第五位,死因第三位,已成为严重危害人类健康的恶性疾病之一。我国是全球癌症发病率(21%)和死亡率(24%)最高的国家。不同的癌症虽然病因及症状存在差异,但临床和病理组织观察均表现出pH梯度失调、代谢紊乱、肿瘤细胞迅速生长及转移的特征[2]。
Na+/K+-ATPase(NKA)是镶嵌在细胞膜磷脂双分子层之间的一种通道蛋白,具有ATPase活性,每消耗一分子ATP可将3个Na+泵出而泵入2个K+,以保持细胞高钾状态,维持细胞内外渗透压、膜电位稳态,产生动作电位,促进系统体液平衡[3-7]。NKA由4个α、3个β亚单位及γ亚型组成[8-10],α亚基有α1、α2、α3、α4亚型,相对分子量110~130kDa,包括ATP、CTS、Na+、K+等配体的结合位点。α亚基的N端和C端均位于胞内,通过10个跨膜螺旋区定位于质膜上[11](图1),α亚基在不同组织中特异性表达,其中α1亚型(ATP1A1)在真核细胞中广泛表达,α2、α3亚型主要表达于神经组织、心肌细胞等,α4亚型主要在睾丸中表达。α1亚基是一个具有Mg2+、ATP、Na+、K+和哇巴因结合位点的催化亚基;β亚基为调节性糖蛋白,在α亚基的合成、稳定性和转运中起着重要作用;γ亚基属于相对分子质量为6.5~10 kDa的单次跨膜FXYD蛋白家族,可通过与α羧基末端相互作用,调节NKA与底物的亲和力[12]。近期研究发现[13],NKA基因的某些突变可能会比离子泵功能失活引起更大的生理扰动,这种生理扰动可能是通过使离子通道泄漏、蛋白质不稳定或错误折叠等方式产生。
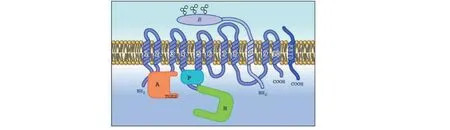
图1 Na+/K+-ATPase结构与α-亚单位结构示意图Fig.1 The general structure of Na+/K+-ATPase and alpha subunits注:α亚基上具有用于离子传输的催化域(A,P和N结构域);A:执行结构域;P:磷酸化结构域;N:核酸结合结构域。Note:The α-subunit carries all the catalytically domains (Domain A,P,and N) for ion transport;A:Actuator domain;P:Phosphorylation domain;N:Nucleotide binding domain.
NKA在主动转运、能量代谢、信号传递等方面都发挥着重要作用[14-17],其中信号转导作用主要归因于α亚基[18]。在各种肿瘤中ATP1A1的表达具有显著差异性[5,19,20],调节ATP1A1基因的表达对抑制肿瘤进展具有积极的作用。本文就ATP1A1基因在不同肿瘤中的表达情况、参与信号转导机制及目前以ATP1A1为靶点的治疗应用进行综述,以期为后续研究提供参考。
1 ATP1A1基因在肿瘤中的表达差异性
缺氧是肿瘤微环境的主要特征之一,NKA活性降低加重肿瘤组织缺氧程度并参与维持癌细胞异常的pH梯度[21,22],缺氧和细胞外酸化又使NKA离子泵活性进一步降低。研究发现,ATP1A1在多种癌细胞中过表达,如乳腺癌[23]、肺癌[24,25]、肝癌[26]、胶质瘤[27]等。其中乳腺癌患者ATP1A1过表达与乳腺癌患者生存率低密切相关。相对于ATP1A1过表达的乳腺癌患者,ATP1A1低表达的乳腺癌患者具有更长的生存期,抑制ATP1A1的表达具有抑制肿瘤生长,延长乳腺癌患者生存期的作用[23]。Mijatovic等[24]对非小细胞肺癌(NSCLC)的临床样本研究显示,66%的样品中α1亚基过表达,α2和α3亚基在正常肺组织和NSCLCs中表达无差异,提示NKA信号转导功能的失调主要因α1亚基的表达改变所导致。沉默或抑制ATP1A1基因的表达可显著抑制癌细胞的增殖和迁移能力。恶性神经胶质瘤是复发率和死亡率最高的中枢神经系统疾病之一,ATP1A1-siRNA的转染实验证实[28],钠泵抑制剂在治疗人脑胶质瘤中具有积极作用,抑制ATP1A1可能是人类神经胶质瘤的潜在治疗方法。
与之相反,在某些肿瘤中ATP1A1基因呈现低表达现象,如结直肠癌[10,29]、前列腺癌[30]、肾癌[31]等。Sakai等[10]发现与正常粘膜细胞相比,结直肠癌患者肿瘤组织中NKA活性显著降低,α1亚基表达下降,α3亚基表达水平升高,提示ATP1A1表达的减少和α3亚基的增加可能与结直肠癌的发生和发展有关。这一结论在de Souza等[29]的研究中也得到证实,并发现NKAα1和β1亚基下调和ERK 1/2激活是相互关联的,这种关联引起了直肠癌细胞粘附性的丧失,而这种细胞粘附性的降低对直肠癌的发展起到关键作用。在前列腺癌的研究中[30]发现,正常前列腺和前列腺增生上皮细胞中α1亚型丰富,但晚期癌细胞中α1亚型却明显降低,说明ATP1A1表达的减少可能与前列腺的发展有关。同样,在肾癌细胞中[31]ATP1A1基因表达高低与肾癌(RCC)患者的生存情况也有相关性,ATP1A1低表达与RCC的生存期短相关,提高ATP1A1的表达具有明显延长RCC患者生存时间的作用[32,33]。
ATP1A1基因的异常表达广泛存在于各种肿瘤细胞中,其表达水平的高低与患者生存期长短相关,而在不同类型的肿瘤中ATP1A1基因表达体现出了细胞之间的差异性,这种表达的差异性与肿瘤类型的关系,以及其发生机制及意义尚未阐释,值得进一步深入的研究[34]。
2 ATP1A1参与信号转导的分子机制
NKA是质膜上一种广泛表达的膜蛋白,但只有约30%的质膜NKA行使离子泵功能,大部分NKA参与了依赖于酪氨酸激酶(Src)的细胞信号转导,其中α亚基为主要参与者[35]。α1亚基第二个胞浆结构域(CD2)与Src激酶结构域(SH2)相结合,稳定Src激酶处于无活性状态,α1亚基的任何改变,都将打破这一稳态,从而诱发细胞内信号转导,而其他α亚基均无此功能[35-37],因此,NKA的信号转导功能主要归因于α1亚基。
2.1 NKAα1亚基介导的信号转导
每个正常组织的上皮细胞约表达一百万个α1亚基,数量大概是Src的五倍。因此,α1亚基至少可以通过两种方式调节细胞活性:首先,可以结合并保持Src处于非活化状态。当敲除一个拷贝的ATP1A1基因会导致α1亚基的表达降低20%~30%,致使Src和ERK活性提高至少1倍[38];其次,Na+/K+-ATPase-Src复合物上有强心类固醇激素结合位点,可调节细胞信号[39]。ATP1A1与Src的相互作用存在着争议,据报道,Src可以与NKA亚基的胞内域结合,从而调节下游蛋白质和细胞功能[40]。相反,也有报道称ATP1A1通过与Src结合而抑制Src活化[41]。
当ATP1A1基因减少或类固醇激素与α亚基结合,破坏了Src稳态,Src发生418位点的自磷酸化而被激活,激活的Src可与表皮生长因子受体(EGFR)结合,启动激酶级联信号转导,导致磷酸肌醇3-激酶(PI3K)、Ras/Raf/ERK、ERK1/2和PLC/PKC的随后激活;同时可以促使线粒体产生大量的ROS,调节胞内Ca2+浓度,激活第二信使[42],调控细胞的增殖、分化及凋亡[43](图2)。无论Src活性升高还是降低,与α1亚基相互作用的改变,都会改变Src信号传导,最终影响细胞的增殖和代谢。
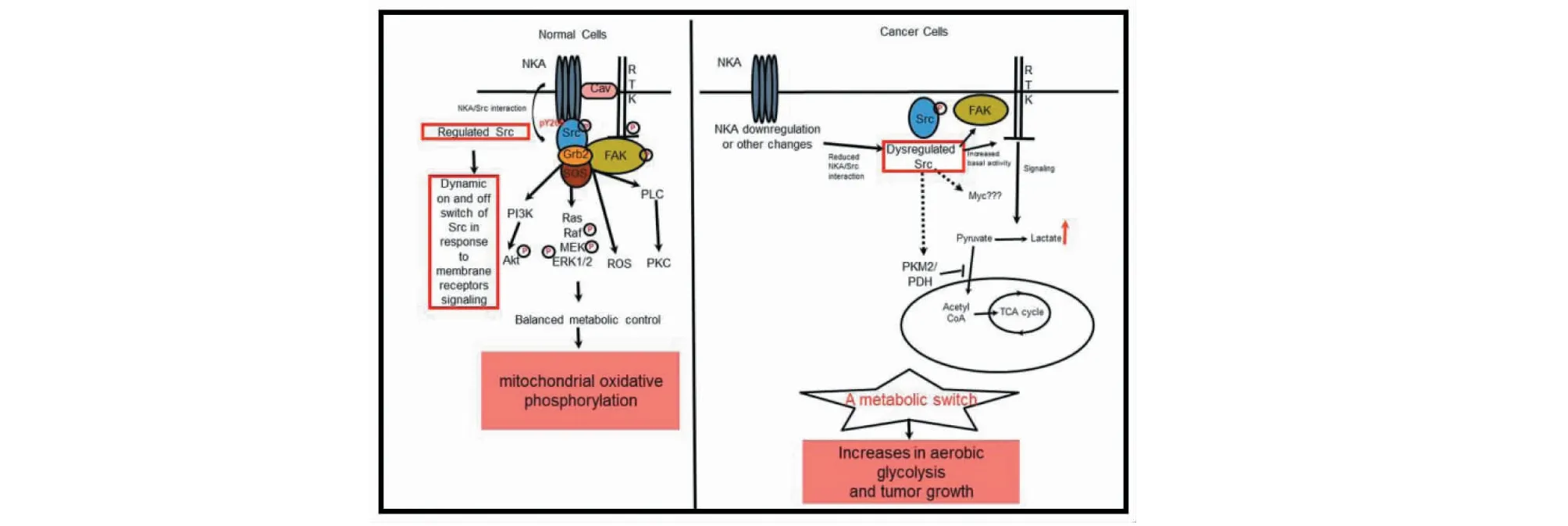
图2 依赖Na+/K+-ATPaseα1介导的Src激酶信号通路在正常细胞和癌细胞中的调节示意图Fig.2 Schematic diagrams of α1 Na+/K+-ATPase-mediated Src regulation in normal and cancer cells
2.1.1 PI3K信号通路
PI3K信号通路通过激活蛋白激酶B(Akt)将信号传递到下游不同的靶点,包括mTOR的激活(影响p70或4EBP1的转录),从而在细胞增殖、存活、迁移、自噬、血管新生等众多生理过程发挥作用。PI3K/AKT途径是控制细胞增殖、存活的主要途径之一,也是经典Ras通路之一。当Ras介导的AKT信号转导受到抑制时,PI3K途径被ATP1A1激活,调控细胞增殖和生长,用特定的Src抑制剂治疗神经胶质瘤细胞时可显著抑制癌细胞的迁移和增殖[44]。研究证实,敲除ATP1A1可以降低Src激酶Tyr416的磷酸化,导致Src活性受到抑制[45],从而进一步抑制基于Src活化的信号转导。ATP1A1基因过表达的胶质瘤细胞中,敲除ATP1A1基因可在不影响Akt表达水平的条件下,抑制Akt蛋白的磷酸化,负调控PI3K-Akt-mTOR通路,从而诱导自噬的发生[43],调节NKA在质膜上的密度及分布。
2.1.2 MAPK信号通路
MAPK超家族包括3个亚家族,即MAPK/JNK、p38MAPK及ERK1/2。Snhematorova等[46]对MAPK信号通路在巴顿病的分子机制研究中发现,由于ATP1A1蛋白质三级结构的错误折叠导致Src激酶活性的失调,发生自发性和重复激活,而激活的EGFR,随后导致MAPK的级联。ERK 1/2活化可增加细胞cyclinDl蛋白活性和基因表达,cyclinDl蛋白是G1向S期转换的正性调控因子,cyclinDl的过度表达可导致细胞异常增殖[47],ERK 1/2的激活可诱导癌细胞的大量增殖。在ATP1A1基因低表达的肾癌细胞中,通过转染ATP1A1表达质粒,肾癌细胞中磷酸化的MEK和ERK蛋白在转染细胞中表达量显著降低(约为50%)。这说明对于低表达ATP1A1基因的癌细胞来说,提高ATP1A1基因表达或抑制NKA离子泵活性均可以起到抑制Raf/MEK/ERK活化的作用,从而抑制细胞增殖及分化[28,30]。
2.1.3 PKC信号通路
PKC是肿瘤细胞活化的重要信号分子,参与细胞增殖、分化、凋亡及肿瘤生成等过程[48]。为了探讨PKC与NKA活性的关系,研究者[49]采用PKC抑制剂处理肾癌细胞(Caco2),发现PKC通路被抑制的同时NKA活性显著降低。Sottejeau等[48]的研究表明,ATP1A1亚基参与了PKC介导的离子转运调节,PKC调节NKA进出质膜的循环,PKC的激活可影响网格蛋白所介导的内吞作用,从而影响NKA在质膜中的分布,调节NKA的活性。研究证实,NKAα1亚基16位和23位丝氨酸的磷酸化是PKC活化NKA的活化位点,NKA的活化继而又使PKC进一步激活[50]。
2.2 NKA α1介导的细胞内吞
细胞内吞是细胞与外界物质交流至关重要的过程,包括网格蛋白和非网格蛋白介导的内吞作用,涉及到细胞极性、迁移、分裂等[51]。EGFR是位于细胞质膜上的跨膜糖蛋白,属于酪氨酸激酶受体,激活的Src与EGFR结合,导致EGFR的反式激活,诱导网格蛋白介导的细胞内吞。Lingemann等[52]最新研究发现,肺合胞病毒(RSV)感染与ATP1A1信号激活密切相关,ATP1A1的激活导致EGFR的反式激活,诱发肌动蛋白重排和质膜皱褶,膜的延伸将RSV吞噬到囊泡中,RSV以包膜的形式进入宿主细胞,其机制不依赖病毒转录和基因组或病毒复制。降低ATP1A1基因的表达,抑制Src-EGFR信号的激活,可显著降低RSV感染效率(图3)。
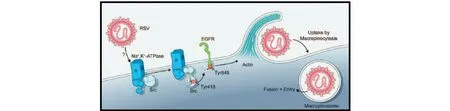
图3 ATP1A1依赖性RSV进入细胞的模式图Fig.3 Proposed model of ATP1A1-dependent macropinocytic entry of RSV
3 ATP1A1基因表达与肿瘤细胞增殖、凋亡的关系
NKAα1亚基参与的上述细胞信号转导,涉及到了细胞增殖、分化、迁移、凋亡、肿瘤形成等过程[53,54]。对于ATP1A1过表达的肿瘤细胞,α1亚基在细胞膜上的分布显著提高,ATP1A1的敲除或沉默可以减少Src激酶级联激活,下调Akt和ERK1/2磷酸化,从而有效抑制细胞的增殖和生长。将人类肝癌细胞的ATP1A1基因沉默或抑制的实验结果显示,抑制cyclin依赖性激酶2(CDK2)的表达,细胞产生S期阻滞,细胞的增殖能力和迁移能力降低,同时细胞内Ca2+和ROS的增加,而过度产生的 ROS 导致 DNA 的氧化损伤,从而引发细胞凋亡[28]。因此,对ATP1A1过表达的肿瘤来说,抑制ATP1A1基因的表达,具有延长生存期的作用[55]。
对于ATP1A1低表达的肿瘤,NKA离子泵功能降低,导致细胞内H+与细胞外部的Na+跨膜交换减少,胞外pH降低,呈现弱酸性。临床研究发现,ATP1A1阳性的肾癌患者比ATP1A1阴性的患者有更长的生存时间。外源ATP1A1基因的引入可增加线粒体ROS的产生,导致DNA损伤,抑制肾癌细胞增殖和细胞迁移,诱导细胞凋亡的发生[32]。在前列腺癌中NKA下调降低了离子泵的活性,及Src相关的信号转导,α1亚基类似多肽pNaKtide的导入,可以降低Src激酶活性,从而诱导细胞凋亡,阻止体内癌细胞增殖[17]。
可见α1亚基在不同肿瘤细胞中的特异性表达与其所行使的功能,存在着复杂的联系,正常细胞和恶性细胞的NKA活性不同,可能是由于肿瘤细胞质膜NKA的密度改变以及同工酶表达的差异所致。这种转变的分子机制尚不清楚,是一个值得进一步研究的课题。
4 以ATP1A1为靶点的药物开发及临床应用
α1亚基在信号转导和NKA活性调节中所表现出来的双重作用,为以ATP1A1为靶点的药物研究与开发提供了依据。脊椎动物体内可产生内源性强心剂类固醇[18],如哇巴因,但在生理条件下含量很低,故其浓度变化不会导致离子浓度的扰动,但可以引发信号级联[56]。强心苷类物质[57]通过抑制NKA的信号转导来发挥作用,如诱发自噬、促进细胞凋亡等方式发挥抗癌作用[58]。低浓度的强心苷,包括哇巴因,地高辛和洋地黄毒苷,可以在不影响NKA活性的情况下阻断癌细胞的生长,通过体积调节阴离子通道(volume-regulated anion channel,VRAC)和NKA之间的相互作用介导强心苷诱导的信号传导,刺激活性氧的产生,激活VRAC,VRAC电流增强,并伴随着癌细胞增殖的减少[59]。Lan等[60]对华蟾素的主要成分蟾毒灵抗胶质母细胞瘤的研究显示,蟾蜍灵可诱导胶质母细胞瘤细胞凋亡和氧化应激,并引发DNA损伤,通过激活泛素-蛋白酶体信号通路显著抑制胶质母细胞瘤细胞中ATP1A1的表达,促进ATP1A1蛋白的降解,并显著抑制肿瘤的生长,进一步证实了ATP1A1在人胶质瘤抗癌作用中的关键作用,调节的ATP1A1和p53信号介导的线粒体凋亡途径的疗法可能是人类神经胶质瘤的潜在治疗方法。目前多种NKA抑制剂已开展临床研究(表1),其中地高辛(digoxin)、安维泽尔(anvirzel)和华蟾素等药物的I和II期临床试验结果显示,单独或与其他抗癌剂的联合使用,NKA抑制剂均具有良好的安全性,但疗效有限,需要进一步推进随机临床试验以证实强心苷类物质治疗癌症的有效性和安全性。寻找或开发具有NKA调节活性的抗癌药物也值得深入研究。
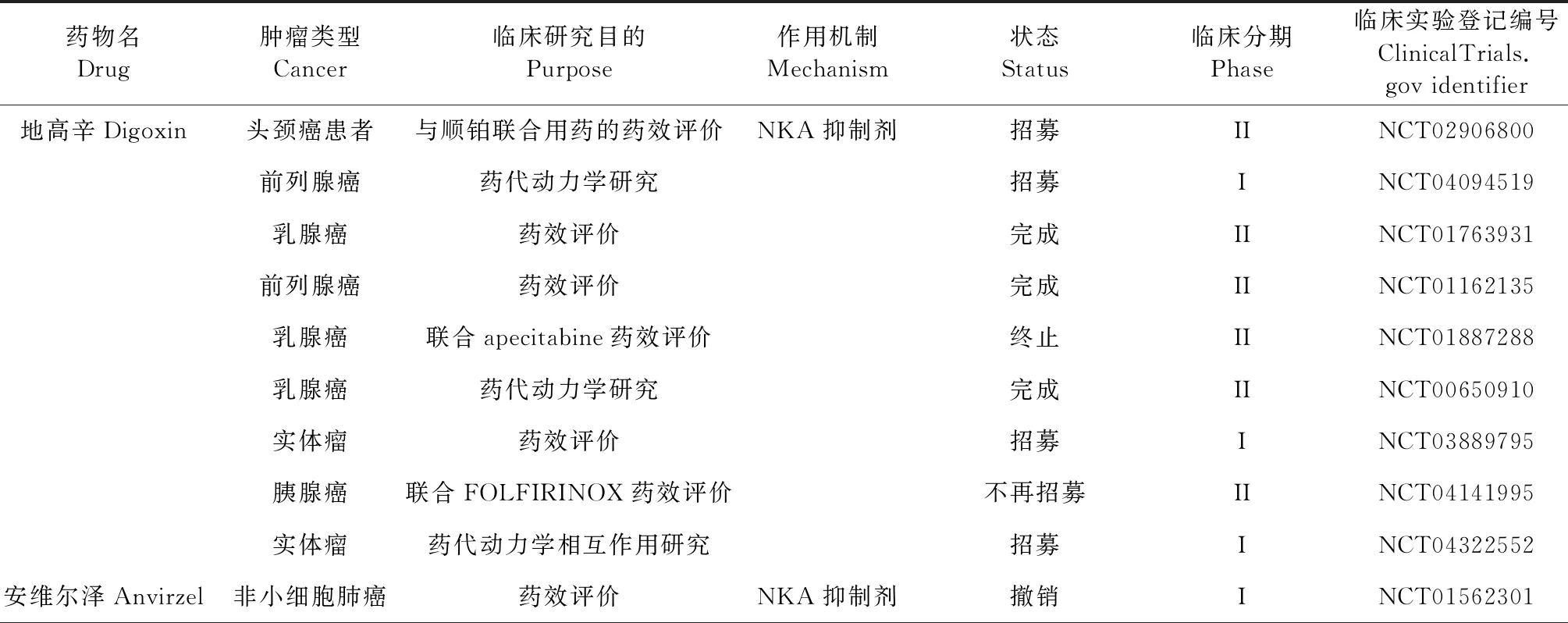
表1 Na+/K+-ATPase抑制剂抗癌作用的临床研究Table 1 Clinical study of anti-cancer effect of Na+/K+-ATPase inhibitor
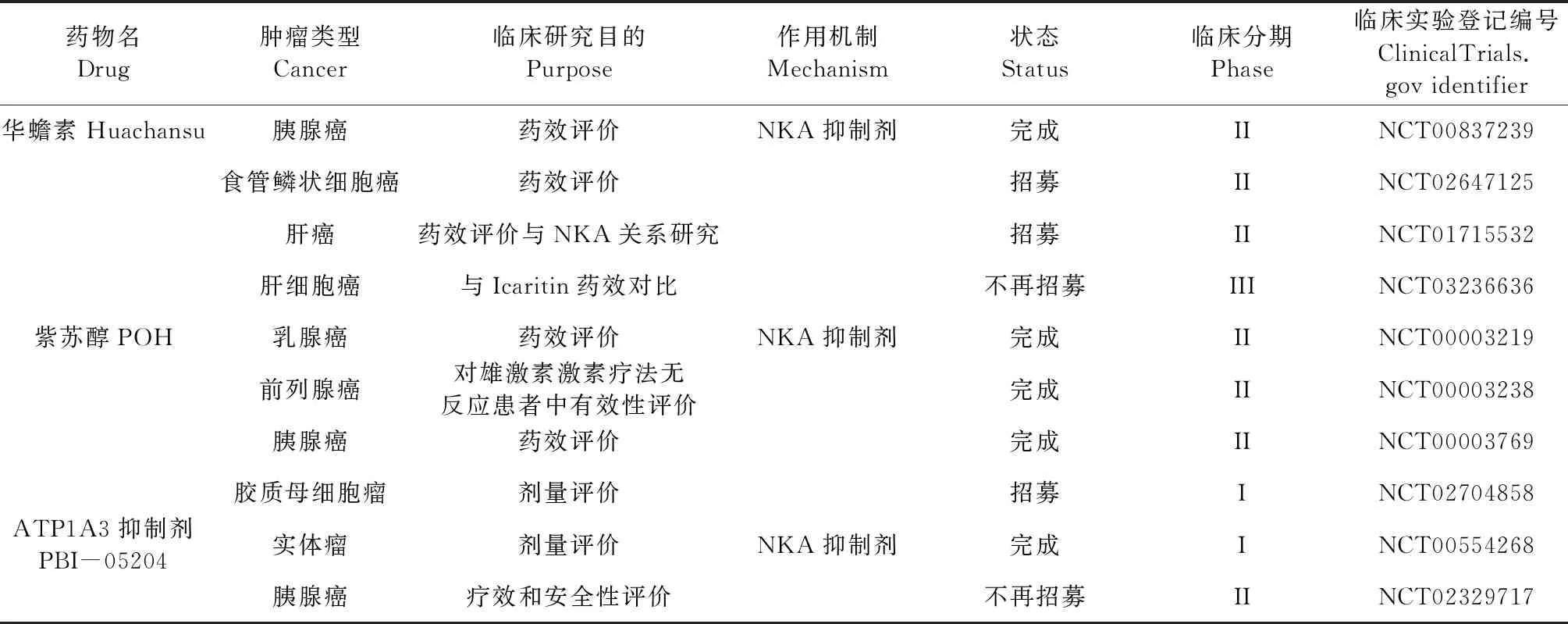
续表1(Continued Tab.1)
ATP1A1基因在不同肿瘤中表达具有显著性差异,作为信号转导的主要参与者,阐释其发生机制及意义对开发具有NKA调节功能的抗肿瘤药物具有重要的意义。近些年许多国内外学者通过敲除或沉默ATP1A1对其抗癌活性机制进行了大量研究,但其作用机制复杂,涉及到不同肿瘤中ATP1A1基因表达的特异性,且目前关于ATP1A1在稳定Src和激活Src方面存在争议。因此,在今后的研究中,需要进一步阐释ATP1A1基因表达特异性在肿瘤中的发生机制,构建肿瘤模型以阐释α1-Src相互作用的确切机制和直接证据。

