HPLC指纹图谱结合多指标含量测定的八角莲质量评价研究
崔誉文,何 昊,张 丽,李玉泽,黄文丽,张化为,宋小妹
1西安医学院 药学院,西安 710021;2陕西中医药大学 陕西省秦岭中草药应用开发工程技术研究中心/陕西省中药基础与新药研究重点实验室,咸阳712046
八角莲为八角莲属八角莲(Dysosmaversipellis(Hance) M.Cheng ex Ying)的干燥根及根茎,在陕西又名八角七,是传统民间草药“太白七药”之一[1]。八角莲主要分布在湖北、广西、广东、江西、四川、贵州、陕西等地,具有清热解毒、祛瘀止痛、化痰散结的功效,主治痈肿疔疮、跌打损伤、毒蛇咬伤、咽喉肿痛、瘰疬[1,2]。八角莲以鬼臼之名始载于《神农本草经》,但因其外观和药性与桃儿七、窝儿七相似,故历代草本记载常有混淆之处。八角莲以木脂素类和黄酮类成分为主,如4′-去甲基鬼臼毒素、鬼臼毒素、山柰酚、槲皮素等[3-6]。研究表明,八角莲具有抗肿瘤、抗病毒、抗菌消炎等药理作用[7-12]。值得注意的是,八角莲有毒,若使用不当可导致中毒,表现为恶心、呕吐、呼吸急促,严重可导致死亡[13-15]。临床上八角莲可用于流行性出血热、尖锐湿疣等治疗,表现出较好的药理作用[16,17]。笔者通过文献检索发现,目前对八角莲质量控制标准研究尚不完整,对其化学成分的测定方法和指纹图谱研究尚浅。因此,为进一步完善八角莲质量评价体系,本研究参考相关研究[18-20],通过建立八角莲HPLC指纹图谱,测定其5个化学成分的含量,以期为八角莲的质量评价提供科学依据。
1 仪器与材料
1.1 仪器
Waters e2695型高效液相色谱仪(美国Waters公司);舒美KQ-500DE型超声波清洗仪(昆山市超声仪器有限责任公司);KEWE电热恒温水浴锅(北京科伟永兴有限公司);GB204电子分析天平(瑞士梅特勒托利多公司,精度0.01 mg);101-A4型电热鼓风干燥箱(上海捷呈实验仪器有限公司);DYF-200A型高速万能粉碎机(上海比朗仪器有限公司)。
1.2 试药
对照品(+)-tanegool-7′-methylether、山柰酚葡萄糖苷、4′-去甲基鬼臼毒素、鬼臼毒素葡萄糖苷、槲皮素、鬼臼毒素、鬼臼毒酮、山柰酚均由本课题组自制,纯度经高相液相色谱按面积归一化法测定均大于98%,符合定量要求。甲醇、磷酸均为色谱纯(天津市科密欧化学试剂有限公司);其余所用试剂均为分析纯(天津市天力化学有限公司);实验水为娃哈哈纯净水;八角莲药材由课题组采挖或购买于四川、广西、湖北、贵州、云南等省区。经陕西中医药大学王继涛高级实验师鉴定为小檗科植物八角莲Dysosmaversipellis(Hance) M.Cheng ex Ying的干燥根及根茎。各产地药材鲜品采收或购买后50 ℃烘干,除去杂质,备用。16批药材样品来源见表1。
2 方法与结果
2.1 色谱条件
Thermo HyPURITY C18色谱柱(250 mm×4.6 mm,5 μm;流动相:流动相甲醇(A)- 0.4%磷酸水溶液(B),梯度洗脱(0~13 min,35%→40% A;13~20 min,40%→43% A;20~40 min,43%→45% A;40~50 min,45%→49% A;50~55 min,49%→54% A;55~56 min,54%→60% A;56 min~70 min,60% A;70~80 min,60%→70% A);流速:1.0 mL/min;柱温:30 ℃;检测波长:290 nm;进样量:10 μL。八角莲化学对照品及供试品HPLC色谱图见图1。
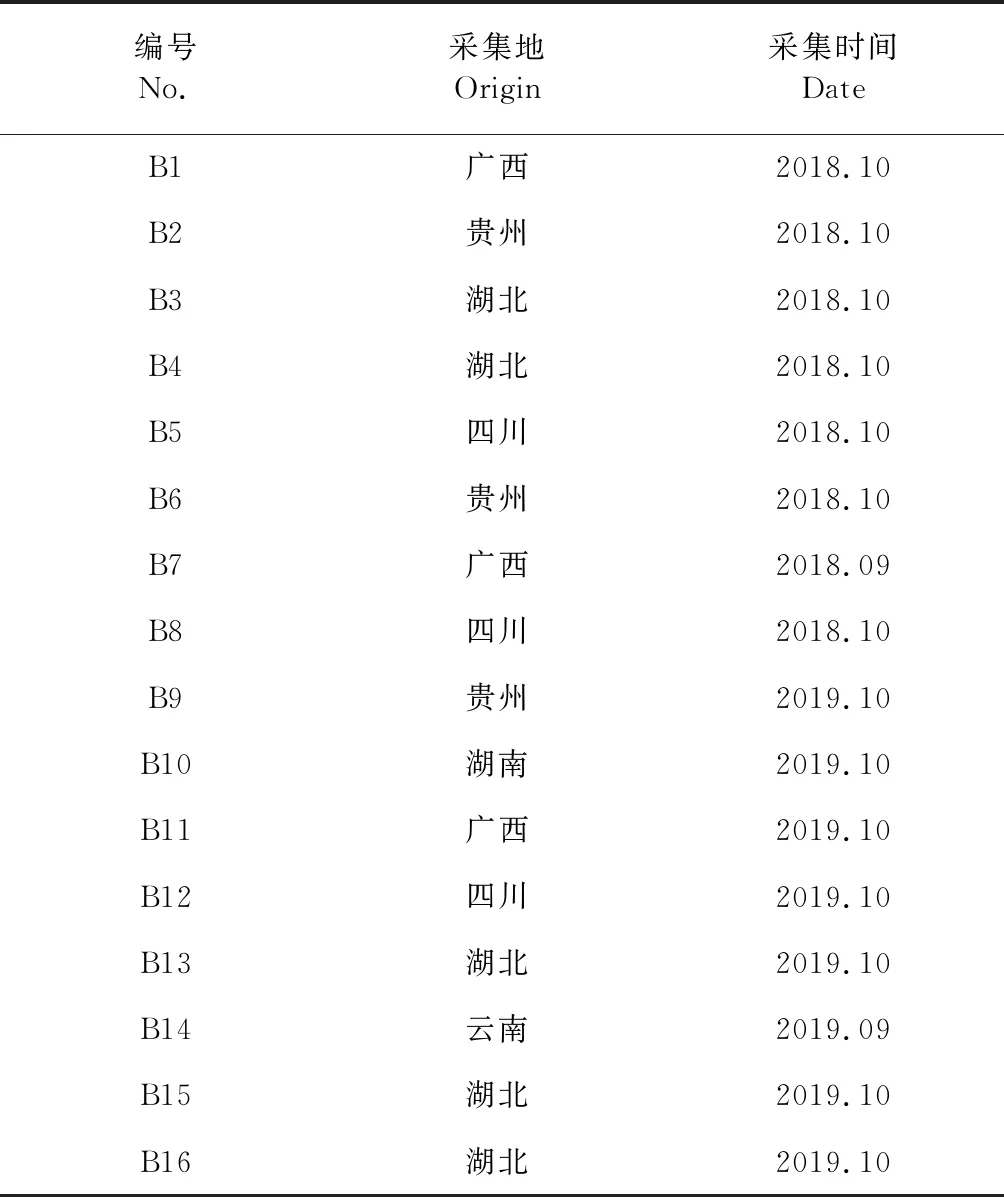
表1 八角莲药材样品来源Table 1 Sources information of 16 samples
2.2 溶液的制备2.2.1 对照品溶液的制备
精密称取(+)-tanegool-7′-methylether、山柰酚葡萄糖苷、4′-去甲基鬼臼毒素、鬼臼毒素葡萄糖苷、槲皮素、鬼臼毒素、鬼臼毒酮、山柰酚的对照品适量,置同一量瓶中,用80%甲醇溶解并定容成质量浓度分别为0.154、0.103、0.754、0.840、0.219、5.04、0.146、0.446 mg/mL的混合溶液,即得。
2.2.2 供试品溶液的制备
精密称取八角莲药材粉末(过5号筛)1.0 g,置100 mL具塞锥形瓶中,精密加入80%甲醇25 mL,称重,超声(250 W,60 kHz)45 min,放冷,再称重,用80%甲醇补足减失的量,摇匀,经0.45 μm微孔滤膜滤过,取续滤液作为供试品溶液,即得。

图1 混合对照品(A)及供试品(B)的HPLC色谱图Fig.1 HPLC chromatograms of mixed reference substances (A) and samples (B) 注:11.(+)-Tanegool-7′-methylether;15.山柰酚葡萄糖苷;17.4′-去甲基鬼臼毒素;19.鬼臼毒素葡萄糖苷;20.槲皮素;22.鬼臼毒素;23.鬼臼 毒酮;24.山柰酚。Note:11.(+)-Tanegool-7′-methylether;15.Kaempferol-3-O-β-D-glucoside;17.4′-demethylpodophyllotoxin; 19.Podophyllotoxin-4-O-β-D-glucoside;20.Quercetin;22.Podophyllotoxin;23.Podophyllotoxone;24.Kaempferol.
2.3 指纹图谱
2.3.1 方法学考察
2.3.1.1 精密度试验
分别取八角莲(B8)样品溶液,按“2.1”项下色谱条件分别连续进样6次,记录峰面积值,均以鬼臼毒素为参比峰,测得八角莲28个共有峰的相对保留时间RSD 均小于1%,相对峰面积的RSD均小于3%,表明仪器精密度良好。
2.3.1.2 稳定性试验
分别取八角莲(B8)样品溶液,在室温放置0、2、4、8、12、24 h后分别按“2.1”项下色谱条件进样,记录峰面积值,以鬼臼毒素为参比峰,测得八角莲28个共有峰的相对保留时间RSD 均小于1%,相对峰面积的RSD均小于3%,表明供试品溶液在室温放置24 h内稳定。
2.3.1.3 重复性试验
分别取八角莲(B8)样品,按照“2.2.2”项下的方法分别平行制备6份供试品溶液,按照“2.1”项下色谱条件进样,记录峰面积值,以鬼臼毒素为参比峰,测得八角莲28个共有峰的相对保留时间RSD 均小于1%,相对峰面积的RSD均小于3%,表明该方法的重复性良好。
2.3.2 指纹图谱建立
取16批八角莲不同产地的药材样品,每份约1.0 g,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录HPLC色谱图,将16批八角莲样品的色谱图导入中国药典委员会开发的《中药色谱指纹图谱相似度评价系统》(2012版)软件进行分析,以广西八角莲(B1)的指纹图谱为参照图谱,以中位数法生成对照图谱,时间窗宽度为0.4 s,经多点校正、自动匹配后生成八角莲药材指纹图谱的共有模式,见图2。
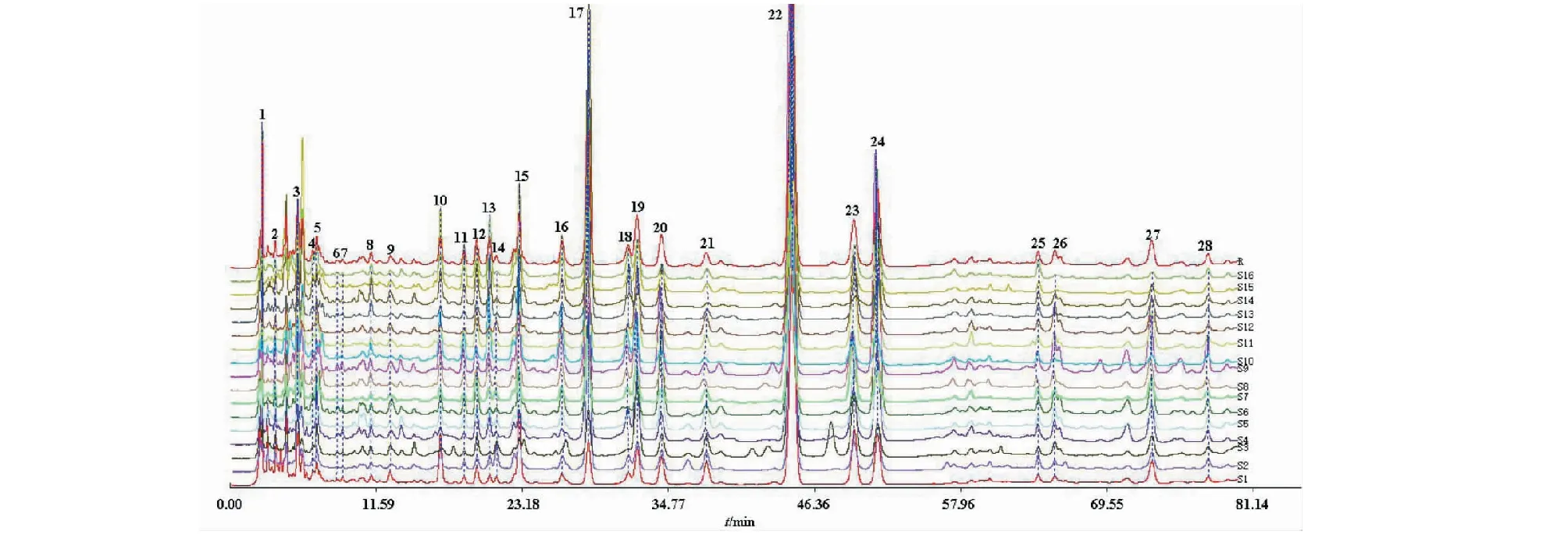
图2 16批次八角莲的指纹图谱Fig.2 HPLC fingerprints of 16 batches of the root of D.versipellis
2.3.3 共有峰的标定
根据16批八角莲药材的指纹图谱的检测结果,利用《中药色谱指纹图谱相似度评价体系》(2012版)的数据匹配功能,在对照指纹图谱上标定共有峰,八角莲HPLC指纹图谱中共有28个共有峰,见图3。通过HPLC将各对照品的保留时间与各药材的指纹图谱对照,共指认了其中的8个共有峰,分别为 (+)-tanegool-7′-methylether(11号峰)、山柰酚葡萄糖苷(15号峰)、4′-去甲基鬼臼毒素(17号峰)、鬼臼毒素葡萄糖苷(19号峰)、槲皮素(20号峰)、鬼臼毒素(22号峰)、鬼臼毒酮(23号峰)和山柰酚(24号峰)。选择出峰时间适中、峰面积较大、对称性较好的鬼臼毒素色谱峰(22号峰)作为参照峰(S),以参照峰的保留时间和峰面积作为1,分别计算其他各共有峰的相对保留时间和相对峰面积。结果见表2、表3。
图3 八角莲HPLC对照指纹图谱Fig.3 HPLC of common models fingerprint of the root of D.versipellis注: 11.(+)-Tanegool-7′-methylether;15.山柰酚葡萄糖苷;17.4′-去甲基鬼臼毒素;19.鬼臼毒素葡萄糖苷;20.槲皮素;22.鬼臼毒素;23.鬼臼 毒酮;24.山柰酚。Note:11.(+)-Tanegool-7′-methylether;15.Kaempferol-3-O-β-D-glucoside;17.4′-demethylpodophyllotoxin; 19.Podophyllotoxin-4-O-β-D-glucoside;20.Quercetin;22.Podophyllotoxin;23.Podophyllotoxone;24.Kaempferol.
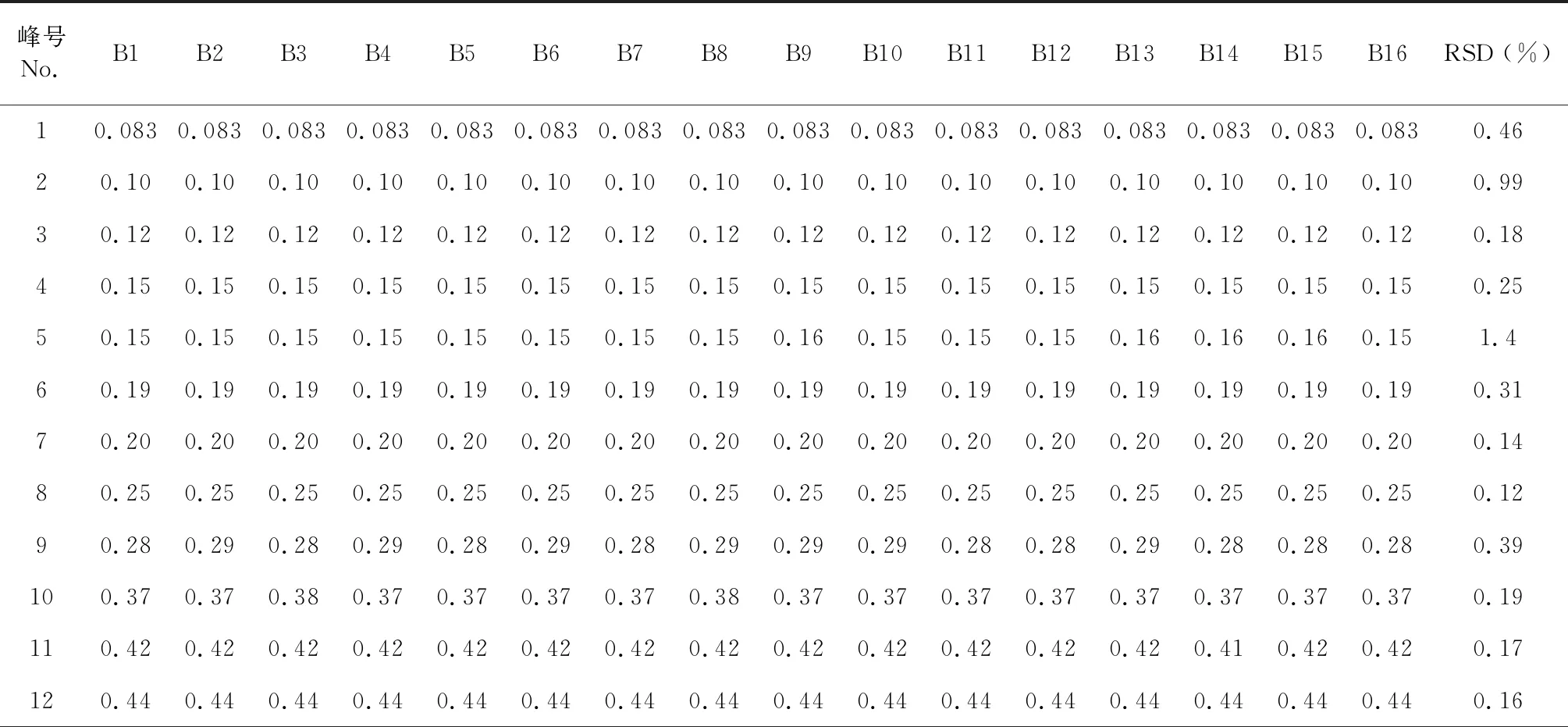
表2 八角莲共有峰的相对保留时间Table 2 Relative retention time of common peak
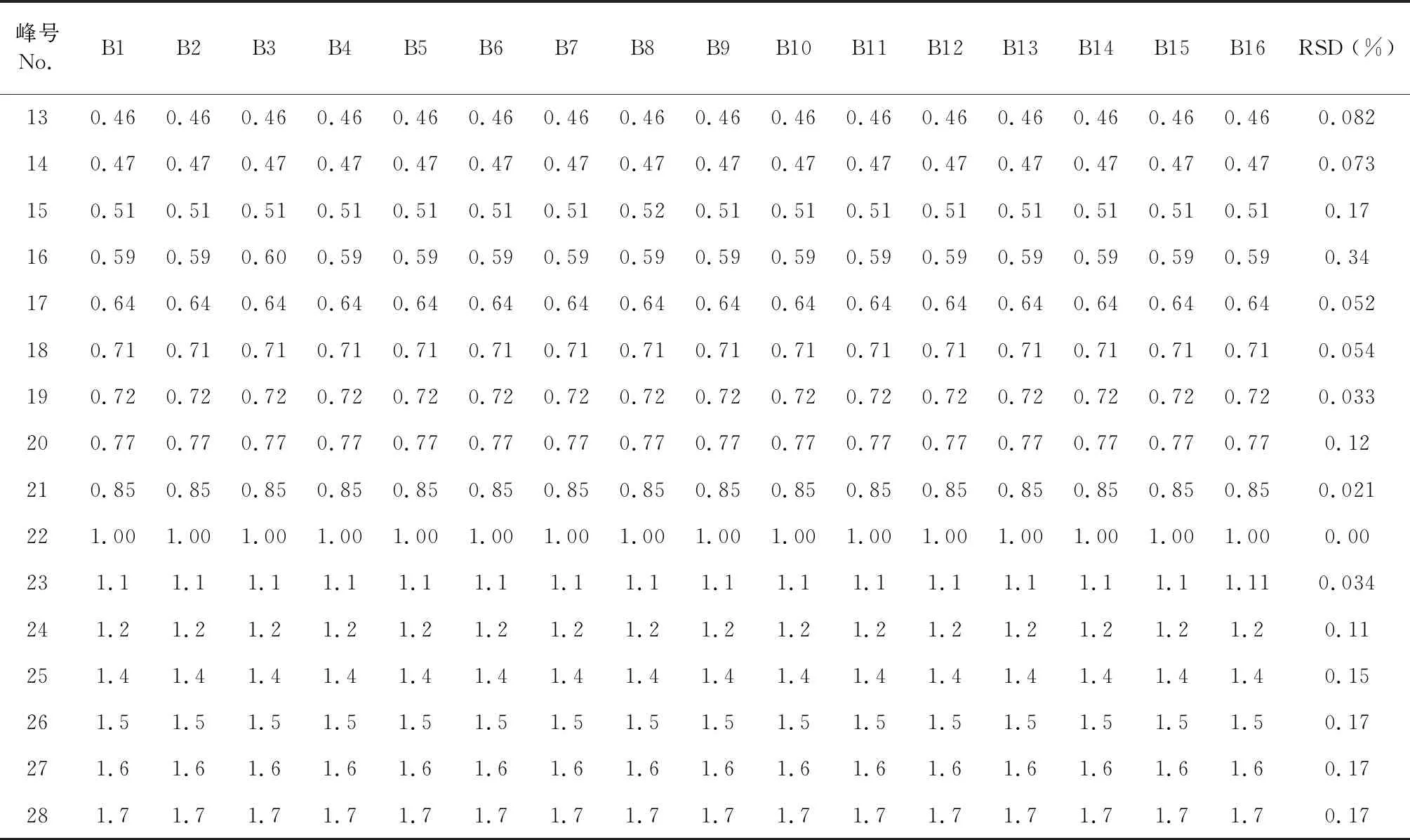
续表2(Continued Tab.2)
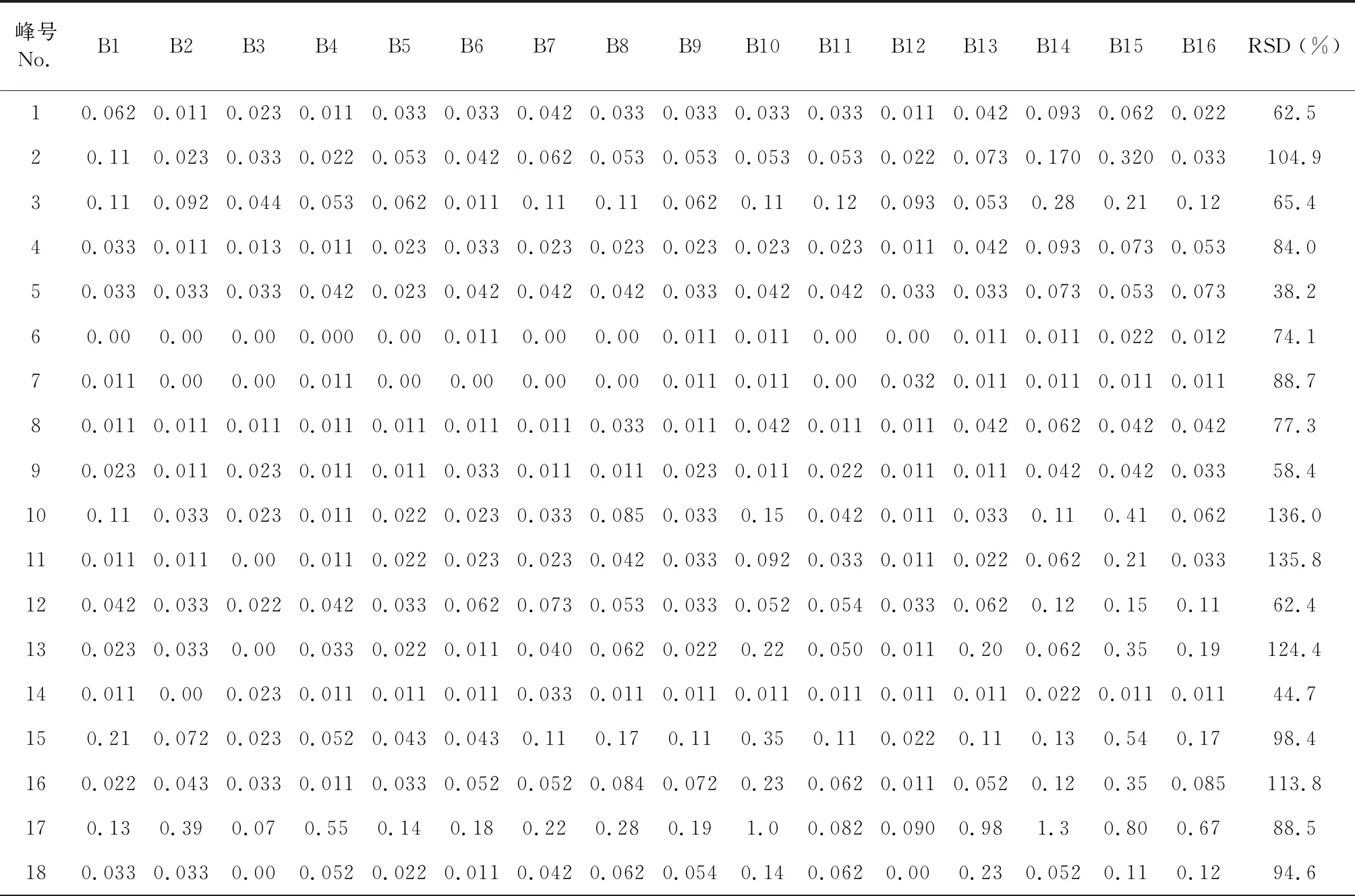
表3 八角莲共有峰的相对峰面积Table 3 Relative retention area of common peak
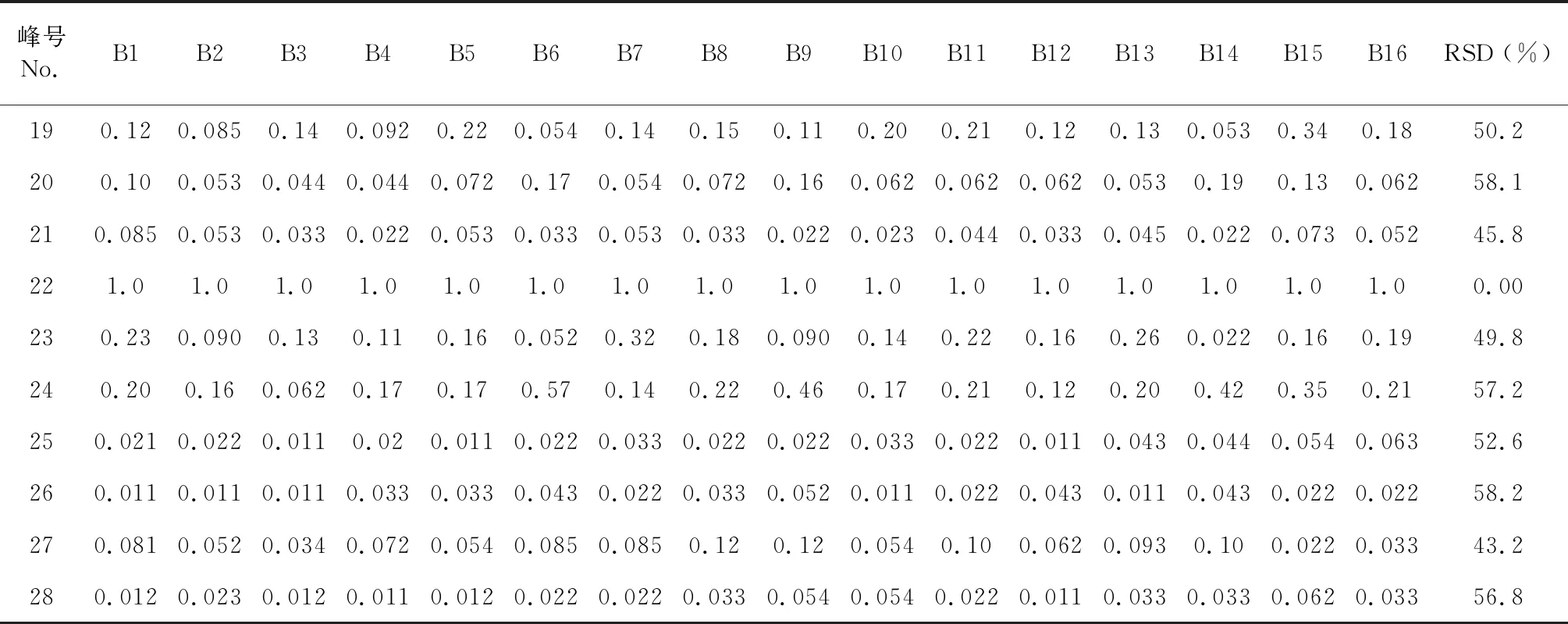
续表3(Continued Tab.3)
2.3.4 相似度评价
将各个批次的八角莲指纹图谱分别导入“中药色谱指纹图谱相似度评价系统(2012版)”软件,对各批次样品的指纹图谱与对照图谱进行相似度评价。八角莲与对照图谱的相似度除B10(湖南)、B14(湖北)、B15(湖北)外,其他均在0.9以上。结果见表4。
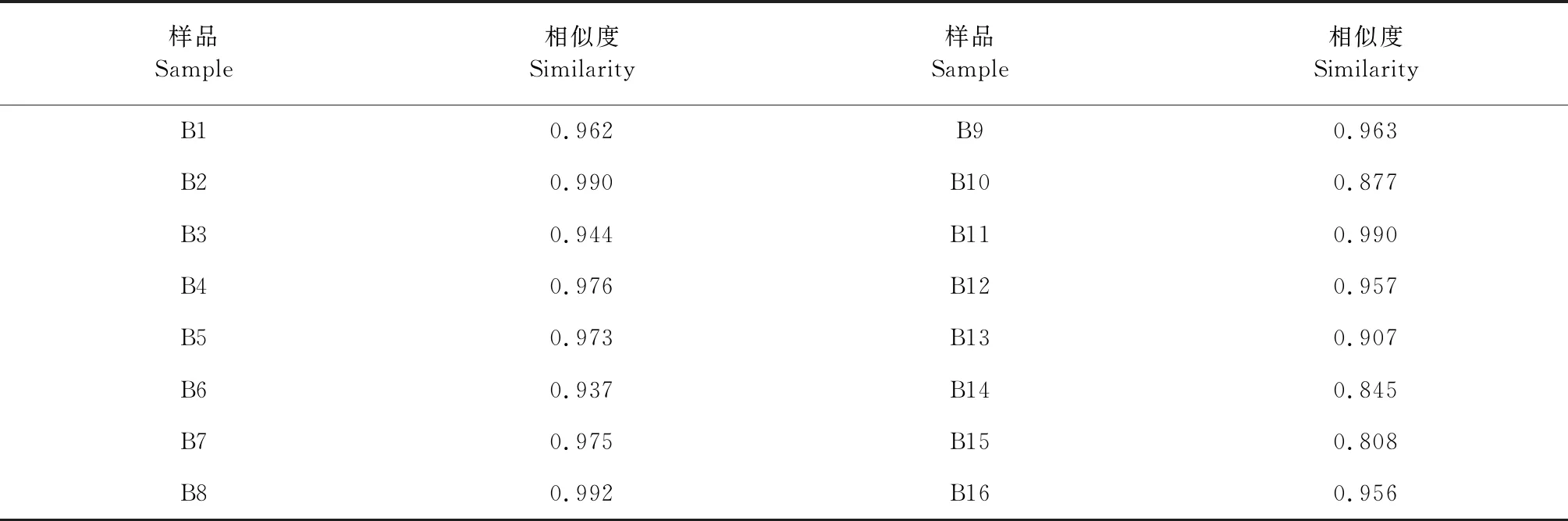
表4 八角莲样品与生成的对照图谱的相似度Table 4 Similarity of 16 batches of samples
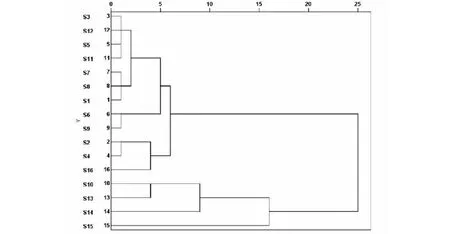
图4 16批药材指纹图谱聚类分析的树状图Fig.4 Dendrogram of fingerprint clustering analysis of 16 batches of samples
2.3.5 系统聚类分析
分别将16批八角莲样品的HPLC指纹图谱中各自的共有峰的峰面积数据导入SPSS19.0统计分析软件,采用组间联接法,以欧式平方距离对样品进行聚类分析结果见图4。由图4可知,16批八角莲大致分为两类,I类包括S1~S9、S11、S12、S16,各个批次的样品相似度较高(0.937 ~0.992),产地包括湖北、广西、贵州、四川、云南,II类包括S10、S13~S15,各个批次的样品相似度较低(0.808~0.907),产地包括湖南、湖北、云南。
2.4 含量测定
2.4.1 线性关系考察
将“2.2.1”项下混合对照品溶液,以80%甲醇水溶液依次稀释0、2、4、8、16、32倍,制成系列混合对照品溶液,吸取上述混合对照品溶液,按“2.1”项下色谱条件进行分析。以色谱峰峰面积(Y)为纵坐标,对照品质量浓度(X,μg/mL)为横坐标,得5种成分的回归方程。结果表明,5种成分线性关系良好(见表5)。

表5 5种成分线性关系结果Table 5 Results of linear ranges of 5 constituents
2.4.2 精密度试验
取同一供试品溶液(B8),按“2.1”项下色谱条件连续进样6次,记录峰面积值,测得(+)-tanegool-7′-methylether、4′-去甲基鬼臼毒素、槲皮素、鬼臼毒素、山柰酚峰面积的RSD(n=6)均小于3%,表明仪器精密度良好。
2.4.3 稳定性试验
取同一供试品溶液(B8),分别于0、4、8、12、16、20、24 h按“2.1”项下色谱条件进样,记录峰面积值,测得(+)-tanegool-7′-methylether、4′-去甲基鬼臼毒素、槲皮素、鬼臼毒素、山柰酚峰面积的RSD(n=6)均小于3%,表明供试品溶液在24 h内稳定性良好。
2.4.4 重复性试验
精密称取同一批次(B8)的药材粉末6 份,按照“2.2.2”项下的方法平行制备6份供试品溶液,按照“2.1”项下色谱条件进样,记录峰面积值,测得(+)-tanegool-7′-methylether、4′-去甲基鬼臼毒素、槲皮素、鬼臼毒素、山柰酚的平均含量分别为0.824、6.16、0.807、31.6、1.80 mg/g,峰面积的RSD(n=6)均小于3%,表明该方法的重复性良好。
2.4.5 加样回收率试验
精密称取已知含量(B8)的样品粉末6份,每份约0.5 g,精密称定,分别加入一定量对照品,按照“2.2.1”项下的方法制备,按“2.1”项下色谱条件进样测定,计算回收率。结果(+)-tanegool-7′-methylether、4′-去甲基鬼臼毒素、槲皮素、鬼臼毒素、山柰酚的平均回收率分别为98.2%、99.5%、99.4%、99.6%、98.7%,RSD均小于3%(见表6)。
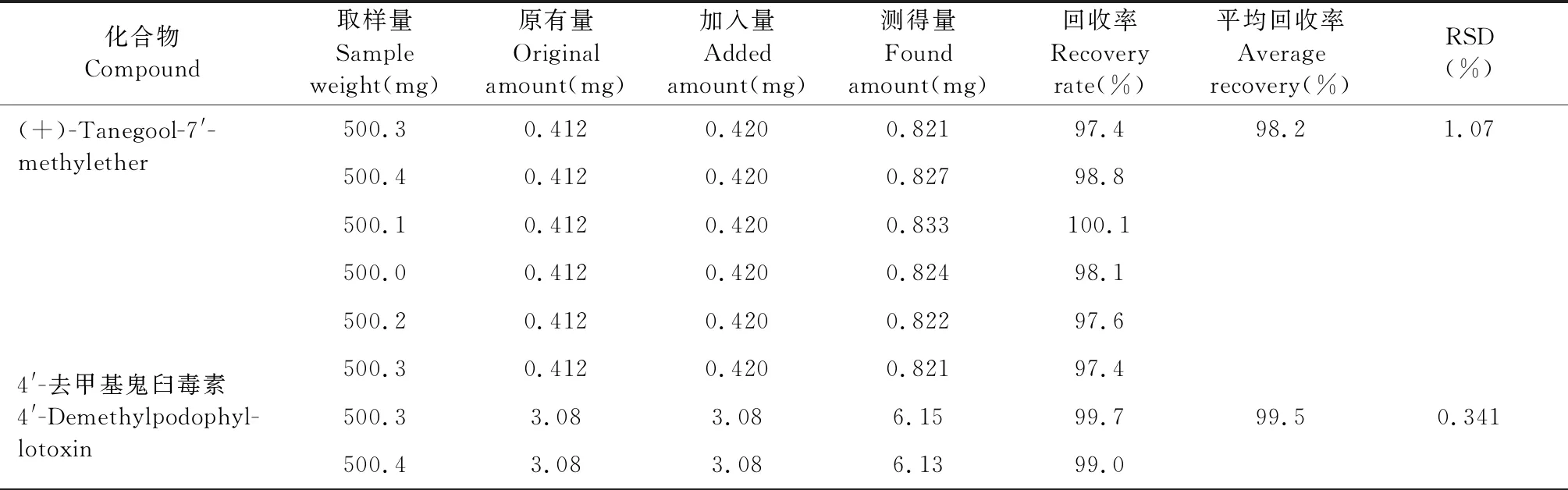
表6 回收率试验结果Table 6 Results of recovery test
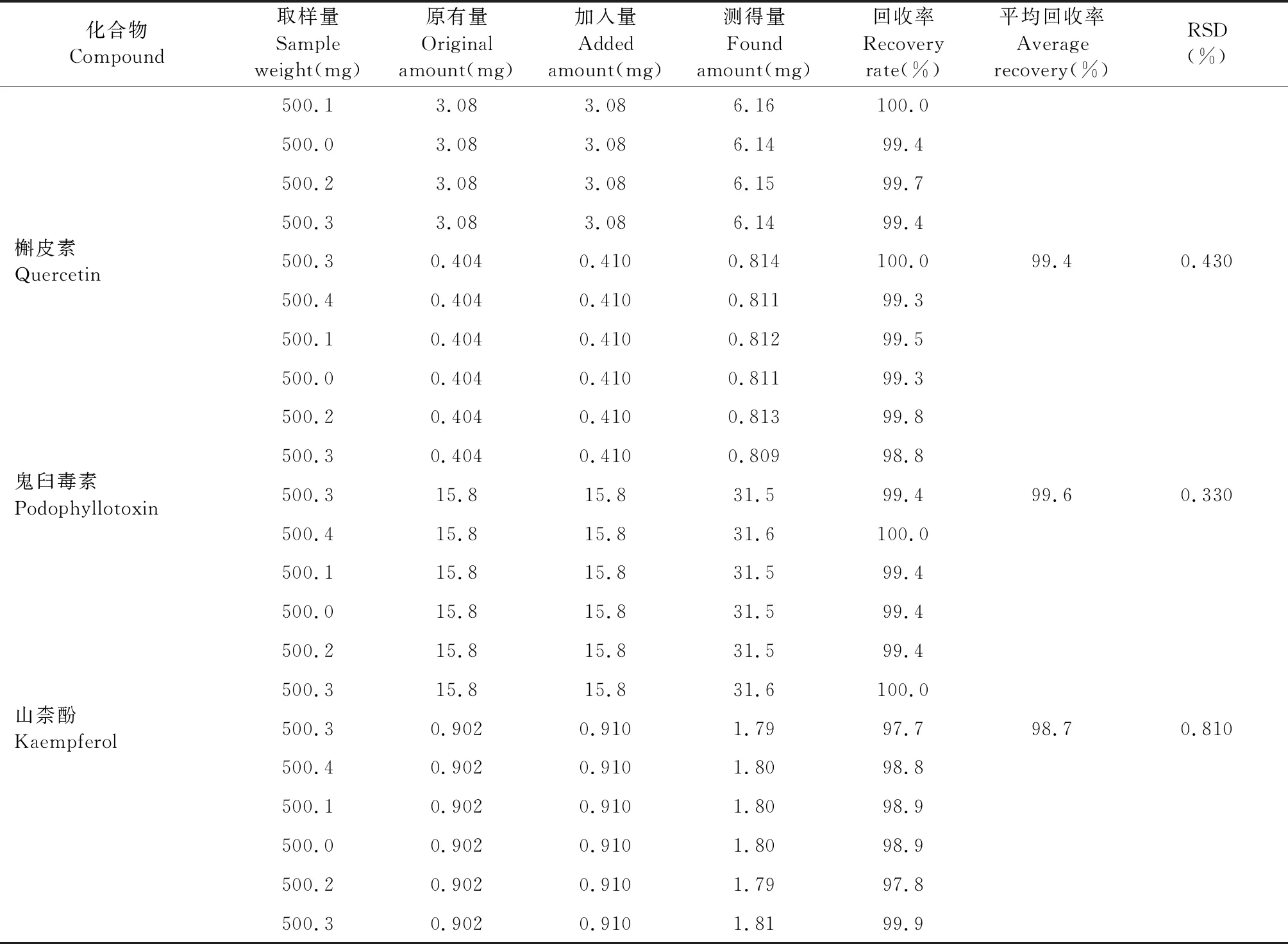
续表6(Continued Tab.6)
2.4.6 样品含量测定
分别精密称取不同批次的八角莲样品约1.0 g,每个样品平行2份,按“2.2.2”项下方法制备供试品溶液,以“2.1”项下的色谱条件进样测定,计算各样品中(+)-tanegool-7′-methylether、4′-去甲基鬼臼毒素、槲皮素、鬼臼毒素、山柰酚的含量。结果见表7。
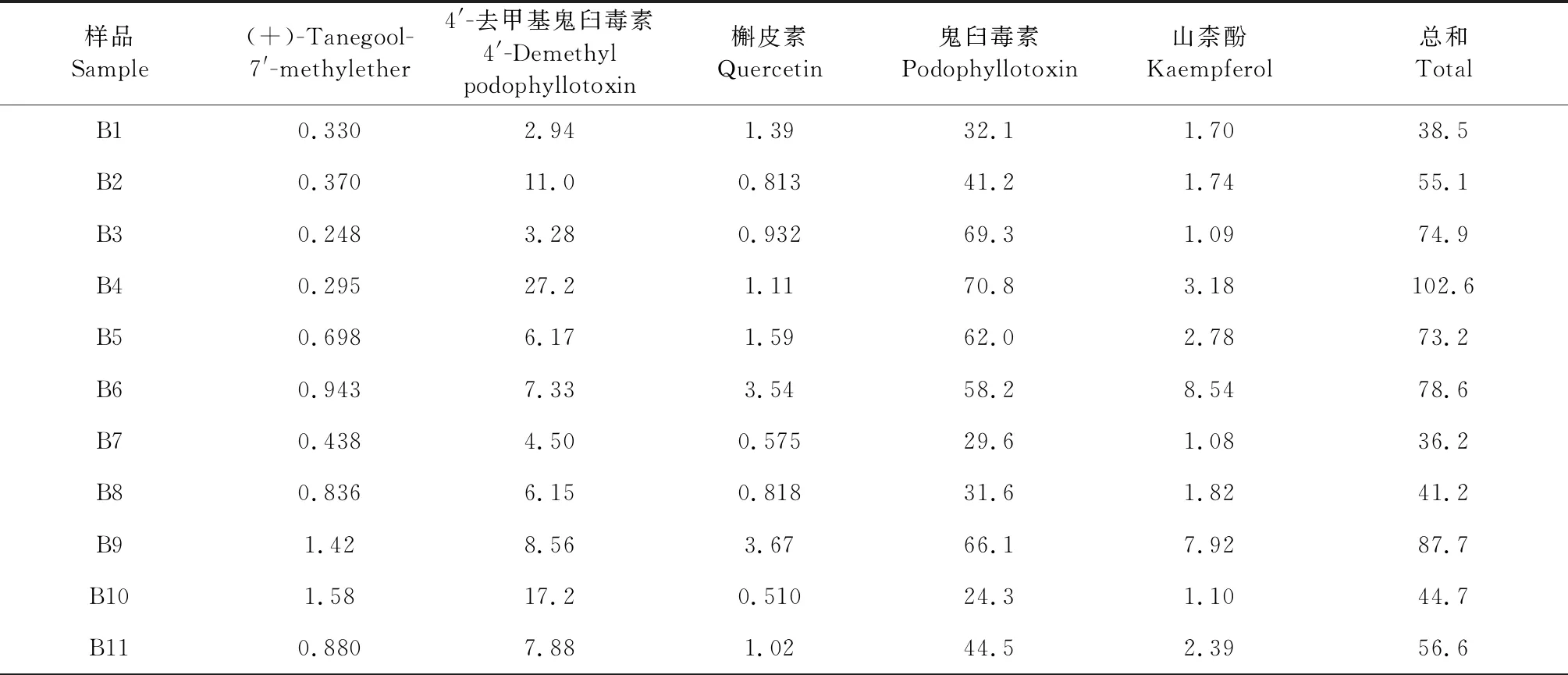
表7 样品含量测定结果(n=2)Table 7 Results of the samples content determination(n=2) (mg/g)
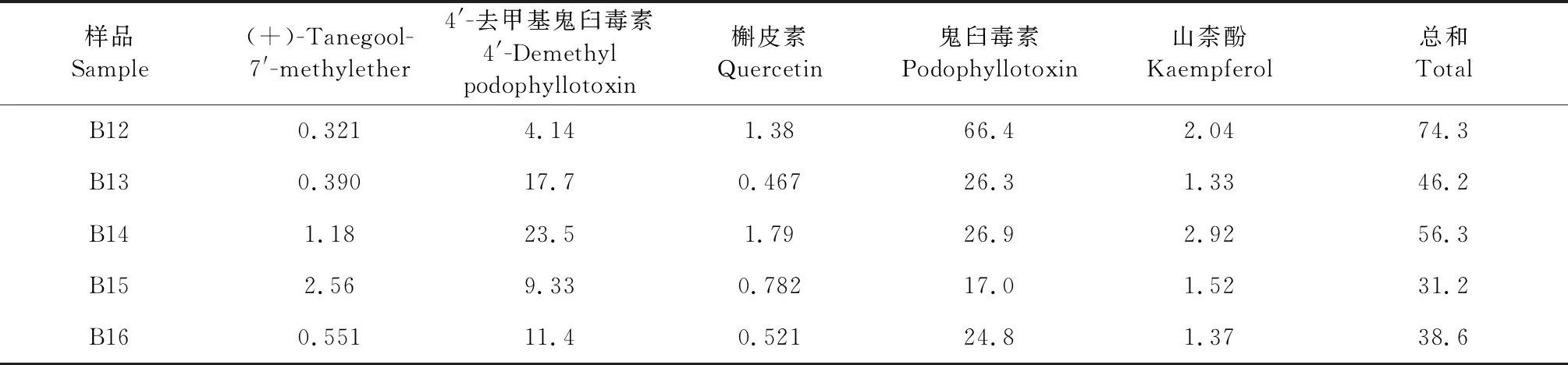
续表7(Continued Tab.7)
2.4.7 耐用性试验
2.4.7.1 色谱柱考察
精密称取样品(编号:B8)适量,按“2.2.2”项下方法制备供试品溶液,分别设置色谱柱Thermo HyPURITY C18色谱柱(250 mm×4.6 mm,5 μm)、Waters SunFire C18(150 mm×4.6 mm,5 μm)、Inertsil ODS-3 C18(250 mm×4.6 mm,5 μm),再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,详见表8。结果表明,色谱柱发生一定程度变化时,本方法能满足试验要求,耐用性良好。
2.4.7.2 流速考察
精密称取样品(编号:B8)适量,按“2.2.2”项下方法制备供试品溶液,流速分别设置为0.8、1.0、1.2 mL/min,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,结果见表8。由表8可知,流速发生一定程度变化时,本方法能满足试验要求,耐用性良好。
2.4.7.3 检测波长考察
精密称取样品(编号:B8)适量,按“2.2.2”项下方法制备供试品溶液,检测波长分别设置为285、290、293 nm进样测定,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,详见表8。结果表明,检测波长发生一定程度变化时,本方法能满足试验要求,耐用性良好。
2.4.7.4 柱温考察
精密称取样品(编号:B8)适量,按“2.2.2”项下方法制备供试品溶液,柱温分别设置为20、25、30 ℃,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,详见表8。结果表明,柱温发生一定程度变化时,本方法能满足试验要求,耐用性良好。
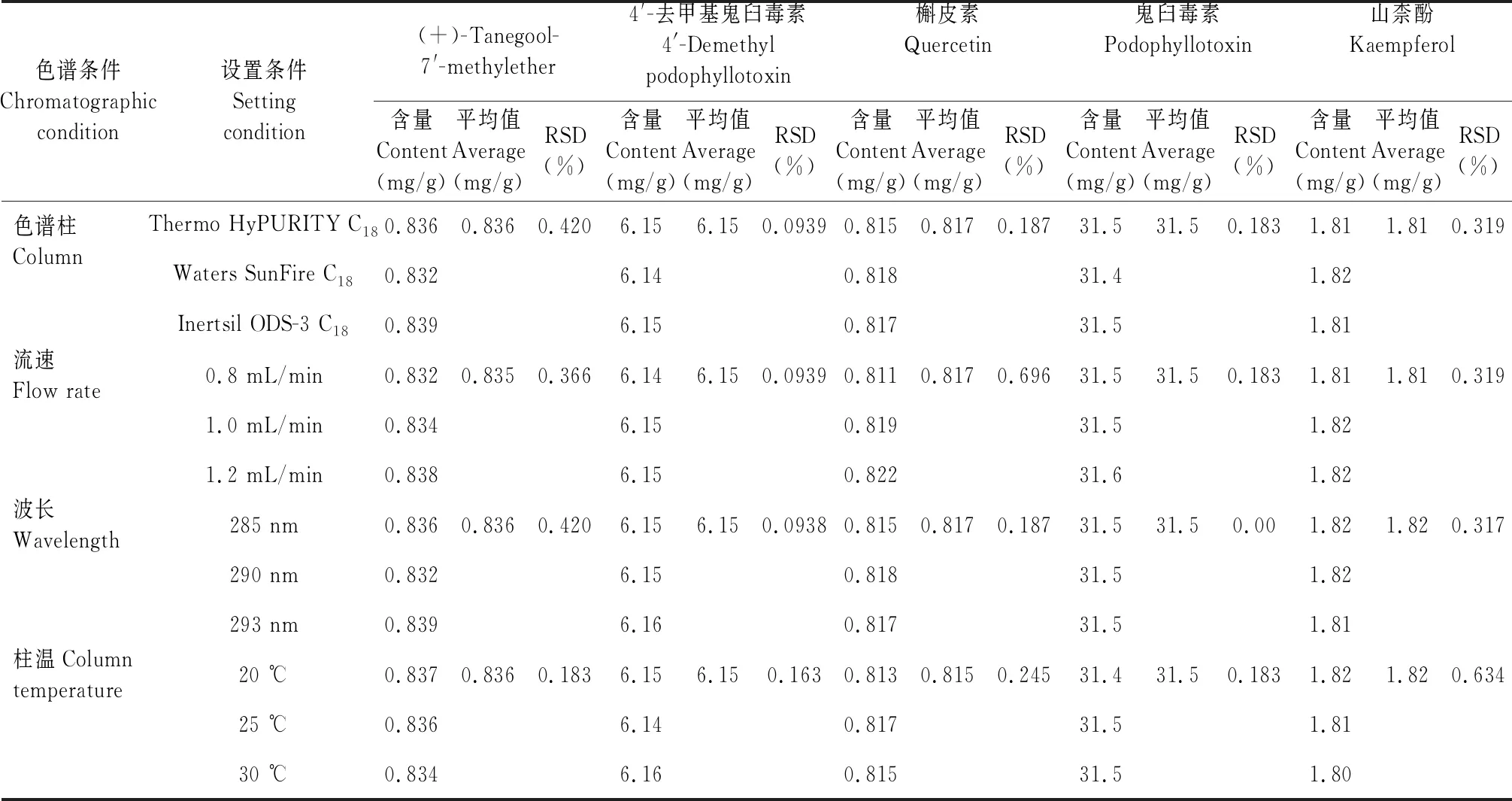
表8 耐用性试验结果Table 8 Results of content determination of samples
3 讨论
本研究对八角莲检测的色谱条件进行了选择及优化,分别考察了甲醇/水、乙腈/水、甲醇/磷酸水、乙腈/磷酸水不同比例洗脱溶剂对HPLC色谱图的影响,结果显示甲醇-0.4%磷酸水为较优溶剂;并结合全波长扫描,结果显示290 nm下色谱峰的数量较多,峰面积较大且分离度较好,故选择290 nm作为检测波长;另对提取方式(回流和超声),提取溶剂(水、乙醇、甲醇)等对实验结果影响进行了考察,发现以甲醇超声(250 W,60 kHz)提取效果最优。该方法简洁方便,易于操作,还可减少对色谱仪的损耗,准确测定八角莲药材中的5个指标成分。
指纹图谱中28个共有峰相对保留时间的RSD值均小于1.0%,表明本文建立的指纹图谱研究方法为一种稳定的共有模式,可以作为八角莲药材品质评价的方法。16批样品相对峰面积RSD值较大,说明各批样品间组分含量差异较大,提示八角莲的品质与其产地密切相关,需对八角莲化学成分进行含量测定,阐明药材品质与产地之间的关系,为临床使用八角莲提供依据。
从相似度分析结果可知,相似度除B10(湖南)、B14(湖北)、B15(湖北)外,其他均在0.9以上,说明不同产地的八角莲药材存在差异,但是其质量具有一致性。同时从聚类分析结果可知,16批八角莲药材聚为两类,区域特征不明显,与相似度分析结果相一致,说明八角莲药材质量稳定。
从含量测定结果可知,不同产地的八角莲药材的主要化学成分有鬼臼毒素、4′-去甲基鬼臼毒素、山柰酚,各个成分含量差异较大,说明不同产地八角莲药材质量差异较大,这可能与药材的生长环境差异和不同采收时期有关,单纯测定1~2种成分的含量不能有效反应药材的质量,需要对八角莲的多种成分同时测定,才能全面的反应其内在质量。
八角莲是我国特有的濒危药用植物,已列入国家三级保护植物,同时也是秦岭“太白七药”中重要的代表药物之一,在民间药用历史悠久,然而其质量标准尚未完整制定。本研究建立了八角莲指纹图谱研究,并对其5种成分进行了含量测定,为今后八角莲质量标准的制定提供一定依据。

