葫芦茶提取物对α-葡萄糖苷酶活性的抑制作用研究
何贝桥,张园园,庄远杯,魏爱红,李榕娣,张声源2,*
1北京中医药大学中药学院,北京 100049;2广东省山区特色农业资源保护与精准利用重点实验室;3嘉应学院医学院客家药用生物资源研究所,梅州 514031
非胰岛素依赖型(2型,T2DM)糖尿病患者占90%以上,由于胰岛素分泌和(或)胰岛素作用缺陷以及蛋白质和脂质代谢紊乱,常出现餐后血糖持续升高症状[1]。持续性高血糖是引起肾病、心血管疾病等并发症的主要原因,有效控制餐后高血糖是预防糖尿病、减少并发症以及降低死亡率的重要措施之一[2,3]。α-葡萄糖苷酶是引起餐后血糖升高的主要酶之一,抑制α-葡萄糖苷酶活性已成为控制餐后高血糖的主要治疗策略[4]。微生物来源的阿卡波糖、伏格列波糖为临床降低餐后血糖的首选药物,但其制备工艺繁琐成本高,合成研究进展缓慢,且长期服药会引发肠胃胀气、腹部不适等不良反应[5]。因此,开发药效好毒副作用低的新型天然α-葡萄糖苷酶抑制剂已成为研究热点[6-8]。
葫芦茶为豆科葫芦茶属植物葫芦茶Tadehagitriquetrum(L.)Ohashi 的全草,别名牛虫草、百劳舌、咸鱼草等,主要分布于广东、广西、海南等地区[9]。葫芦茶始载于《生草药性备要》,味苦、涩,性凉,具有清热解毒,消痰散瘀,消积杀虫等功效,临床上主要用于急性扁桃体炎、风湿关节痛、小儿疳积等疾病[10,11]。现代研究表明,葫芦茶具有抗糖尿病、抗炎、抗氧化、抗菌等药理作用,富含黄酮类、酚类、萜类成分[12]。葫芦茶在梅州客家地区资源丰富,民间药用历史悠久,但一直未得到深入研究与开发。本实验首次评价了葫芦茶各溶剂提取物对α-葡萄糖苷酶的抑制活性,并运用酶动力学探讨了正丁醇萃取物对酶的抑制机制,为进一步综合利用葫芦茶资源提供实验数据。
1 材料
1.1 药材
葫芦茶于2016年8月采自广东省阴那山自然保护区,经嘉应学院医学院药学系聂华副教授鉴定为豆科葫芦茶属植物葫芦茶Tadehagitriquetrum(L.) Ohashi全草,标本存放于嘉应学院医学院客家药用生物资源研究所(编号:20160866)。
1.2 试剂
对-硝基苯基-α-D-吡喃葡萄糖苷(上海源叶科技有限公司,批号MZ1M7E15108,pNPG);阿卡波糖(拜耳公司,德国,批号 BJ31578);α-葡萄糖苷酶(Sigma公司,美国,批号:1002515,EC 3.2.1.2,面包酵母,活性≥10 U/mg) ;甲醇和乙腈(色谱纯,Fisher Scientific公司,美国);无水碳酸钠、磷酸氢二钾、磷酸二氢钾等均为分析纯。
1.3 仪器
Waters Alliance 2695 型高效液相色谱仪(Waters公司,美国);XBridge Peptide BEH C18色谱柱(Waters公司,美国,250 mm × 4.6 mm,5 μm);PHSJ-3F型pH计(上海精科仪器有限公司);BT125D型电子分析天平(Sartorius公司,德国)。
1.4 动物
健康昆明种小鼠80只(♂),由广东省医学实验动物中心提供,生产合格证号:SCXK(粤)2018-0002,体质量18~22 g。实验前饲养于湿度45%~75%、室温25 ℃的动物室内,饲养期间自由饮食,适应性喂养1周后用于实验。本研究得到嘉应学院医学院伦理委员会批准,在整个实验中遵守《实验动物管理条例》,做到减轻小鼠痛苦,增加其舒适度[13]。
2 方法
2.1 葫芦茶不同提取物样品的制备
干燥葫芦茶药材5.0 kg,粉碎,用3倍量95%乙醇超声提取4次,合并提取液,减压浓缩得到95%乙醇浸膏226.4 g,加适量水混悬,依次用石油醚、乙酸乙酯和正丁醇萃取,得到石油醚提取物0.1 g、乙酸乙酯提取物16.6 g、正丁醇提取物102.2 g和水提取物107.2 g。将各提取物放置于4 ℃冷藏,备用。使用磷酸盐缓冲液(PBS,0.067 mol/L、pH6.8)溶解样品并制备成不同质量浓度的溶液(质量浓度均以提取物计)。
2.2 小鼠小肠黏膜α-葡萄糖苷酶的提取
此部分方法参照本实验室之前报道方法[13]。
2.3 α-葡萄糖苷酶抑制活性的测定
将样品(石油醚提取物、乙酸乙酯提取物、正丁醇提取物和水提取物)分别配制成不同质量浓度的样品液,其中石油醚提取物为100、200、300、400、500、600 μg/mL,乙酸乙酯提取物为100、150、250、350、450、500 μg/mL,正丁醇提取物为5、10、15、20、25、30 μg/mL,水提取物为10、20、30、40、50、60 μg/mL。阳性对照品阿卡波糖制备成质量浓度分别为100、150、200、250、500、1 000、2 000、3 000、4 000 μg/mL[13]。参考文献[13,14]方法并作适当调整,采用基于HPLC的pNPG体外评价模型进行检测,具体如下:先将0.067 mol/L pH6.8的磷酸盐缓冲溶液500 μL、待测样品100 μL和0.1 U/mLα-葡萄糖苷酶(酵母来源和小鼠小肠来源)600 μL振荡混匀,37 ℃恒温孵育20 min,再加入4.0 mmol/L pNPG 400 μL,振荡混匀,37 ℃恒温反应30 min后,最后加入200 mmol/L Na2CO3溶液1 600 μL终止反应。经0.45 μm微孔滤膜过滤后,通过HPLC检测对硝基苯酚(pNP)的变化,确定α-葡萄糖苷酶的活性。色谱条件[13]:色谱柱为XBridge Peptide BEH C18柱(4.6 mm×250 mm,5 μm);流动相:A为乙腈,B含0.1%甲酸的水溶液。梯度洗脱条件为:0~8 min,20%→30% A;8~13 min,30%→80% A;13~15 min,80%→20% A;15~25 min,20% A。流速:1.0 mL/min;进样量:10 μL;柱温:35 ℃;检测波长为315 nm。每组实验重复3次,抑制率计算公式[13]如下:
抑制率=[1-(A样品-A样品对照)/A阴性]×100%
式中,A阴性指在相同条件下以等体积磷酸盐缓冲溶液(PBS)代替样品测得的pNP峰面积,A样品对照指在相同条件下以等体积PBS代替α-葡萄糖苷酶测得的pNP峰面积。
葫芦茶不同溶剂提取物和阿卡波糖对酵母来源、小鼠小肠来源α-葡萄糖苷酶抑制活性的结果见图1~3和表1。
2.4 α-葡萄糖苷酶抑制作用的动力学研究
因葫芦茶正丁醇提取物抑制α-葡萄糖苷酶的能力最强,本研究选用葫芦茶正丁醇提取物探究α-葡萄糖苷酶抑制作用的动力学。参考文献[13,15]并做适当调整,具体方法如下:固定pNPG浓度为2.5 mmol/L,在葫芦茶正丁醇提取物质量浓度为0、20、30、40 μg/mL的条件下,测定不同α-葡萄糖苷酶浓度(0.1、0.15、0.2、0.25 U/mL)时的酶促反应初速度作图。横坐标表示酶浓度(U/mL),纵坐标表示反应初速度(μmol/L·min),并利用图的特征推断酶的结合方式。再将pNPG浓度分别稀释成0.125、0.25、0.5、1 mmol/L,固定α-葡萄糖苷酶浓度为0.2 U/mL,依次测定正丁醇提取物(质量浓度为0、20、40 μg/mL,以乙醇提取物计)的反应速率。以底物质量浓度的倒数(1/S)为横坐标和反应速率的倒数(1/V)为纵坐标绘制Lineweaver-Burk曲线,经动力学参数(Vmax、Km)来推断其抑制类型。葫芦茶正丁醇提取物对α-葡萄糖苷酶的抑制类型结果见图4和图5。
2.5 数据统计分析
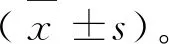
3 结果
3.1 α-葡萄糖苷酶的抑制活性
图1和表1结果显示,阿卡波糖对酵母来源、小鼠小肠来源α-葡萄糖苷酶的抑制活性随质量浓度的增大而增强,并呈量效关系,其IC50分别为5 012.62±18.49、3217.17±7.27 μg/mL。葫芦茶各溶剂提取物抑制酵母来源、小鼠小肠来源α-葡萄糖苷酶的效果均显著优于阿卡波糖,差异具有统计学意义(P<0.05)(表1)。葫芦茶各提取物对酵母来源α-葡萄糖苷酶的抑制活性强弱为正丁醇提取物(IC50= 13.08±1.23 μg/mL)>水提取物(IC50= 33.73±2.21 μg/mL)>乙酸乙酯提取物(IC50= 237.37±3.24 μg/mL)>石油醚提取物(IC50= 253.53±3.42 μg/mL);对小鼠小肠来源酶的抑制活性强弱则为正丁醇提取物(IC50= 221.21±3.75 μg/mL)>水提取物(IC50= 291.91±2.49 μg/mL)>乙酸乙酯提取物(IC50= 352.52±4.78 μg/mL)>石油醚提取物(IC50= 539.39±3.34 μg/mL)(图2、图3)。葫芦茶各提取物对酵母来源、小鼠小肠来源α-葡萄糖苷酶抑制活性强弱一致,且与阳性对照阿卡波糖相比均具有显著性差异(P<0.05)。
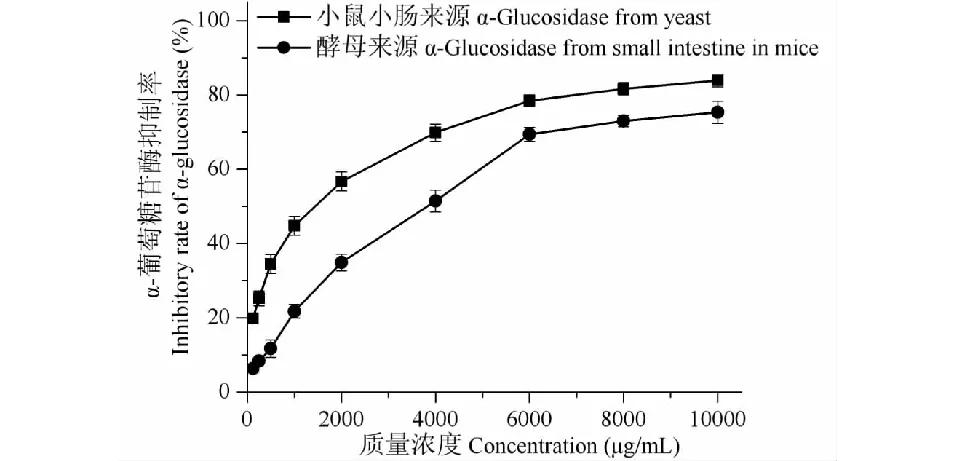
图1 阿卡波糖对α-葡萄糖苷酶的抑制活性Fig.1 α-Glucosidase inhibitory activity of acarbose
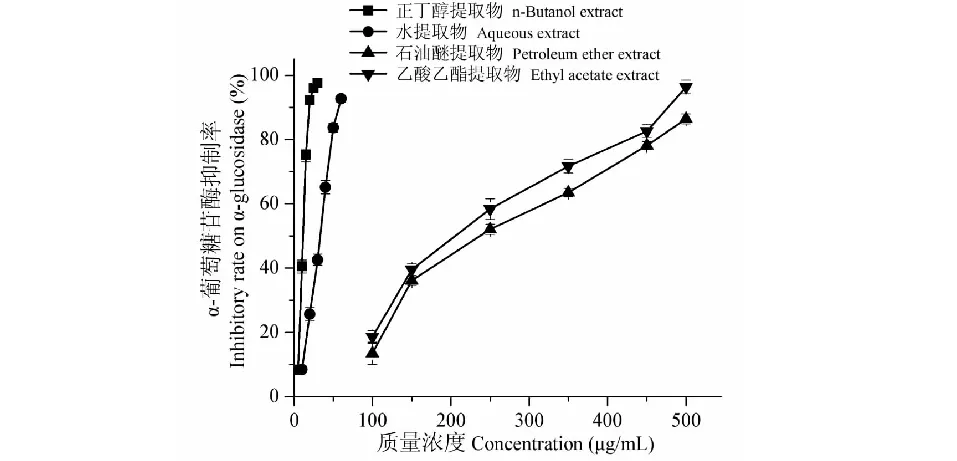
图2 葫芦茶不同溶剂提取物对酵母 源α-葡萄糖苷酶抑制活性Fig.2 Yeast α-glucosidase inhibitory activity of extracts from different solvents of T.triquetrum
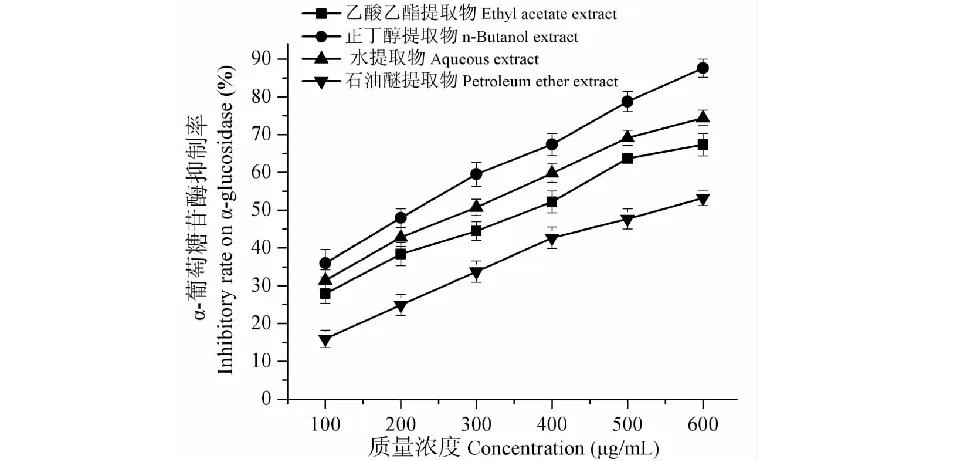
图3 葫芦茶不同溶剂提取物对小鼠小肠 来源α-葡萄糖苷酶抑制活性Fig.3 Mice intestine α-glucosidase inhibitory activity of extracts from different solvents of T.triquetrum
3.2 葫芦茶正丁醇提取物对α-葡萄糖苷酶的抑制机制
结果显示,葫芦茶正丁醇提取物(20、30、40 μg/mL)的酶浓度-反应初速率图是一组近似通过原点的直线,且直线斜率低于未加提取物的直线斜率,由此可推断正丁醇提取物与α-葡萄糖苷酶和(或)酶底物复合物进行可逆性结合(图4)。Lineweaver-Burk双倒数作图为一组相交于纵轴一点的线,Km(0.90、2.41、5.80 mmol/L)随着葫芦茶正丁醇提取物质量浓度(0、20、40 μg/mL)增大而增大,但Vmax(0.028 1 mmol/L/min)保持不变,表明正丁醇提取物对α-葡萄糖苷酶的抑制类型为竞争性抑制(图5)。
表1 葫芦茶提取物和阿卡波糖对α-葡萄糖苷酶抑制作用IC50值比较Table 1 Comparison of extracts and acarbose IC50 values of inhibition on α-glucosidase
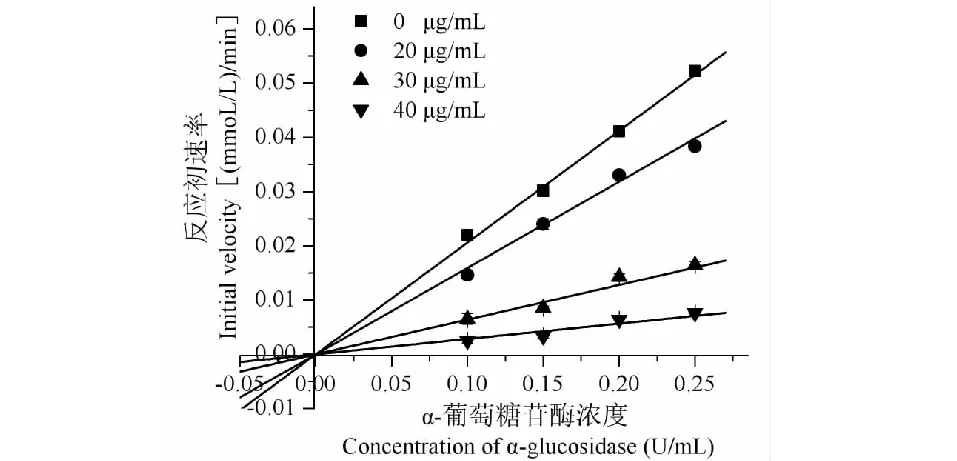
图4 酶浓度-反应初速率图Fig.4 Picture of enzyme concentration-initial velocity
4 讨论
本实验采用基于HPLC的体外α-葡萄糖苷酶抑制活性评价模型比较葫芦茶不同溶剂提取物对小鼠小肠来源、酵母来源α-葡萄糖苷酶抑制活性的差异,综合筛选有效活性提取物并确定其抑制类型。实验结果显示,葫芦茶各溶剂提取物对酵母来源、小鼠小肠来源的α-葡萄糖苷酶均有不同程度的抑制活性且强于阳性对照阿卡波糖(P<0.05)。从整体上看,各提取物对两种来源的α-葡萄糖苷酶抑制作用强弱趋势相同,但抑制酵母来源酶的活性明显强于小鼠小肠来源,可能与小鼠小肠来源的α-葡萄糖苷酶包含蔗糖酶、麦芽糖酶、海藻糖酶和异麦芽糖酶等有关[16,17]。同时,葫芦茶各溶剂提取物中,正丁醇提取物抑制α-葡萄糖苷酶的能力明显优于葫芦茶其他提取物(P<0.05),结果提示葫芦茶中抑制α-葡萄糖苷酶的药效物质主要集中在大极性部位,可能与该部位富含黄酮类、酚类等极性较大的化学成分有关[12]。此外,经葫芦茶正丁醇提取物的酶促动力学研究,发现其能有效地竞争性抑制α-葡萄糖苷酶,研究结果将有利于明确葫芦茶提取物的具体降糖机理。
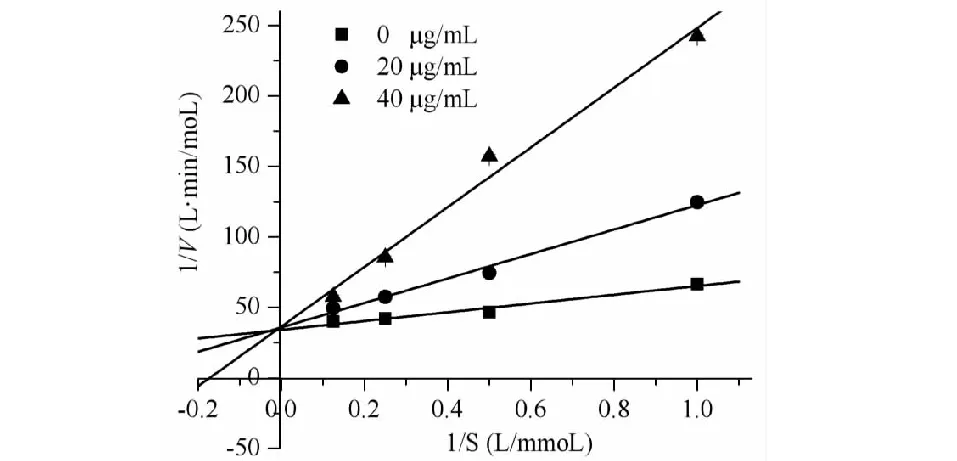
图5 葫芦茶正丁醇提取物的Linweave-Burk双倒数曲线Fig.5 Lineweaver -Burk plot of n-butanol extract from T.triquetrum
本研究证实葫芦茶提取物对α-葡萄糖苷酶有良好的抑制作用,并发现其对α-葡萄糖苷酶的作用机制为竞争性抑制,是天然的α-葡萄糖苷酶抑制剂资源,后续应深入开展葫芦茶特别是极性较大的提取物化学成分研究,并进行体内药效学验证,有望从中发现高效、新型的α-葡萄糖苷酶抑制剂。

