双侧原发性乳腺癌两侧肿瘤病灶的差异性分析
陈学燕 李利亚 万冬桂 李园
乳腺癌是女性恶性肿瘤死亡的主要原因,女性肿瘤患者中乳腺癌的发病比例(46.3%)和死亡比例(13.0%)均最高[1],随着医疗服务的普及和技术水平的提高,乳腺癌患者生存期显著延长,第二原发癌的风险也随之增加,对侧乳腺癌(contralateral breast cancer,CBC)已成为常见的第二原发癌,有报道显示CBC 发病率每年增加0.5%~1.0%[2]。乳腺癌患者罹患对侧乳腺癌的风险是普通人群发生乳腺癌的2~7 倍[3]。本研究通过对双侧原发性乳腺癌(bilateral primary breast cancer,BPBC)患者的临床资料进行回顾性分析,探讨两侧肿瘤病灶的组织病理学差异及临床病理因素在对侧乳腺癌发生中的作用,以期为存在高危因素的单侧乳腺癌患者提供针对性干预和监测的依据。
1 对象和方法
1.1 对象 中日友好医院中西医结合肿瘤科2016 年1月1 日至2018 年12 月31 日收治乳腺癌患者共563 例(多次住院的患者按1 例计算),其中BPBC 患者28 例。BPBC 患者中2 例无法排除对侧转移、1 例拒绝穿刺活检致病理诊断不明确、1 例合并十二指肠内分泌肿瘤且病理资料不完整而剔除,最终纳入24 例,随访至2019年7 月15 日。
1.2 诊断标准
1.2.1 BPBC 鉴别标准 (1)生长部位及浸润性:原发癌灶多呈单发性,多位于外上象限,在乳腺实质呈浸润性生长,转移癌则多呈多发性,多位于乳腺内侧象限或胸正中线或乳腺尾叶的脂肪组织内,呈膨胀性生长;(2)原位癌:可在再发癌灶里找到原位癌成分(可靠证据之一);(3)组织学:双侧癌灶组织病理学不同或细胞核分化程度有明显差异;(4)时间间隔:两侧肿瘤病灶间隔时间在5 年以上,且无局部复发或远处转移证据[4]。
1.2.2 异时性双侧原发性乳腺癌(metachronous bilateral primary breast cancer,MBPBC)和同时性双侧原发性乳腺癌(synchronous bilateral primary breast cancer,SBPBC)的界定 参照文献[5],以24 个月作为分界。
1.2.3 第一原发癌的界定 将SBPBC 中癌灶直径大或分级更高一侧界定为第一原发癌,MBPBC 中早发现的一侧界定为第一原发癌[6]。
1.2.4 免疫组化及分子分型判定标准参照《中国抗癌协会乳腺癌诊治指南与规范(2017 年版)》[7]中的乳腺癌分子分型的标志物检测和判定标准。
1.2.5 随访 24 例患者均通过电话随访,将第二原发癌病理确诊的时间作为随访起始时间,观察总生存期(overall survival,OS),随访截止日期为2019 年7 月15 日。
1.3 统计学处理 应用SPSS 20.0 统计软件,符合正态分布的计量资料以表示,组间比较采用t检验;计数资料组间比较采用Fisher 确切概率法;两侧肿瘤病灶免疫组化受体的一致性检验采用Kappa 检验;采用Kaplan-Meier 法绘制生存曲线并计算累积存活率。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基本信息
2.1.1 BMI 24 例BPBC 患者中SBPBC 6 例(25%),MBPBC 18 例(75%)。BMI<18.5kg/m2(偏瘦)1 例、18.5~23.9kg/m2(正常)10 例、≥24kg/m2(偏胖)13 例,平均BMI(24.43±3.87)kg/m2。依据BMI 水平,将563 例患者分为偏胖(BMI≥24kg/m2)和不胖(BMI<23.9kg/m2)两组,偏胖组患者BPBC 发病率(4.33%,13/300)高于不胖组(4.18%,11/263),差异有统计学意义(P=0.001)。
2.1.2 发病年龄 24 例BPBC 患者第一原发癌的发病年龄34~73 岁,中位发病年龄48 岁,平均发病年龄(50.42±10.91)岁。MBPBC 患者第一原发癌的发病年龄34~66 岁,中位发病年龄47.5 岁,平均发病年龄(48.44±9.49)岁;SBPBC 患者首发癌的发病年龄46~73 岁,中位发病年龄52.5 岁,平均发病年龄(56.33±13.62)岁。MBPBC 患者第一原发癌的平均发病年龄早于SBPBC患者首发癌的平均发病年龄,但差异无统计学意义(P=0.187)。
2.1.3 两侧病灶发病间隔时间 24 例BPBC 患者总体发病间隔时间为0~18 年,中位发病间隔6.5 年,平均发病间隔时间为(7.15±5.59)年。MBPBC 发病间隔3~18 年,中位发病间隔9 年,平均发病间隔时间为(9.44±4.45)年。<24 个月界定为SBPBC。SBPBC 患者除1 例(间隔1.5 年)外均为同时发现,且两侧均伴有不同程度转移,两侧病灶平均发病间隔时间为(0.25±0.61)年,MBPBC 和SBPBC 两侧病灶发病间隔差异有统计学意义(P=0.001)。
2.2 肿瘤病灶的临床病理特征 24 例患者中,第二原发癌初诊时的临床分期以0~Ⅱ期居多(58.33%),比第一原发癌/首发癌的临床分期早,但差异无统计学意义(P>0.05)。两侧癌灶均以雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)阳性,而人类表皮生长因子受体-2(human epidermalgrowth factor receptor-2,HER-2)阴性多见,差异无统计学意义(P>0.05),两侧癌灶ER、PR 受体表达一致性较差(Kappa<0.4),HER-2 表达存在一致性,且一致性较好(Kappa>0.75,P<0.05)。两侧癌灶均以浸润性导管癌为主,差异无统计学意义(P>0.05)。两侧癌灶分子分型比较差异无统计学意义(P>0.05),均以Luminal 型为主,且以LuminalB 型多见,见表1、2。
2.3 临床治疗情况
2.3.1 SBPBC 6 例SBPBC 患者,由于肿瘤分期较晚,故未行手术治疗,5 例行以化疗和内分泌治疗为主的全身解救性治疗,另1 例患者拒绝放化疗,而仅行内分泌姑息治疗,与单侧晚期乳腺癌的治疗并无差别。晚期乳腺癌解救性全身治疗临床指南原则:(1)晚期乳腺癌包括复发和转移性乳腺癌,是不可治愈的疾病。(2)治疗的主要目的是缓解症状、提高生活质量和延长患者生存期;(3)应尽可能在决定治疗方案前对复发或转移部位进行活检,尤其是孤立性病灶,以明确诊断;(4)重新评估肿瘤的ER、PR 和HER-2 状态;(5)局部治疗,如手术和放疗在初治为Ⅳ期乳腺癌中的价值还不明确;(6)只有当全身药物治疗取得很好的疗效时,才可考虑姑息性的局部治疗,以巩固全身治疗的效果。
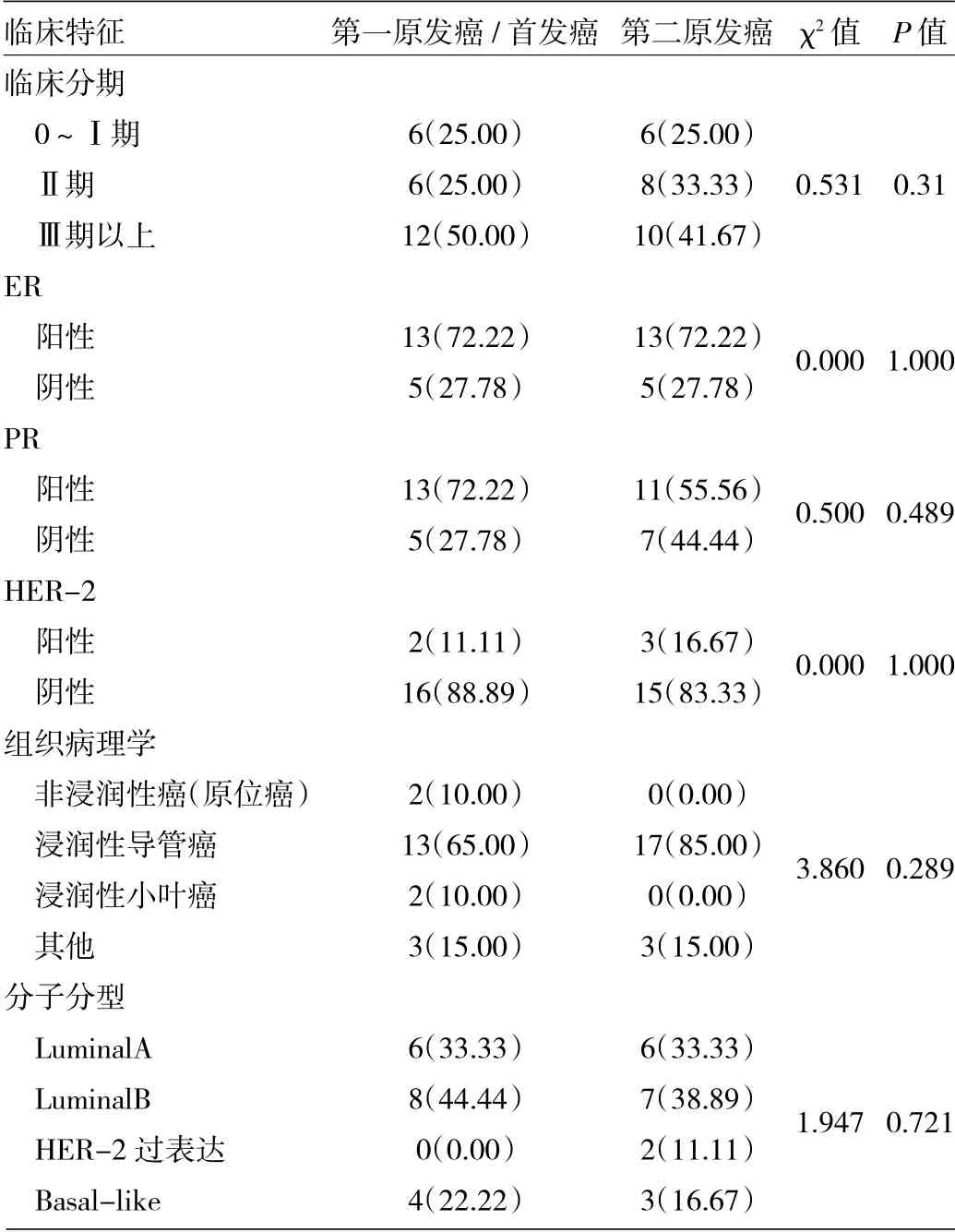
表124 例BPBC 患者肿瘤病灶的临床特征[例(%)]
2.3.2 MBPBC 18 例MBPBC 患者第一原发癌均行根治性手术切除,术后8 例接受内分泌治疗,10 例未行内分泌治疗的患者中4 例激素受体阴性,4 例激素受体状态不详,1 例为原位癌,另1 例激素受体阳体但拒绝内分泌药物治疗;第二原发癌15 例行根治切除术,10 例激素受体阳性的患者均接受内分泌治疗(其中2 例HER-2 受体阳性的患者均行曲妥珠单抗靶向治疗),另7 例未行内分泌治疗。
2.4 患者生存分析 24 例患者中失访1 例,随访率95.83%。BPBC 患者平均生存时间估计值为5.12 年;SBPBC 患者1 例尚存活,另外5 例OS 分别为2、2.5、1.4、7.3 和2.8 年,平均生存时间估计值3.22 年;MBPBC患者13 例尚存活,1 例失访,4 例死亡,平均生存时间估计值5.99 年。MBPBC 患者生存期长于SBPBC 患者,差异有统计学意义(P<0.05),见图1。
3 讨论
乳腺癌大多表现为浸润性癌,目前尚无十分明确的标准去界定双侧乳腺癌是原发还是转移。综合Robbins和Berg 于1964 年拟定的鉴别标准并结合后来研究,将BPBC 的鉴别标准作了归纳。关于SBPBC 和MBPBC 的界定,目前国内外尚无统一明确的标准,多以6 个月为分界,但有学者认为,乳腺癌细胞克隆增殖周期长,由一个癌细胞增殖到可探查的体积至少需要1 年,以6 个月为分界划分SBPBC 和MBPBC 不符合癌细胞生物学特性。
双侧乳腺所处内分泌和暴露环境大致相同,对单侧乳腺起作用的致癌因素也可能刺激另一侧乳腺癌变导致BPBC,同理,影响单侧乳腺癌预后的因素对双侧乳腺癌的预后也有重要影响。临床上统计的双侧乳癌占同期全部乳腺癌的2%~11%[8]。本研究乳腺癌人群的BPBC 发病率为4.26%,与报道相符。除了1 例患者两侧肿瘤病灶间隔1.5 年相继确诊,其余均为同时发现,而且发现时即伴有淋巴结或远处转移,在判断属于原发性癌还是转移性癌仍存疑,但肿瘤穿刺病理提示有原位癌成分,或组织病理学有差异,故考虑为BPBC 可能性大。本研究共统计了24 例BPBC,其中SBPBC 患者18例,MBPBC 患者6 例,临床上关于MBPBC 与SBPBC的界定仍有争议,王昊天等[5]利用二元logistics 回归的方法探究与BPBC 发病间隔相关的因素,并筛选划分SBPBC 和MBPBC 最准确的时间界点,最终得出以24个月为划分标准最为合理,本研究参考此建议,以24个月作为界点。

表224 例BPBC 患者两侧肿瘤病灶免疫组化表达一致性检验
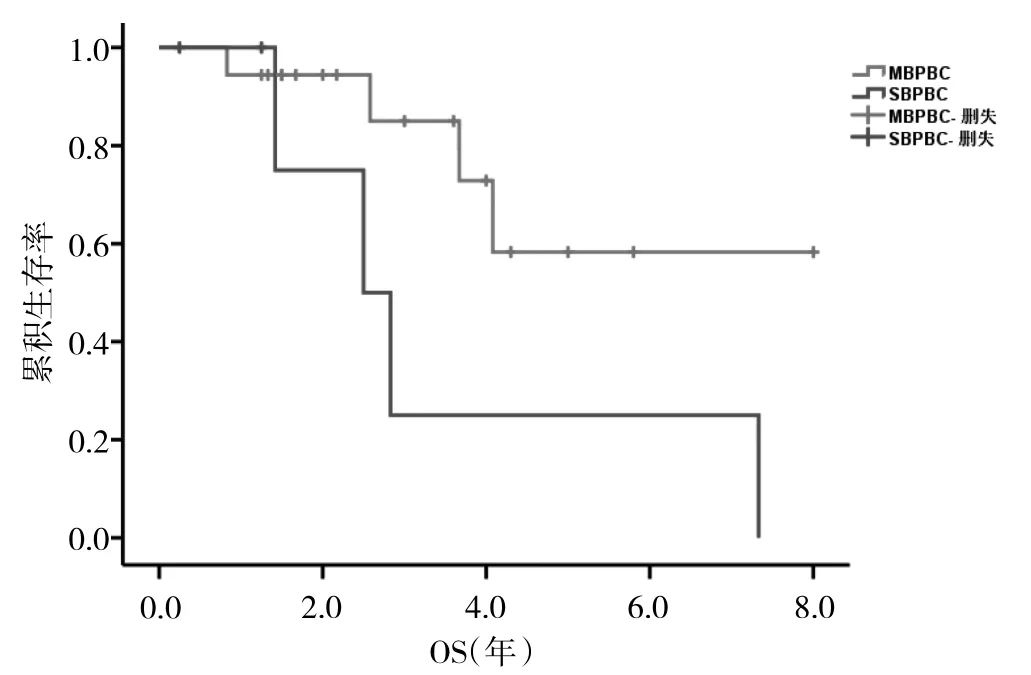
图1 SBPBC 和MBPBC 患者的生存曲线
本研究中MBPBC 第一原发癌的平均发病年龄为(48.44±9.49)岁,SBPBC 第一原发癌的平均发病年龄为(56.33±13.62)岁。国内外大多数研究显示,BPBC 患者第一原发癌的发病年龄较单侧乳腺癌患者早10年左右[9]。Narod 等[10]对瑞典78775 例乳腺癌患者进行的研究显示,乳腺癌患者中首次发病年龄<50 岁的患者发生对侧乳癌的风险明显高于50 岁以后发病的患者。Shankar 等[6]对532 例乳腺癌患者进行年龄分组,发现20~40 岁年龄组患者对侧罹患乳腺癌的发病率为83.3%(P=0.006)。足以说明发病年龄是一个很重要的影响因素,对于绝经前罹患乳腺癌的患者需要加强对侧乳腺的监测。另外本研究总的平均发病间隔(7.15±5.59)年;MBPBC 平均发病间隔(9.44±4.45)年,MBPBC 患者罹患对侧乳腺癌的时间与单侧乳癌容易复发转移的时间接近,所以在第一原发癌灶发现的5~10 年内应该加强对侧乳腺的监测并排除复发转移的可能。
本研究中54.17%的患者BMI≥24kg/m2,具有更高的BPBC 发病率。BMI 是一个评估体脂指数的指标,可以在一定程度反映肥胖程度。肥胖往往伴随着血脂、血压、血糖代谢的紊乱,血脂代谢异常会导致雌激素抵抗而分泌过多,从而刺激乳腺细胞异常增殖。提示偏胖的乳腺癌患者需要加强体重控制,并做好对侧乳腺的监测。
临床特征方面,大多研究表明第二原发癌的临床分期较第一原发癌早[6],主要与乳癌患者对侧乳腺监测的加强有关。本研究也显示第二原发癌初诊时的临床分期比第一原发癌早,以0~Ⅱ期居多(58.33%),但差异无统计学意义,与部分患者第二原发癌发现或就诊时间较晚有关。ER、PR、HER-2 受体是乳腺癌患者治疗和预后重要的免疫组化生物标志,对病理类型相同的BPBC 患者,受体的表达状态也是判断两侧肿瘤异质性的参考标志。本研究显示,两侧肿瘤病灶均以浸润性导管癌为主要病理类型,ER 阳性、PR 阳性、HER-2 阴性多见,两侧肿瘤病灶ER、PR 表达及分子分型一致性较差(Kappa<0.4)提示BPBC 患者两侧肿瘤病灶之间具有独立性和异质性。HER-2 过表达是影响乳腺癌预后的不良因素之一,刘志英等[11]报道HER-2 过表达在BPBC 的浸润性癌中较单侧乳腺癌显著。但本研究两侧肿瘤病灶均以HER-2 阴性多见,可能与病例数较少或免疫组化资料缺失有关。这些标志物是预测预后的因素,两侧癌灶受体表达有差异性,则对内分泌治疗的反应也各不相同,其中ER 阳性/PR 阳性肿瘤的反应率最佳,ER 阳性/PR 阴性和ER 阴性/PR 阳性肿瘤的反应率较低[12],建议对BPBC患者分别检测两侧肿瘤病灶的ER、PR 和HER-2 表达状态。
治疗方面,BPBC 患者的治疗与单侧乳腺癌的治疗无明显差异,每一侧肿瘤均应按照独立的肿瘤病灶进行最大限度的根治性治疗。内科治疗需要兼顾两侧肿瘤病灶且不能对患者总体治疗效果产生负面影响,辅助治疗通常比较复杂,治疗方案取决于侵袭性更强的一侧肿瘤[13]。当任何一侧乳腺癌ER 阳性时,均适用于内分泌治疗。大多研究表明一侧癌灶进行内分泌及化疗能够降低第二原发癌的发生率,但也不能忽视这些辅助治疗手段的远期致癌作用,需要加强全身监测,避免第二原发恶性肿瘤的产生。
生存期和预后方面,在生存期和预后方面,MBPBC患者的生存及预后较SBPBC 患者佳。Meta 分析结果显示,SBPBC 患者组1、5、10 年生存率均明显低于MBPBC患者[14]。考虑与SBPBC 患者肿瘤负荷较大、发现就诊时间较晚及两侧肿瘤的异质性表达有关。
综上所述,BPBC 两侧肿瘤病灶在免疫组化表达、分子分型、临床分期方面具有差异性,第一原发癌发病早、偏胖是BPBC 发病的重要预测因素,在第一原发癌灶发病后的5~10 年容易罹患对侧乳腺癌。在治疗方面BPBC 患者的治疗与单侧乳腺癌的治疗无明显差异,每一侧肿瘤均应按照独立的肿瘤病灶进行最大限度的根治性治疗。

