两性霉素B在体外对血清钾测定结果影响的实验观察
王 麟,胡 鹏,成景松
(1.成都市郫都区中医医院检验科,成都 611730;2.安康市白河县人民医院检验科,陕西安康 725800)
两性霉素B(amphotericin B)属多烯类抗真菌药物,适用于敏感真菌所致的深部感染[1],如败血症、心内膜炎、脑膜炎(隐球菌及其他真菌)、腹腔感染(包括与透析相关者)、肺部感染、尿路感染和眼内炎等。但该产品毒性大,易造成体内血清钾浓度的改变、肾损伤等不良反应,它是目前治疗危重深部真菌感染的首选药物[2],在治疗期间临床上要随时了解患者血清钾浓度及肾功能等检测指标。由于检验前周转时间的不同,造成体内血清钾浓度的假性变化,给临床诊治带来困难。本文通过体外实验评估在应用两性霉素B药物时不同的检验前周转时间对血清钾测定的影响,旨在给临床提供一个准确的检验结果,为临床监测患者血清钾浓度提供客观的实验室依据。
1 材料与方法
1.1 研究对象 收集2017年12月~2019年3月白河县人民医院检验科无疾患的健康体检者180例,其中男性100例,女性80例,年龄23~56岁。本实验已获得患者知情同意并经本院伦理委员会批准。
1.2 仪器与试剂 注射用两性霉素B干粉由华北制药股份有限公司提供,25mg/瓶,商品名“欧泊”,批号FDLD170201;真空采血管由浏阳市三力医用科技发展有限公司提供;500E电解质分析仪及其配套的试剂、校准物、质控品由广东梅州康立高科技有限公司提供。
1.3 方法
1.3.1 按药品说明书每瓶两性霉素B先加入1ml注射用水溶解,然后吸取0.1ml两性霉素B溶解液用l5g/dl葡萄糖注射液9.9ml配制成2.5mg/L的药液。
1.3.2 在肝素钠采血管(绿头管)和促凝剂采血管(红头管)中各加入含5g/dl葡萄糖注射液20μl作为对照管,用先前配好的2.5mg/L两性霉素B药液取20μl分别加入到肝素钠采血管(绿头管)和促凝剂采血管(红头管)中作为试验管。
1.3.3 采集每位体检志愿者静脉血液16ml,立即分配给含5g/dl葡萄糖注射液和含0.25mg/ml两性霉素B的对照管和实验管中,每管2ml静脉血各4份共8管,并充分混匀,用含0.25mg/ml两性霉素B的静脉血采血管作为试验组,含5g/dl葡萄糖注射液的静脉血采血管作为对照组。本实验随机分配180例志愿者,其中100例采集的静脉血用于肝素钠采血管,80例用于促凝剂采血管。
1.3.4 每日检测标本前,用仪器原装质控品做质控,保证仪器相关监测指标在控的前提下完成标本检测。将对照组和实验组的血液标本两两配对分别在采集30,60,90和120min后3 000r/min 离心 10min,立即测定各管血清钾浓度。每管重复检测2次取平均值为检测值。
1.4 统计学分析 采用SPSS19.0统计学软件进行数据分析。计量资料结果以均数±标准差(±s)表示。同一分离时间血清钾水平采用两配对样本t检验,不同分离时间组内血清钾水平比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 实验组与对照组不同血凝管在不同分离时间的血清钾浓度比较 见表1及表2。含两种不同抗凝剂的采血管在加入静脉血放置30min后血清钾浓度比较显示:试验组与对照组差异无统计学意义(t=-0.74,-1.43,P>0.05),但是随着分离时间的延长,试验组的血清钾浓度明显升高,与对照组相比差异均有统计学意义(t=-42.01~-3.38,P<0.05)。
表1 肝素钠管实验组与对照组不同分离时间的血清钾浓度比较(±s,mmol/L)
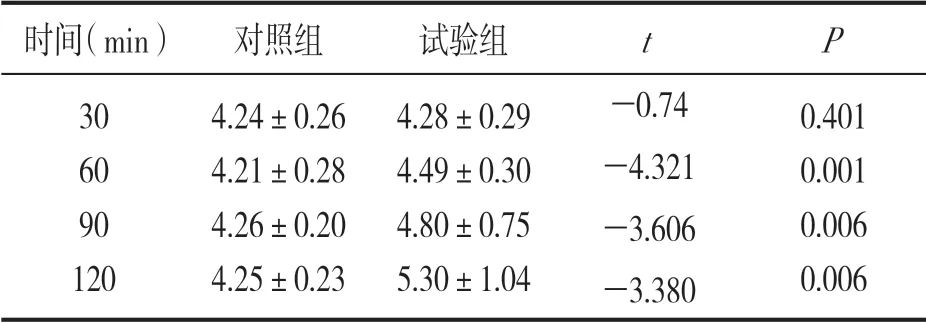
表1 肝素钠管实验组与对照组不同分离时间的血清钾浓度比较(±s,mmol/L)
时间(min) 对照组 试验组 t P 30 60 90 120 4.24±0.26 4.21±0.28 4.26±0.20 4.25±0.23 4.28±0.29 4.49±0.30 4.80±0.75 5.30±1.04-0.74-4.321-3.606-3.380 0.401 0.001 0.006 0.006
表2 促凝剂管实验组与对照组不同分离时间的血清钾浓度比较(±s,mmol/L)

表2 促凝剂管实验组与对照组不同分离时间的血清钾浓度比较(±s,mmol/L)
时间(min) 对照组 实验组 t P 30 60 90 120 4.35±0.20 4.36±0.25 4.34±0.27 4.37±0.22 4.39±0.22 4.87±0.50 5.26±0.31 5.69±0.21-1.43-3.78-23.97-42.01 0.203 0.020 0.001 0.001
2.2 实验组与对照组各组内不同血凝管在不同分离时间的血清钾浓度比较 见表3。对照组内不同分离时间血清钾浓度差异无统计学意义(F=0.008~0.204,均P>0.05),而实验组内血清钾浓度随着时间的延长明显升高,差异具有统计学意义(F=6.787~21.67,均P<0.001)。
表3 实验组与对照组各组内不同抗凝管在不同分离时间血清钾浓度比较(±s,mmol/L)
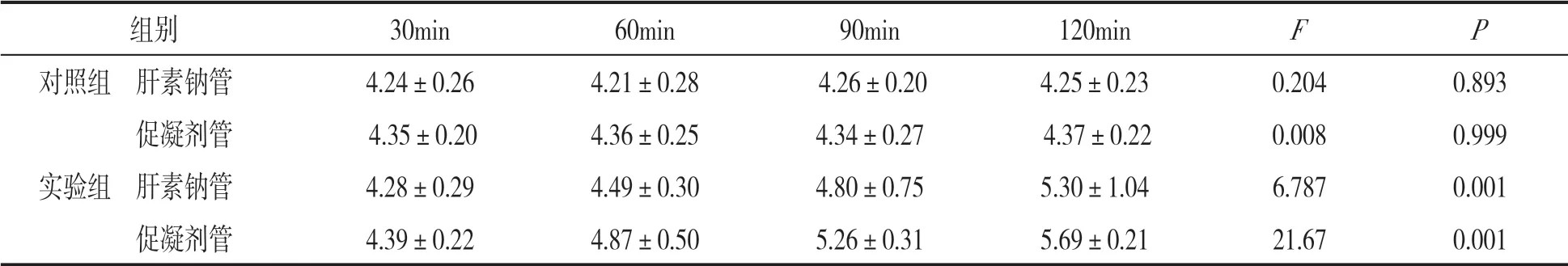
表3 实验组与对照组各组内不同抗凝管在不同分离时间血清钾浓度比较(±s,mmol/L)
组别 30min 60min 90min 120min F P对照组 肝素钠管 4.24±0.26 4.21±0.28 4.26±0.20 4.25±0.23 0.204 0.893 促凝剂管 4.35±0.20 4.36±0.25 4.34±0.27 4.37±0.22 0.008 0.999实验组 肝素钠管 4.28±0.29 4.49±0.30 4.80±0.75 5.30±1.04 6.787 0.001 促凝剂管 4.39±0.22 4.87±0.50 5.26±0.31 5.69±0.21 21.67 0.001
3 讨论
临床检验医学实验室的质量控制包括分析前、分析中和分析后,特别是分析前的影响因素占整个检验质量的65%~80%[3]。分析前的影响因素包括标本的采集、运输、检验前的周转时间等环节。从卫计委临床检验中心2015年血清钾检验前周转时间调查结果看不同医院有不同周转时间[4],有小于30 min的,也有超过180 min的。而临床在应用两性霉素B药物治疗时发现不同的检验前周转时间对血清钾浓度的准确性造成影响,离体后静脉血的血清钾浓度受溶血、EDTA-K2污染、采血时的温控及采血后的周转时间等因素的干扰。这些因素会导致临床医生在应用两性霉素B药物治疗时对患者血清钾浓度的错误判断,给诊治带来困难,严重威胁患者的医疗安全。本研究用体外模拟体内常规剂量下使用两性霉素B后,当血药峰浓度达到2.5mg/L(与实验组内各抗凝管浓度一致)时观察血清钾随周转时间的变化,从表1及表2中观察到:实验组与对照组不同血凝管在不同分离时间的血清钾浓度在放置30min内试验组与对照组差异无统计学意义(P>0.05),在分离时间≥60min以上时,血清钾浓度明显增高,差异有统计学意义(P<0.05)。对各组内不同血凝管在不同分离时间的血清钾浓度比较显示:实验组内血清钾浓度随着时间的延长明显升高,差异具有统计学意义(P<0.001),而对照组内差异无统计学意义(P>0.05)。由此可见,检验前周转时间的延长能引起血清钾假性升高。其原因可能为两性霉素B抗真菌的作用是通过与真菌细胞膜上的麦角甾醇结合,改变真菌细胞壁的通透性而发挥作用[5],其优先与真菌细胞壁发生结合,引起真菌死亡,它也可与哺乳动物细胞中的胆固醇相结合引起同样的损伤[6]。而红细胞膜的胆固醇含量在脂类中占比达22%,因此,两性霉素B在血液中同样也能改变人类红细胞膜的通透性。由于人体内98%的钾离子存在于细胞内,血液离体后在两性霉素B的作用下红细胞内K+缓慢漏出到血浆或血清中,导致血浆或血清钾假性升高。这与刘晓东等[7]报道临床在应用两性霉素B药物治疗后,在血药峰浓度时采血时,随着血液标本周转时间的延长会导致血清钾浓度假性增高相一致。本实验考虑到两性霉素B药物副作用较大,主要是应用于危重深部真菌感染治疗,因此,未进行充分的临床对比试验,如果做临床对比试验还需要联合多中心开展进一步研究。
在实际工作中,临床医生在应用两性霉素B药物治疗时患者体内常引起血清钾浓度的改变。主要见于低钾血症[8],其机制为在体内两性霉素B可以引起细胞膜通透性的改变使胞内钾离子丢失,但由于有细胞内Na+,K+-ATP活性酶,使血液内红细胞外血钾浓度不会升高太多。同时两性霉素B通过多种机制引起肾血管收缩、损伤肾小球及肾小管,最终导致肾脏损害[9]。出现肾小管酸中毒,而肾小管酸中毒使钾离子的排泄增多,尿中排出大量钾离子,从而引起低钾血症,它的发生率为75%~90%[10]。
综上所述,与患者症状和体征不相符合的假性高血钾,容易误导临床,威胁医疗安全,因此临床上在应用两性霉素B药物治疗时监测血清钾除了要错开血药峰浓度采血,还要在采集标本后30 min内分离血清或血浆立即测定,才能给临床提供一个准确的检验结果,为临床监测血清钾浓度提供科学、客观的实验室依据。

