多发性骨髓瘤治疗后继发骨髓增生异常综合征一例
郭淑萍 金鑫 陈志炉 蒋慧芳
作者单位:310012 浙江省立同德医院
多发性骨髓瘤(multiple myeloma,MM)是浆细胞的恶性增殖性疾病,其特征为骨髓中克隆性浆细胞异常增生,分泌单克隆免疫球蛋白或其片段(M 蛋白),并导致相关器官或组织损伤。骨髓增生异常综合征(myelodysplastic syndromes,MDS)是一组获得性造血水平的克隆性疾病,临床表现异质性,以难治性贫血伴白细胞减少和(或)血小板减少,骨髓增生正常或亢进伴病态造血,在疾病进展过程中易发生急性白血病转变。临床研究显示,MM 患者髓系肿瘤概率明显高于普通人群,并与MM 治疗相关。作者收治1 例MM 治疗后继发MDS,MDS 后又转化为急性白血病的患者,并复习相关文献,现报道如下。
1 临床资料
患者,男性,59 岁,于2011 年7 月初因骑车颠簸后出现腰背疼痛,未予重视及治疗,其后在行走过程中突感腰背部剧烈疼痛,活动受限,经腰椎X 线检查示L1、L2 椎体骨折,为进一步治疗,来本院入住骨科,查血常规:白细胞计数5.0×109/L,血红蛋白112g/L,血小板计数205×109/L。免疫球蛋白+补体:轻连Kappa 0.63g/L,轻连Lamda 59.50g/L,免疫球蛋白G 39.4g/L,免疫球蛋白A 0.36g/L,免疫球蛋白M 0.20g/L。为进一步诊治,请血液科会诊,考虑血液系统疾病,转入本科,行骨髓穿刺术,骨髓涂片示浆细胞系统增生极度活跃,占64%,并可见形态异常的幼稚浆细胞;诊断为多发性骨髓瘤(IgG-Lamda 型,DS 分期II 期,A 型)于2011-7-12 开始行CAD 方案(环磷酰胺+阿霉素+地塞米松)化疗2 个疗程。
患者2011-9-13 复查骨髓提示:浆细胞样瘤细胞23%,于2011-09-17 开始硼替佐米+CMD(环磷酰胺+米托蒽醌+地塞米松)方案化疗。患者因无法耐受硼替佐米副作用,后 分 别 于2011-10-18、2011-11-25、2011-12-27、2012-02-02、2012-03-16、2012-05-18 行DTPACE(吡柔比星+顺铂+环磷酰胺+地塞米松+依托泊苷)+沙利度胺方案化疗6 个疗程。期间患者2012 年2 月化疗前复查骨髓浆细胞<5%。治疗后患者骨折好转,可正常行走活动及从事适当体力活动。患者于2012-7-20、2012-10-18、2013-01-05、2013-04-10、2013-7-17、2013-10-16 行 VCMD(长春地辛+环磷酰胺+米托蒽醌+地塞米松)方案化疗5 个疗程。治疗后患者病情好转,故延缓至3 月化疗1 次巩固。患者于2014-01-09、2014-04-14 行CVAD 方案(环磷酰胺+长春地辛+吡柔比星+地塞米松)化疗,复查骨髓缓解。之后患者分别于2014-07-16、2014-10-17、2015-01-21、2015-04-15、2015-07-14、2015-10-13、2016-01-12行CVAD+CCNU(环磷酰胺+长春地辛+吡柔比星+地塞米松+司莫司汀)方案化疗6 个疗程,期间2014-10 复查骨髓:成熟浆细胞2%,每次化疗前复查免疫球蛋白正常范围。患者2016-04-20 行VMD(长春地辛+米托蒽醌+地塞米松)化疗,2016-07-19 再次行CVAD 方案化疗,并复查骨髓:涂片可见成熟浆细胞1%。2016-10-25 患者再次行 VCMD+CCNU 方案化疗,2017-02-22、2017-06-20、2017-11-08 再次行CVAD+CCNU+万珂方案化疗3 个疗程。
患者2018-01-08 因再次腰痛入院。入院查血常规:白细胞计数1.6×109/L,中性粒细胞(%)54.1%,血红蛋白 111g/L,血小板计数 193×109/L。免疫球蛋白+补体:免疫球蛋白A 0.70g/L,免疫球蛋白M 0.17g/L,轻连Kappa 5.23g/L。患者2018-01-09 行骨髓穿刺术,骨髓涂片(见图1):(1)涂片原始细胞比例明显增高,单核细胞系统异常增生;(2)MM 复查。骨髓免疫分型:(1)髓系原始细胞比例增高,表型异常;单核细胞比例明显增高,表型成熟为主,部分偏幼稚,综合鉴别MDS/M5b;(2)检出单克隆浆细胞,占0.70%,单克隆/多克隆浆细胞=2.6。骨髓染色体:44,XY,add(13)(p11.2),-17,-21[2]/44,idem,inv(1)(p21q31)[10]/ 46,XY[7]。骨髓FISH:约56%的细胞丢失一条17 号染色体。患者更改诊断为MM(IgG-lamda 型,DS 分期II 期,A 型)治疗相关MDS-RAEB-II(IPSS 评分2.5 分,高危组),于2018-01-13 给予地西他滨33mg d1-5 化疗,过程顺利。患者2018-02-22 再次行地西他滨33mg d1-5+高三尖杉酯碱(HOM)2mg d4-8+阿糖胞苷(Ara-C)25mg q12h d4-8 方案化疗。患者2018-04-10 复查骨髓,骨髓涂片(见图2):结论:涂片单核细胞系统异常增生,考虑治疗相关血液肿瘤;MM(复查)。骨髓免疫分型(见图3):CD45 设门中检测出单克隆浆细胞占0.71%。检测出异常髓系原始细胞占6.95%,并出现明显单核细胞分化,检测出幼稚到成熟单核细胞占51.1%,首先考虑急性髓系白血病(AML-M5b)。患者更改诊断诊断:(1)AML-M5b(MDS 转化);(2)MM(IgG-lamda 型,DS 分期II 期,A 型)。排除禁忌后,患者于2018-04-06 行地西他滨+IA 方案:地西他滨25mg d1-5+伊达比星5mg d4,6,8+阿糖胞苷15mg q12h d4-8 化疗,过程顺利。2018-05-15 复查骨髓常规提示(见图4):原始幼稚单核细胞58%,成熟单核细胞18%,考虑急性髓系白血病M5b。骨髓免疫分型:CD45 设门中检出异常髓系原始细胞,占13.94%,并伴有明显单核细胞分化,检出幼稚到成熟单核细胞占54.56%,考虑AML-M5b。患者于2018-05-23 行HAA 方案:HOM 2mg d1-7+阿克拉霉素(Acla)20mg d1-5+Ara-C 75mg q12h d1-7 化疗,过程顺利。2018-5-30 患者全基因组芯片结果:有14 组染色体异常,8 处嵌合型缺失(LossMosaic(2,4,6,7,12,16,18))、4 处嵌合型扩增(GainMosaic(1q、8、9、190),1 处复杂异常(21q)。2018-6-26 地西他滨+HAA方案化疗。2018-7-21 患者行克拉曲滨10mg d1,d3+阿糖胞苷0.5g d1-5+重组人粒细胞刺激因子150μg d2-5。患者2018-8-16 复查骨髓:原始幼稚单核细胞占52%,于2018-8-21 开始地西他滨25mg 治疗,化疗当日反复高热,病情危重,暂停次日化疗。患者为MM 治疗相关的MDS 转AML,总体预后不佳,治疗效果差,于2018-8-23 自动出院,出院后当日死于家中。
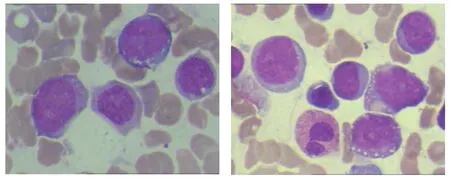
图1 患者2018-01-09骨髓涂片:骨髓增生明显活跃,可见部分核仁明显的原始细胞约占8%;另见部分幼稚细胞形态似该类原始细胞分化,约10%,考虑幼稚细胞不到成熟单核细胞;涂片成熟单核细胞比例增高,占25%。涂片偶见浆细胞,占1%。

图2 患者2018-04-10骨髓涂片:骨髓增生欠活跃,有核细胞量减少。可见部分核仁明显的原始细胞约占7%,胞体大染色质疏松颗粒状,胞浆丰富着色淡蓝,部分可见空泡(暂考虑单核来源);另可见部分幼稚细胞形态似该类原始细胞分化,占11%,考虑幼稚到不成熟单核细胞;涂片成熟单核细胞比例增高,占29%。
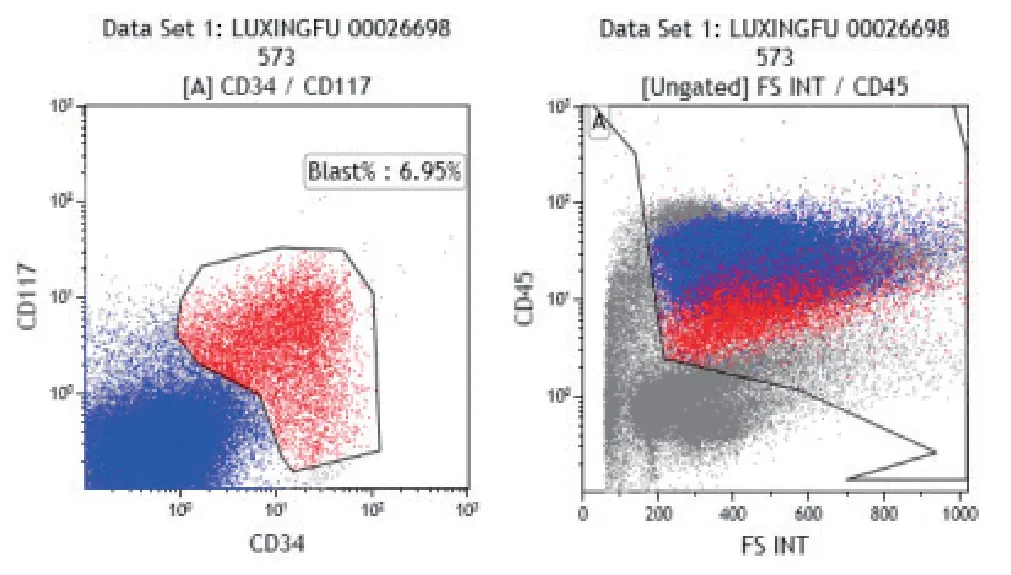
图3 患者2018-04-10骨髓免疫分型:检测出异常髓系原始细胞占6.95%,并出现明显单核细胞分化,检测出幼稚到成熟单核细胞占51.1%。

图4 患者2018-05-15骨髓涂片:(1)骨髓增生明显活跃,有核细胞量增多。(2)粒系增生收抑。(3)红系增生欠活跃,早期幼红细胞比例增高,幼红细胞可见巨幼变,多核等病态造血现象,成红细胞大小不等。(4)成熟淋巴细胞减少。(5)涂片可见一类原始幼稚细胞,该类细胞胞体大染色质疏松粒状,胞浆丰富,着色淡蓝,部分可见空泡(暂考虑单核来源)占58%,分类中可见成熟单核细胞,占18%。(6)浆细胞偶见,约占1%。(7)环片一周见到巨核细胞9个,皆为颗粒性巨核细胞,产板功能差。结论:急性白血病,形态学似ALL-M5。
2 讨论
根据世界卫生组织(WHO)对 MM 的诊断标准,本例患者MM(IgG-lamda 型)诊断明确。2018-01-09 骨髓涂片示:骨髓增生明显活跃,可见部分核仁明显的原始细胞约占8%,单克隆浆细胞比例0.70%。按照维也纳MDS 最低诊断标准,MDS 诊断成立,分型为MDS-RAEB-II。患者多发性骨髓瘤形态学缓解,故本例患者诊断为MM 治疗后继发MDS。
MM 是一种常见的血液系统恶性肿瘤,约占全部恶性肿瘤的1%,造血系统恶性肿瘤的10%[1]。MM 是一种浆细胞恶性增殖性肿瘤,目前仍不可治愈。尽管新药的出现,如硼替佐米、卡非佐米、雷那度胺、泊马度胺、Daratumumab(DARA,CD38 单抗)等,极大改善了疗效和生存时间,但伴随长期治疗,MM 继发第二肿瘤成为新的挑战。与 MM 相关的肿瘤包括实体肿瘤及血液系统肿瘤,实体肿瘤中以皮肤、结直肠、妇科、前列腺、泌尿生殖系统肿瘤多见,极少数患者可见肺癌、甲状腺癌。血液系统肿瘤以B 细胞淋巴瘤及急性白血病或骨髓增生异常综合征(AL/MDS)较常见[2]。
本文患者初诊为多发性骨髓瘤(IgG-lamda 型,DS 分期II 期,A 型),开始每月化疗1 个疗程,2 年后改为每3 个月化疗1 个疗程,治疗共维持6 年。患者6 年6 月后复查骨髓,提示继发MDS-RAEB-II),经2 次化疗,后转为急性白血病(AML)。患者治疗效果不佳,继发MDS 后很快转化为AML-M5b。目前MM 继发MDS 尚无统一治疗方案,按照原发MDS 治疗,药物反应差,相关文献未提到是否可行异基因造血干细胞移植的方案。但鉴于该患者治疗过程中出现疾病进展,考虑化疗无效,患者自动出院,最后死亡。
随着MM 患者生存期的延长,MM 治疗后继发MDS/AL的报道可能会越来越多,探讨MM 继发第二肿瘤的机制及进一步治疗则显得更为重要。MM 继发的MDS/AL 病情进展迅速,化疗后完全缓解率低,常伴发出血及感染等不良反应,预后差,死亡率高。因此,MM 患者治疗中复查骨髓是很有必要的,定期监测血液学、遗传学与分子生物学等相关检查很重要。

