新型亲水性荧光探针BODIPY-PC-RGD的制备及性能测试
孟舒献,孟 洋,薛中博,冯 彤,冯亚青,
(1.天津大学化工学院,天津 300072;2.天津化学化工协同创新中心,天津 300072)
目前,近红外荧光染料已经在肿瘤诊断[1]、荧光成像、生物标记以及非线性光学材料[2]等诸多领域发挥着重要的作用,并越来越受到相关领域研究者的重视.近红外荧光染料的吸收波长与发射波长均在650~900nm 左右,因此,其在传播过程中受到的干扰较小,对物质的穿透性能较强;尤其在医药生物学的活体标本检测中,其较大的波长有利于避开生物体内的自发荧光,因此对组织细胞的渗透性增强,降低对生物体的损伤,在生物检测、样本分析、活体诊断等领域表现出明显的优势[3-6].
氟硼荧类(BODIPY)荧光染料是一种重要的近红外荧光染料.德国化学家 Treibs等[7]于 1968年首次对 BODIPY荧光染料进行了报道.1985年,带有磺酸基团的水溶性 BODIPY首次被发现后,氟硼荧类荧光染料逐渐引起了化学家的重视[8].近年来,BODIPY荧光染料因其优良的光学性质、较大的摩尔消光系数、较强的光稳定性和易于修饰等优点被广泛用作近红外荧光探针的发光基团[9-11].
然而,BODIPY荧光染料也有其不足之处,Sibrian-Vazquez等[12]提出,目前大多数 BODIPY 类荧光染料的吸收和发射波长小于 600 nm,处于可见光区域,并非真正意义上的近红外 BODIPY荧光染料;除此之外,用于活体成像中的BODIPY荧光染料普遍具有较大的共轭芳香结构,刚性较强,导致其水溶性与生物相容性差,严重限制了其在有机生命体中的应用[13-14].
为了解决上述两种难题,目前国内外对BODIPY荧光染料的研究主要集中在以下两个方面,其一是对BODIPY分子进行修饰以增大其吸收与发射波长,主要包括:①在 3、5位引入共轭基团以延长其共轭结构[15];②在β位进行芳环共轭;③在2、3位与5、6位引入芳环基团,扩大共轭结构;④在 2、6位引入炔基;⑤在meso位用N原子取代C原子以改变其电子推拉结构等方法[16-20].其次,BODIPY荧光染料的水溶性问题,目前通常采用以下方法解决:①在核心骨架上引入亲水基团[21];②与两亲性聚合物自组装等[22-24].
本课题拟合成一种具有新型化学结构的荧光染料,对BODIPY进行化学修饰,使其最大吸收和发射波长均发生较大红移,随后利用靶向基团 RGD共价修饰的水溶性和生物相容性较好的磷脂分子与BODIPY进行自组装,进而研发一种具有优良荧光性能、近红外发射波长较长、良好的靶向性与生物相容性的荧光探针分子,为发展新型的荧光性能优异并具有良好的生物相容性的近红外荧光探针提供新思路和新方法.
1 实 验
1.1 实验原料
卵磷脂、胆固醇,生物试剂,天津苏斯泰来生物技术有限公司;2,4-二甲基吡咯、对甲酰基苯甲酸甲酯、三氟乙酸、2,3-二氯-5,6-二氰对苯醌(DDQ)、三氟化硼乙醚,分析纯,天津希恩斯奥普德科技有限公司;二氯甲烷、石油醚、四氢呋喃,分析纯,天津市江天化工技术股份有限公司;二苯胺、对碘苯甲醛、醋酸钯、双[2-(二苯基膦基)苯基]醚、碳酸铯、18-冠-6醚,分析纯,上海阿拉丁生化科技股份有限公司;哌啶,分析纯,中国医药上海化学试剂研究所.所有化学药品均未经处理可直接使用.
1.2 实验设备
Bruker DPX 500M 型核磁共振仪,瑞士 Bruker公司;Autoflex tof/tofIII 型基质辅助激光解吸附-串联飞行时间质谱仪,布鲁克道尔顿公司;S-4800型场发射扫描电子显微镜,Hitachi公司;Tecnai G2F20型场发射透射电子显微镜,荷兰FEI公司;ZS90纳米粒度分析仪,马尔文仪器有限公司;Nicolet 6700型傅里叶变换红外光谱仪,Thermo Scientific公司;LB942型酶标仪,Berthold Technologies公司;Ultra VIEM Vox型共聚焦显微镜,PerkinElmer公司.
1.3 实验路线
1.3.1 8-对甲氧羰基苯基-1,3,5,7-四甲基氟硼二吡咯(Ⅰ)化合物的制备
氟硼二吡咯化合物骨架的合成参见文献[25],具体步骤如下:称取对甲酰基苯甲酸甲酯 864mg(5.2 mmol)加入 100 mL单口烧瓶中,加入 32mL二氯甲烷溶液加入使其溶解,之后再量取 2,4-二甲基吡咯 1mL(10.0 mmol)加入.避光反应 15min,N2鼓泡 0.5h,用来除去体系中的氧气.之后,缓慢加入0.08 mL三氟乙酸,避光搅拌 4h,取 600mg DDQ(1.3 mmol)溶解于 5 mL二氯甲烷与 5 mL四氢呋喃混合溶液中,避光反应1h后,量取8.6mL三乙胺逐滴加入,持续约 10 min,之后在冰浴环境中逐滴加入8.6 mL三氟化硼乙醚,0.5h后,撤去冰水浴,混合物于室温下进行磁力搅拦避光过夜反应.之后,将混合物水洗,二氯甲烷萃取,以CH2Cl2和PE体积比为 2∶1进行硅胶柱层析分离,收集第 2条色带,得到深色片状晶体化合物Ⅰ,如图1所示.
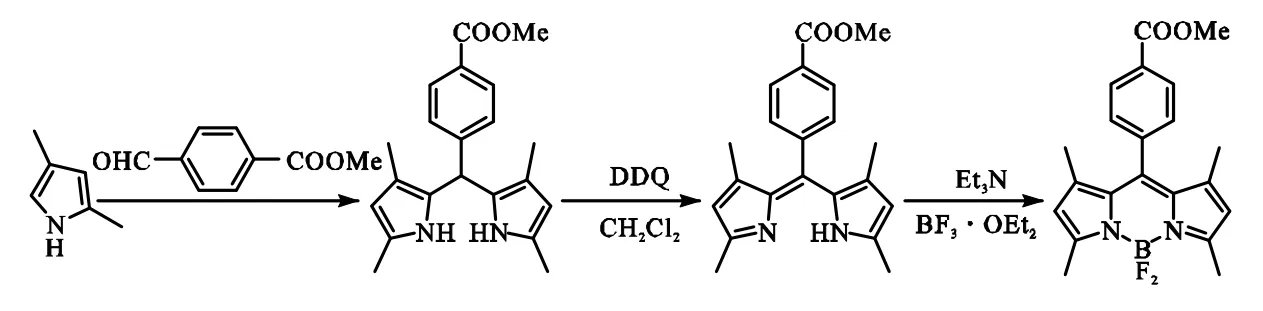
图1 化合物Ⅰ的合成Fig.1 Synthesis of compoundⅠ
1.3.2 4-二芳胺基苯甲醛(Ⅱ)的合成
向装有冷凝管的100 mL烧瓶中分别加入18-冠-6醚 670 mg(2.5 mmol)、二苯胺 423 mg(2.5 mmol)、醋酸钯28 mg(125μmol)、对碘苯甲醛580 mg(2.5 mmol)、双[2-(二苯基膦基)苯基]醚 68mg(125μmol)、碳酸铯 630mg(2.5 mmol),在氩气保护下,加入 15 mL四氢呋喃,缓慢加热至回流,12h后终止反应.以二氯甲烷萃取,并收集有机相,以CH2Cl2和 PE体积比为1∶1.5的比例进行柱层层析分离,收集第3条色带,得到产品Ⅱ,如图2所示.

图2 化合物Ⅱ的合成Fig.2 Synthesis of compound Ⅱ
1.3.3 3,5-二(4-二苯胺基苯乙烯基)-8-对甲氧羰基苯基-1,7-二甲基氟硼二吡咯(Ⅲ)化合物的合成
分别称取化合物Ⅰ76.4 mg(0.2 mmol)和化合物Ⅱ164mg(0.6 mmol)加入圆底烧瓶,之后加入 15 mL苯作溶剂,并向溶液中滴加 0.2 mL(2.0 mmol)哌啶和0.2 mL(3.4 mmol)冰乙酸,90℃下进行回流反应12h.待反应终止后,用二氯甲烷萃取反应液,收集有机相,柱层析分离后,收集第 1条主要色带,得到化合物Ⅲ,如图3所示.
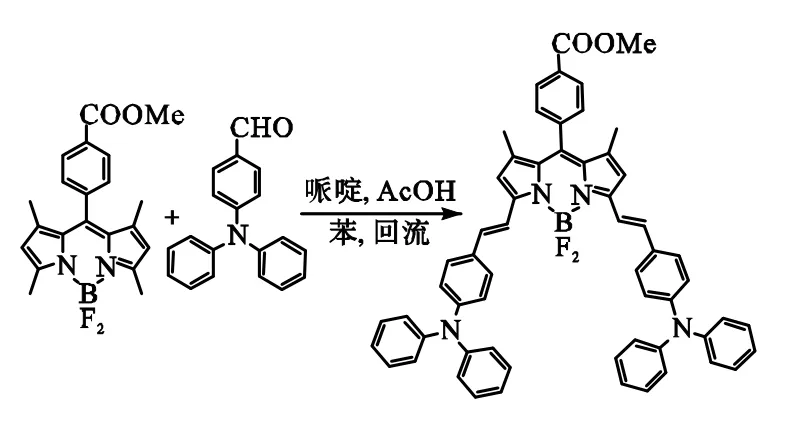
图3 化合物Ⅲ的合成Fig.3 Synthesis of compound Ⅲ
1.3.4 DSPE-PEG2000-MAL-RGD的合成
将 2.5mg DSPE-PEG2000-MAL与 200μg RGD投入10 mL、pH值为7.4的PBS缓冲液中,在25℃氮气保护下反应 12h,然后用透析袋透析 3×24h除去未反应的 RGD小分子,在冷冻干燥机中将溶剂冻干,得到白色固体,4℃下冷冻保存.
1.3.5 BODIPY-PC-RGD的合成
精确称量 3mg卵磷脂、1mg化合物Ⅲ、2.5mg DSPE-PEG2000-MAL-RGD以及 1mg 胆固醇溶于30 mL的甲醇-氯仿溶液中(氯仿与甲醇的体积比为2∶1),40℃下,在旋转蒸发仪中彻底除去氯仿与甲醇,直至其在烧瓶内壁上形成一层脂质薄膜.加入10 mL磷酸缓冲液(pH=7.8)于烧瓶中,超声 15min至溶液澄清,经 0.45μm滤膜过滤制得 BODIPY-PCRGD溶液.在冷冻干燥机中将溶剂冻干,得到白色固体,4℃下冷冻保存.
1.4 分析测试
1.4.1 核磁共振氢谱(1HNMR)
采用核磁共振波谱仪表征化合物Ⅰ、Ⅱ、Ⅲ.溶剂为无内标的氘代氯仿(CDCl3).
1.4.2 BODIPY的荧光光谱测试
采用荧光分光光度计测试 BODIPY母核、化合物Ⅲ、BODIPY-PC-RGD 稳态荧光光谱,以激发波长Em=560nm进行激发,设置测试参数统一为:激发电压为700V,狭缝宽为5nm.
1.4.3 形貌测试
BODIPY-PC-RGD的形貌由场发射扫描电子显微镜(SEM)、场发射透射电子显微镜(TEM)、普通光学显微镜与荧光显微镜表征.
1.4.4 细胞毒性实验(MTT)
分别培养 U87与Hela两种细胞,并按 MTT实验要求 96孔铺板;制备不同浓度的 BODIPY、BODIPY-PC、BODIPY-PC-RGD(0.001μg/mL、0.01 μg/mL、0.1μg/mL、1μg/mL、10μg/mL、100μg/mL、200μg/mL),分别加入上述培养的两种细胞中,37℃、5% CO2的培养箱中培养 48h后,加入 MTT,继续培养 4h后,每孔加入 100μL DMSO溶液使活细胞中的甲瓒晶体溶解.使用酶标仪测试每个孔中细胞在490nm处的吸光度,数据处理按照式(1)进行.

式中:V代表细胞存活率,%;Aexp代表实验组细胞的吸光度;Acontrol代表空白对照组细胞的吸光度.
1.4.5 激光共聚焦实验
按照细胞毒性实验的方法进行细胞铺板,96孔板替换为48孔板,事先将48孔板细胞加入48孔板进行爬片;将 48孔板放入参数为 37℃、5% CO2的培养箱中,过夜培养使细胞贴壁;之后,吸弃旧的培养基,加入用培养基稀释好浓度的 BODIPY-PC与100μL BODIPY-PC-RGD 溶液(5μmol/L),将 48 孔板放入参数为37℃、5% CO2的培养箱中培养4h;将含有样品的培养基丢弃,加入 4%多聚甲醛 100μL,时长 5 min,固定细胞形态;用移液枪吸出4%多聚甲醛溶液,加入 DAPI溶液 100μL,历时 10 min,进行细胞核染色;之后吸弃 DAPI溶液,将爬片取出,并将其反面扣放在滴有 5μL防荧光淬灭封片剂的载玻片上,用共聚焦显微镜测试拍照,观察其荧光特性.
1.4.6 流式细胞实验
按照细胞毒性实验的方法进行细胞铺板,并用 6孔板代替 96孔板,按照激光共聚焦实验进行样品制备,在用流式仪测试上样前,将样品用 200目铜网进行过滤.
2 结果与讨论
2.1 3,5-二(4-二苯胺基苯乙烯基)-8-对甲氧羰基苯基-1,7-二甲基氟硼二吡咯(Ⅲ)化合物的合成
按第 1.3.3节的制备方法合成化合物Ⅲ.1HNMR(400 MHz,Chloroform-d)δ8.17(d,J=8.1Hz,2H,Ph-H),7.60(d,J=16.2Hz,2H,—CH=CH—),7.42(m,6H,Ph-H),7.27(t,J=7.6Hz,8H,Ph-H),7.20(d,J=16.3Hz,2H,—CH=CH—),7.14(d,J=7.8Hz,8H,Ph-H),7.10~7.00(m,8H,Ph-H),6.62(s,2H,pyrrole-H),3.40(s,3H,—COOCH3),1.43(s,6H,pyrrole-CH3).MALDI-TOFMS:m/z calcd for C59H47BF2N4O2892.86,found 892.53 [M+].化合物Ⅲ的氢谱谱图如图4所示.
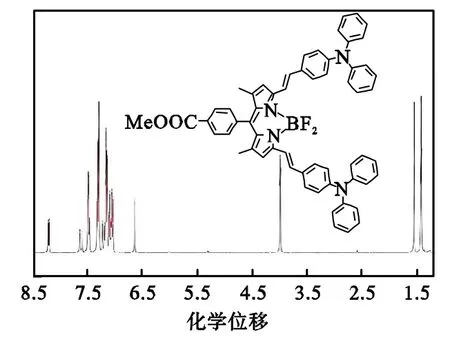
图4 化合物Ⅲ的氢谱谱图Fig.4 1HNMR spectra of compound Ⅲ
2.2 BODIPY的荧光光谱分析
为了研究所合成 BODIPY的光学性能,这里分别测试了BODIPY母核、所合成BODIPY(溶剂均为二氯甲烷)以及 BODIPY-PC-RGD(溶剂为去离子水)的荧光光谱,如图 5所示.由图 5可知,BODIPY母核的最大发射波长在 490 nm左右,而所合成的BODIPY最大发射波长在 680 nm,发生了明显的红移,这主要是因为 BODIPY母核 3、5位上所连接的供电子基团形成推拉电子结构.另一方面,3、5位基团的引入,使原BODIPY分子共平面性增强,这在一定程度上限制了由于结构自由旋转产生的非辐射能量损失,使其荧光波长从 490nm达到了近红外区的680 nm.由图 5(c)可知,当 BODIPY 的浓度相同时(40μg/mL),组装后的 BIDIPY-PC-RGD 相较组装前的荧光强度略有降低,并且发生蓝移,主要是因为用磷脂包覆后,BODIPY分子进入磷脂形成的球囊的间隙中,空间较小,使得磷脂分子容易聚集,从而导致荧光猝灭,荧光强度下降.另一方面,经磷脂包覆后,BODIPY染料外层有了一层磷脂屏障,阻碍了荧光的穿透,导致了荧光强度的下降.蓝移的主要原因在于:BODIPY经磷脂包覆后,其分子周边的微环境极性升高,溶剂分子极化率增大,斯托克斯位移减小,导致蓝移.
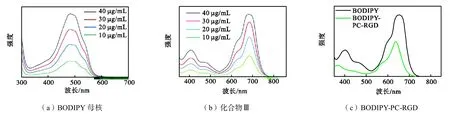
图5 荧光光谱Fig.5 Fluorescence spectra
2.3 BODIPY与BODIPY-PC-RGD的形貌分析
图 6(a)、(b)分别是 BODIPY 在 SEM 与 TEM中的图像,图 6(d)、(e)分别是 BODIPY-PC-RGD 在SEM 与 TEM 下的图像.可以看出,单独的 BODIPY颗粒大小不均一,表面粗糙,没有特定的形状,在水相中呈聚集状态,片层较厚,堆积现象明显,且片层表面有明显的褶皱,无法测算其颗粒直径.当用磷脂将 BODIPY包覆后,发现探针颗粒均一,形状规则,表面圆润.图 6(c)是 BODIPY在水相中光学显微镜下的图像,BODIPY在水相中呈棕绿色,分散混乱,没有特定的形状,当用磷脂包覆后发现,BODIPY-PCRGD在水相中分散较为均匀,并且 BODIPY-PCRGD呈浅绿色说明磷脂将 BODIPY成功包覆.接着,又测试了 BODIPY-PC-RGD的粒径,如图 7所示,其粒径分布较为均一,为(143±20)nm.

图6 BODIPY与BODIPY-PC-RGD的形貌表征Fig.6 Morphologies of BODIPY and BODIPY-PC-RGD

图7 BODIPY-PC-RGD的粒径分布Fig.7 Size distribution of BODIPY-PC-RGD
为了进一步确认 BODIPY-PC-RGD的成功包覆,这里使用荧光显微镜检测了其在水相中的荧光性质与形貌,如图8所示.图8(a)是有机相中BODIPY在荧光显微镜下的图像,可以看出其发橘红色荧光,且形状不规则,大小不均一,图 8(b)是水相中BODIPY-PC-RGD在荧光显微镜下的图像,其发出的荧光与图 8(a)相比较弱,且呈球状分布,大小均一,说明BODIPY-PC-RGD的成功制备.

图8 BODIPY与 BODIPY-PC-RGD荧光显微镜下的图像Fig.8 Fluorescence images of BODIPY and BODIPYPC-RGD
2.4 BODIPY、BODIPY-PC、BODIPY-PC-RGD的细胞毒性分析
这里分别测试了 48h BODIPY、BODIPY-PC和BODIPY-PC-RGD在不同质量浓度0.001μg/mL、0.01 μg/mL、0.1 μg/mL、1 μg/mL、10 μg/mL、100 μg/mL、200μg/mL下对 U87与 Hela两种细胞的毒性,结果如图 9所示,结果表明,在低浓度时,BODIPY-PCRGD对细胞无毒害作用,当质量浓度上升到100μg/mL,无论是 U87还是 Hela细胞,依然有近90%以上的存活率,同时,可以发现,在一系列浓度梯度下,与单独的 BODIPY相比,磷脂包覆后的BODIPY毒性明显降低,因此,在实验所需浓度范围(低浓度)内,BODIPY-PC-RGD可以视为不具有任何细胞毒性,可以将其用于生物体内进行进一步研究.
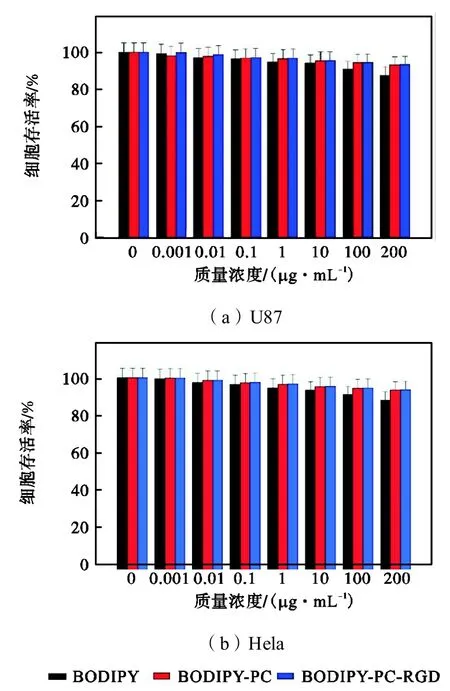
图9 MTT实验结果Fig.9 Results of MTT
2.5 共聚焦显微镜对细胞靶向性的测试结果
整合素 αVβ3在一些肿瘤细胞表面会进行特异性表达,而RGD多肽具有与αVβ3受体发生特异性结合的特性,因此,利用这一性质,让探针被带有靶向基团RGD的磷脂包覆,然后选择整合素αVβ3含量不同的细胞来对其靶向性进行检测.
为了确定 BODIPY-PC-RGD对于肿瘤细胞是否具有靶向性,这里选择了两种细胞 U87(整合素高表达)、Hela(整合素低表达)进行靶向性测试.如图 10所示,发蓝色荧光的是两种细胞的细胞核,这是由于DAPI染料对细胞核染色的结果;BODIPY在560nm的激发光下可以发出红色的荧光,因此可以通过红色荧光的强弱来判断探针与细胞结合的数量,进一步验证 BODIPY-PC-RGD的靶向性.通过实验结果可以看出,不具备靶向基团 RGD的 BODIPY-PC,在两种细胞中均表现出极弱甚至没有荧光,而具有靶向基团的 BODIPY-PC-RGD,则均可在两种细胞内观察到明显的红色荧光.另外,整合素高表达的细胞U87在荧光显微镜下展现出很亮的荧光,而整合素相对较低表达的 Hela则荧光强度比较弱,这也证明了带有靶向基团的磷脂具有靶向性,包覆 BODIPY染料后整体显示出明显的靶向性.
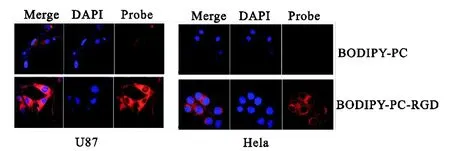
图10 U87细胞和Hela细胞共聚焦显微镜图像Fig.10 Fluorescence images of U87 and Helain vitro
2.6 流式细胞实验测试结果
流式细胞实验是一种通过检测探针到达细胞数量并定量对探针靶向性进行测定的一种手段.如图11所示,对于整合素较少的 Hela细胞,BODIPY、BODIPY-PC、BODIPY-PC-RGD 3者的荧光强度变化较少,说明探针到达细胞的数量较少;而对于整合素较多的 U87细胞,BODIPY-PC-RGD探针明显发生了右移.另外,无论是Hela细胞还是U87细胞,带有靶向基团的探针荧光强度均较无靶向基团的探针有较明显右移,该结论与上述共聚焦显微镜实验结论一致,进一步说明 BODIPY-PC-RGD对整合素高的肿瘤细胞具有良好的靶向作用.

图11 流式细胞实验测定结果Fig.11 Cell viability experimental results
3 结 语
氟硼类染料由于其良好的光学性能被广泛用作荧光探针的发光基团,但因其生物相容性、水溶性差而限制了其在生物体中的应用.为此,本文用接有靶向基团RGD的磷脂对BODIPY进行包覆,在解决了BODIPY难溶于水的难题的同时,增强了其在生物体内的靶向能力,通过细胞毒性实验、共聚焦实验以及流式细胞实验,证实了该 BODIPY-PC-RGD复合物具有良好的生物相容性以及肿瘤靶向性,表示这种复合物在未来肿瘤检测及诊断领域具有长远的发展潜力.

