HRMR-VWI对椎-基底动脉粥样硬化血管壁改变与急性脑梗死的关系研究
石增强,贾琳,贾文霄,韩秉艳,王云玲*
椎-基底动脉系统由椎动脉、基底动脉、大脑后动脉及其各级分支组成,供应脑干、小脑、丘脑、枕叶等重要脑区,该供血区一旦出现脑梗死将引起严重的神经功能损害,致残率及病死率均比较高[1]。椎-基底动脉系引起的后循环卒中约占脑卒中的20%[2]。目前临床常用的影像技术多只能显示血管狭窄的程度,而无法显示狭窄处管壁特征及管腔的结构改变。越来越多的证据表明对动脉粥样硬化管壁结构改变特点的研究比单纯对血管狭窄程度的研究对临床治疗更具有指导意义[3-5]。高分辨率磁共振血管壁成像(high resolution magnetic resonance vessel wall imaging,HRMR-VWI)是目前唯一可以实现活体内动脉管壁结构分析的技术,已被广泛用于颅内动脉粥样硬化责任血管的改变及斑块的诊断和评估。对颅内动脉狭窄的病因分析,指导临床治疗,提供了很大帮助。本研究利用HRMR-VWI对椎-基底动脉系责任血管的狭窄、重构情况及斑块的位置、负荷、强化特点与脑梗死的关系进行初步分析研究。
1 材料与方法
1.1 研究对象
回顾性分析新疆医科大学第二附属医院脑神经中心2018年1月至2019 年3月期间突发急性脑梗死住院的患者32例。
纳入标准:(1)经过MRI扩散加权成像(diffusion weighted imaging,DWI)证实系椎-基底动脉系供血区孤立性急性脑梗死;脑梗死诊断根据2014年中国急性缺血性脑卒中诊治指南标准;(2)所有患者均在发病1周内行磁共振平扫检查(含DWI)和HRMR-VWI T1WI平扫+对比增强成像检查;(3)具备血常规、血脂、血压等易发生动脉粥样硬化危险因素的完整病例资料。所有入组患者入组前签订知情同意书。排除标准:(1)怀疑为心源性栓子脱落、血管炎、或动脉夹层等非动脉粥样硬化性脑梗死患者;(2)具有MRI检查禁忌证患者。研究得到本院伦理委员会批准,所有对象均由本人或家属签署知情同意书。
1.2 影像学检查
所有患者均行头颅CT检查排除脑出血,采用飞利浦3.0 T超导磁共振扫描仪(Achieva;Philips Healthcare,best,the Netherlands),32通道头颅专用线圈。常规头颅平扫(含DWI序列),后进行HRMR-VWI扫描。HRMR-VWI序列包括:基于VISTA容积扫描技术的T1WI,T1WI增强扫描。3D T1WI-VISTA扫描参数如下:TR=800 ms,TE=20 ms,FOV=200 mm×18 mm×40 mm,层厚=0.6 mm,层间隔=0 mm,层数=133,Matrix=332×302,对比剂采用钆-喷酸葡胺,使用量为0.2 mL/kg。
1.3 图像后处理及分析方法
用飞利浦星云6.0后处理工作站,在VISTA序列上用多平面重建技术将观察平面调整至与病变血管垂直角度进行重建、观察及测量计算。由两位影像科副主任医师在工作站上采用盲法独立分析HRMRI血管壁的显示情况,意见不一致时协商取得一致。所有HRMRVWI评价均在T1WI上进行。评价内容包括:管壁是否增厚,有无明确的斑块;有斑块存在时,在T1WI对比增强上分析该斑块强化特点。强化程度与同层面垂体组织进行比较并进行分级。在血管最窄处手动描出血管边界,由工作站软件自动计算出血管面积、管腔面积。对HRMRI上有狭窄血管测量最窄层面的面积。参考层面:取(病变近心端正常层面+远心端正常层面)/2的数值为参考层面,斑块负荷=[(最狭窄处血管面积-最狭窄处管腔面积)/最狭窄处血管面积]×100%,重构指数(remodeling index,RI)=最狭窄处血管面积/参考层面血管面积;重构模式:正性重构,重构指数≥1.05;负性重构,重构指数≤0.95;重构指数在0.95~1.05为无明显重构[6]。
斑块分布位置:结合高分辨图像的T1WI、T1WI增强序列图像确定椎-基底动脉管腔最狭窄的层面,将该层图像放大4倍,以管腔中心点及水平线为基准作两条与水平线45°角斜线,管腔被均分为4个90°扇形角(右侧、腹侧、左侧、背侧),并对斑块在4个扇形角的分布情况进行统计。最大管壁厚度所处的象限为斑块位置,斑块覆盖范围≥3个象限为环形斑块,否则为偏心性斑块[7]。
斑块强化程度:(1)0级:无强化,强化程度低于或等于正常管壁;(2)1级:轻度强化,强化程度高于正常管壁,低于垂体组织;(3)2级:明显强化,强化程度等于或高于垂体组织[6,8]。
1.4 统计学方法
采用SPSS 25.0统计学软件对各实验数据进行统计学分析。计量资料符合正态分布,以均数±标准差来表示,组间比较采用t检验,计数资料采用频数、百分比表示,两组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者基线特征
本研究中共入组32例患者,其中男性27例(84.3%),女性5例(15.6%),平均年龄(54.2±9.3)岁。有高血压者23例(71.9%),糖尿病者15例(46.9%),吸烟者18例(56.2%),高脂血症者15例(48.3%)。
2.2 管壁重构与斑块负荷特点
本研究发现基底动脉粥样硬化斑块18例,椎动脉(颅内段)粥样硬化斑块12例,2例脑桥旁正中急性脑梗死患者后循环未发现明显斑块。对椎动脉及基底动脉粥样斑块的30例患者计算重构指数。结果负性重构7例(23.3%),正性重构21例(70.0%),无重构2例(6.7%),血管重构以正性重构多见。比较责任血管正性重构组的血管重构指数为(1.31±0.21),负性重构组的血管重构指数为(0.78±0.12),差异具有统计学意义。对责任血管管腔最狭窄处分析显示,正性重构组血管面积(14.58±5.27) mm2、斑块面积(6.32±3.19) mm2、斑块负荷(0.51±0.13)均大于负性重构组责任血管最狭窄层面的血管面积(7.49±2.38) mm2、斑块面积(2.14±1.43) mm2、斑块负荷(0.28±0.19),差异具有显著性;对比正性重构组和负性重构组的参考层面管壁特点及管腔面积,差异无统计学意义(P>0.05)。详见表1。
2.3 斑块分布特点
对责任斑块所在层面进行分区,对斑块分布进行统计,结果显示,责任斑块位于前壁6例(20%),背侧壁16例(53.3%),左壁3例(10%),右壁4例(13.3%),环壁1例(3.3%)。本研究中基底动脉斑块多发生于穿支动脉开口周围管壁,以背侧壁多见(如图1)。双侧椎动脉粥样硬化斑块多发生于椎动脉远端近基底动脉汇合处背侧壁或上壁(如图2)。
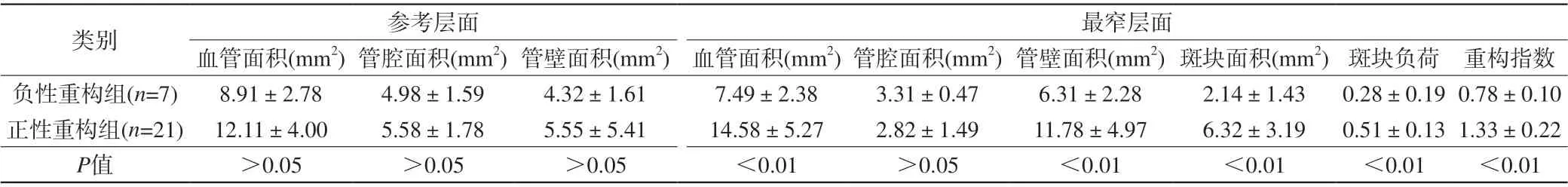
表1 血管负性重构组与正性重构组的管壁特点比较Tab.1 Comparison of wall characteristics between negative vascular remodeling group and positive remodeling group

图1 男,55岁,A、B:右小脑半球DWI异常高信号,ADC呈低信号,提示右小脑半球脑梗死;C:HRMRI-VWI示基底动脉局部管壁增厚(a箭所示),累及分支血管(b箭所示)开口;D:T1-VISTA增强显示增厚管壁明显强化 图2 男,64岁,A:脑干及右侧小脑半球DWI多发异常高信号;B:ADC示病灶区呈明显低信号,提示急性脑梗死;C:HRMRI-VWI示双侧椎动脉迂曲远端管壁明显增厚;D:T1-VISTA增强检查,增厚管壁明显强化 Fig. 1 Male, 55 years old, DWI abnormal high signal in right cerebellar hemisphere (A). ADC showed low signa, suggesting right cerebellar hemisphere cerebral infarction (B); C: HRMRI-VWI showed local thickening of basilar artery wall (a arrow shown), involving the branches of the blood vessels (shown by the arrow b); D: HRMRI-VWI enhanced display thickening of the wall significantly enhanced. Fig. 2 Male, 64 years old, A: Brainstem and right cerebellar hemisphere DWI multiple abnormal high signal; B: ADC showed a significantly low signal in the lesion area, suggesting acute cerebral infarction; C: HRMRI-VWI showed bilateral vertebral artery tortuosity of the distal wall thickened significantly; D: T1-VISTA enhanced inspection, thickened wall is obviously strengthened.
2.4 斑块强化
本研究中30例发现后循环斑块的患者中,斑块未见明显强化4例(13.3%),斑块有不同程度强化者24例(80.0%),其中轻度强化者2例(6.7%),明显强化斑块19例(63.3%)。统计分析显示责任斑块绝大部分表现出明显强化或轻度强化,极小部分责任斑块表现不强化,提示斑块强化与脑卒中的发生有密切关系。2例脑桥旁正中急性脑梗死患者梗死部位在脑桥正中线旁,HRMR-VWI未发现明显斑块及异常管壁强化。
3 讨论
目前临床常用的评价颅内动脉狭窄的影像技术,如磁共振血管成像(magnetic resonance angiography,M R A)、C T 血管成像(c o m p u t e d t o m o g r a p h y angiography,CTA)、经颅多普勒超声(tanseranial dopple,TCD),仅能显示血管狭窄的程度,不能够判断狭窄处管壁特征及管腔狭窄的原因。本研究利用HRMR-VWI对椎基底动脉系血管壁斑块与后循环急性脑梗死关系进行初步探究。
3.1 管壁重构和斑块负荷
在对冠状动脉的研究中发现血管重构是狭窄血管的代偿方式,包括正性重构和负性重构[9]。研究发现颅内动脉也存在与冠状动脉相似的重塑现象[10-11]。正性重构为血管向外扩张,管腔狭窄程度较轻;负性重构表现为管壁向腔内增厚,加重管腔的狭窄程度,两者均导致脑卒中的发生。本研究对后循环卒中患者进行管腔重构测量计算发现多以正性重构多见,且正性重构血管面积、斑块面积及负荷均大于负性重构组。分析原因可能是血管膨胀性生长,具有较大的血管面积,易形成较大负荷的斑块,在血流冲击力作用下,斑块易损部脱落,阻塞下游较细的分支血管,发生缺血性脑卒中。
3.2 斑块分布
研究发现[12-13]基底动脉脑桥部穿支动脉开口多位于基底动脉背侧或背外侧壁。本研究发现,基底动脉粥样硬化斑块多发生于穿支动脉分支开口周围,这可能与基底动脉血流动力学有关。压力高、流速快的管腔中轴部血流在流向管径小、阻力大的细小分支血管时,容易在分支开口周围形成漩涡,冲击周围管壁内膜,进而发生内膜损伤。内膜损伤后管壁则粗糙不平,加之高血脂、红细胞比容增大等血液粘滞性增加的诸因素,动脉粥样硬化的病理改变过程就易发生于分支起始段开口周围管壁。当斑块位于腹侧壁而不累及穿支动脉开口时,可能是造成无症状动脉粥样硬化狭窄的主要原因;当斑块位于背侧壁或腹侧壁及内外侧壁,阻塞穿支动脉开口时,则会导致缺血性卒中的发生(图1)。本研究中斑块分布以背侧壁多发见,这与Guo等[14]对44例患者斑块分布研究结果相仿。斑块分布是影响梗死类型的重要因素之一。有研究发现[15]脑桥旁正中梗死多由于基底动脉粥样硬化斑块堵塞穿支动脉开口;高血压患者也可能因为穿支动脉玻璃样变引起穿支动脉闭塞,造成脑桥旁脑梗死,这可能是出现有梗死而责任血管无斑块的原因之一。本研究中两例脑桥正中旁急性梗死患者高血压三级,后循环未发现明显斑块,引起梗死原因可能是患者高血压导致穿支动脉玻璃样变管腔狭窄或闭塞。HRMR-VWI对椎-基底动脉系穿支动脉开口的清晰显示,对后循环梗死病因做出一定分析;可以指导患者介入治疗,防止雪梨效应、支架封堵事件的发生,监测内膜增生引起的穿支卒中。
3.3 斑块强化
强化被认为是易损斑块的重要特征之一[16-18]。这主要与新生血管形成和炎性反应导致的斑块局部内皮细胞功能障碍有关,斑块容易破裂、脱落,脱落组织阻塞下游分支小血管,引起供血区急性及亚急性脑梗死。本研究中斑块多呈轻度及明显强化,在一例双侧椎动脉均出现强化斑块的患者中,患者出现脑干及小脑多发急性梗死(图2),可能与易损斑块脱落导致下游分支血管栓塞有关。
本研究不足之处包括:样本量较小,在进一步的研究中希望可以扩大样本量,进行一些大型的前瞻性研究进一步证实研究结果;颅内动脉的解剖特点及检查时间较长患者配合欠佳的因素,使得管壁成像质量具有挑战性,部分患者的图像效果欠佳,需要进一步改进技术,缩短成像时间,提高时间和空间分辨率。
综上,HRMR-VWI能够清晰显示椎基底动脉管壁特征、斑块位置、斑块强化特点,能够在一定程度推测梗死病因;能够显示穿支动脉开口,为血管介入治疗提供指导依据。
利益冲突:无。

