酸马奶源产细菌素植物乳杆菌MXG-68的益生特性
满丽莉,向殿军,李华,倪娜
(内蒙古民族大学a.生命科学学院,b.农学院,内蒙古通辽,028042)
0 引 言
益生菌是能促进宿主健康的活体微生物,具有无残留、无毒副作用、无抗药性、耐酸碱、耐胆盐等优点,是未来替代抗生素的潜在产品[1-2]。乳酸菌菌株是作为益生菌的最常见微生物,目前商业化产品中使用的益生菌大部分属于乳杆菌属和双歧杆菌属,大多数是人体来源或乳及乳制品来源的、具有免疫调节功能、能在胃肠道中存活的微生物[3-4]。目前筛选具有良好益生特性、压力耐受性及自主知识产权的益生菌是研究的热点之一。
植物乳杆菌是发酵食品中常见的乳酸菌,因其来源安全(GRAS)被广泛用于益生菌的筛选,其对黄瓜、橄榄、酸菜、发酵乳制品等发酵食品的高酸度和高盐环境具有强耐受性,因而在食品工业中应用甚广[5-6]。另一方面,植物乳杆菌对极端的胃肠道环境(胃酸、胆盐)有足够的抵抗力。此外,一些菌株还具有其他的益生菌特性,包括较高的β-半乳糖苷酶活性和疏水性,这与菌株对宿主的黏附能力有关;抑菌物质的产生如:细菌素、过氧化氢、酸性物质等,这与菌株抑制致病性微生物、维持肠道菌群平衡、提高肠道免疫力有关[7-9]。
FAO/WHO的标准认定益生菌筛选必须满足三个基本特点:耐受胃肠黏膜的选择环境、黏附宿主的肠壁细胞、分泌物或者分解产物为抗菌物质[10]。本试验通过评价酸马奶源产细菌素植物乳杆菌MXG-68的益生性能,以期为益生菌的开发提供新的菌种资源,为进一步开发微生态制剂及其工业化应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试样品及模式菌株
植物乳杆菌MXG-68分离于内蒙古地区的酸马奶中,由实验室自行保存。指示菌菌株购自广东环凯微生物科技有限公司。
1.1.2 试剂、培养基及主要仪器设备
1.1.2.1 试剂、培养基
乳酸菌及指示菌所需培养基购自英国Oxoid公司;过氧化氢酶、异硫氰酸荧光素购自美国Sigma公司;抗菌药物纸片购自杭州天和微生物试剂有限公司及北京天坛药物生物技术开发公司;Caco-2细胞、胎牛血清购自以色列BI公司;DMEM培养基购自上海英骏生物技术公司;其它药品均为国产分析纯或化学纯。
1.1.2.2 主要仪器设备
J-54A/MJ-78A型STIK灭菌锅:北京天赐科仪商贸有限公司;Microfuge16型离心机:美国贝克曼公司;110-801型三量ip67防水原点数显卡尺不锈钢零点电子游标尺:东莞市景有模具五金有限公司;DHP-600恒温培养箱:常州中捷实验仪器制造有限公司;Model 680型酶联免疫检测仪:美国Bio-Rad公司;DNP-9272型生化培养箱:上海精宏实验设备有限公司。
1.2 方法
1.2.1 培养方法
植物乳杆菌MXG-68的培养方法:挑取菌株接种于装有100 mL MRS培养基(p H 5.8)的250 mL锥形瓶中,37℃培养至约109cfu/mL。
指示菌的培养方法:挑取指示菌接种于装有100 mL培养基的250 mL锥形瓶中,37℃培养至约107cfu/mL。产气荚膜梭菌及生孢梭菌用RCM培养基;单核细胞增生李斯特氏菌用TSA-YE培养基;粪肠球菌、铜绿假单胞菌及肠炎沙门氏菌用LB培养基;其他指示菌均用NB培养基。
1.2.2 植物乳杆菌MXG-68的抑菌特性试验
1.2.2.1 抑菌谱的测定
按1.2.1的方法获得植物乳杆菌MXG-68的菌液按1%接种于装有100 mL MRS培养基(p H 5.8)的250 mL锥形瓶中,30℃发酵24 h。
无细胞发酵上清液的制备及抑菌活性测定:发酵液经12 000×g,于4℃离心10 min,收集上清液,用1 mol/L NaOH调p H值至7.0,排除有机酸的干扰。加入过氧化氢酶(终浓度为5.0 mg/m L),37℃水浴2 h排除过氧化氢的干扰,上清液经0.22μm滤膜过滤后备用,取50μL上清液测定抑菌活性。植物乳杆菌MXG-68所产细菌素对20株指示菌的抑菌活性采用双层平板打孔法检测[11],打孔直径为6 mm,抑菌圈直径采用电子游标卡尺测定。
1.2.2.2 传代稳定性的测定
将植物乳杆菌MXG-68在MRS培养基斜面上连续传代20次,培养温度为37℃,培养时间为24 h。将不同代次的菌株按照1.2.1和1.2.2.1的方法培养并制备无细胞发酵上清液,以鼠伤寒沙门氏杆菌ATCC14028为指示菌,通过双层平板打孔法检测观察不同代次菌种抑菌活性的变化情况,确定植物乳杆菌MXG-68所产细菌素的传代稳定性。
1.2.3 植物乳杆菌MXG-68的动力学曲线测定
按1.2.1的方法获得植物乳杆菌MXG-68的菌液按1%接种于装有100 mL MRS培养基(pH 5.8)的250 mL锥形瓶中,30℃发酵32 h,每隔2 h取样,通过平板菌落计数法测定样品的活菌数,获得菌株的生长曲线。按照1.2.2.1的方法制备样品的无细胞发酵上清液,以鼠伤寒沙门氏杆菌ATCC14028为指示菌,通过双层平板打孔法测定抑菌活性,获得菌株所产细菌素的发酵曲线。
1.2.4 植物乳杆菌MXG-68对人工胃液的耐受性试验
人工胃液的制备:取10 g胃蛋白酶,2 gNaCl,7 mL浓盐酸,加蒸馏水至约800 mL,摇匀定容至1 000 mL。用HCl分别将100 m L人工胃液的pH调至1.0~4.0,0.22μm滤膜过滤除菌。按1.2.1的方法培养的植物乳杆菌MXG-68菌液按5%接种于不同p H的人工胃液中,处理1~4 h。经适当稀释后,运用平板菌落计数法分析菌株对人工胃液的耐受性。存活率(%)=(处理后的活菌数/处理前的活菌数)×100%。
1.2.5 植物乳杆菌MXG-68对人工肠液和胆盐的耐受性试验
人工肠液的制备:500 m L蒸馏水溶解6.8 g KH2PO4,调p H至6.8,加入10 g胰蛋白酶,定容至1 000 mL。100 mL人工肠液中分别加入0.1~0.4 g胆盐(终浓度为0.1%~0.4%),0.22μm滤膜过滤除菌。按1.2.1的方法培养的植物乳杆菌MXG-68菌液按5%接种于含有不同浓度胆盐的人工肠液中,处理1~4 h。经适当稀释后,运用平板菌落计数法分析菌株对人工肠液和胆盐的耐受性。存活率(%)=(处理后的活菌数/处理前的活菌数)×100%。
1.2.6 植物乳杆菌MXG-68对Caco-2细胞的黏附性试验
菌液制备:按1.2.1的方法培养的植物乳杆菌MXG-68菌液于4℃,8 000×g离心15 min,弃上清后菌体用无菌的磷酸盐缓冲溶液洗涤3次,用无菌的磷酸盐缓冲溶液重悬菌体至108cfu/m L,备用。
植物乳杆菌MXG-68的荧光标记:制备的菌液悬浮于100mg/mL异硫氰酸荧光素中,于37℃避光处理1h,用无菌的磷酸盐缓冲溶液洗涤后重悬菌体至108cfu/mL,备用。
Caco-2细胞的培养:Caco-2细胞在装有DEME细胞培养液(含10%的热灭活胎牛血清、100μg/mL链霉素及100IU/mL青霉素)的无菌细胞培养瓶中,于37℃、5%CO2的恒温培养箱中培养。
黏附试验:取荧光标记的植物乳杆菌MXG-68与Caco-2细胞培养液等体积混匀,以不加菌液的细胞培养液为对照。培养板于CO2恒温培养箱中37℃孵育1h,用无菌的磷酸盐缓冲溶液洗脱未黏附的菌体。加入0.1mL的胰酶,待细胞完全脱落后加入0.4mL完全培养液终止反应,用酶标仪测定细胞悬液的荧光强度,发射光和吸收光波长分别为530nm和485nm。细菌的黏附率(%)=(乳酸菌黏附Caco-2细胞并洗脱后细胞悬液的相对荧光强度/乳酸菌黏附Caco-2细胞前的相对荧光强度)×100%。
1.2.7 抗菌药物的敏感性试验
采用滤纸片法检测植物乳杆菌MXG-68的药敏性,具体操作如下:按1.2.1的方法培养的植物乳杆菌MXG-68菌液均匀涂布于MRS培养基上,静置晾干。用已灭菌的镊子取40种抗菌药物纸片贴于已均匀涂布菌液的MRS培养基表面,37℃培养24h,测定抑菌圈直径。
1.2.8 数据分析
所有的测定数据均重复三次,应用SPSS17.0软件中的One-wayanalysisofvariance(ANOVA)计算标准差。
2 结果与分析
2.1 植物乳杆菌MXG-68的抑菌特性
2.1.1 抑菌谱
由表1和图1可知,植物乳杆菌MXG-68所产的细菌素对革兰氏阳性菌和革兰氏阴性菌均具有抑制作用,是一种广谱细菌素。且发现其对同种指示菌(如金黄色葡萄球菌ATCC12600和PTCC1112,鼠伤寒 沙 门 氏 杆 菌 ATCC13311、CGMCC1.1552和ATCC14028)的抑菌效果亦不同,可能是由于指示菌本身的差异所造成的。目前已报道的可同时抑制革兰氏阳性菌和革兰氏阴性菌的植物乳杆菌并不多,如植物乳杆菌KLDS1.0391、植物乳杆菌LD4和植物乳杆菌KL-1等[12-14]。作为有利于人及动物健康的益生菌,能够产生抗菌物质才能更好地抑制肠道中致病性微生物的生长,减少有害物质的产生,近而提高肠道免疫力及维持肠道菌群平衡。植物乳杆菌MXG-68能够产生广谱细菌素,满足成为益生菌的基本条件之一。
2.1.2 传代稳定性
各代菌株所产细菌素的抑菌活性之间的差异不显著(P>0.05),表现出稳定的遗传特性,其细菌素生产性能基本保持稳定,如图2所示。说明细菌素生产菌株-植物乳杆菌MXG-68具备作为工业生产细菌素出发菌株的前提条件。
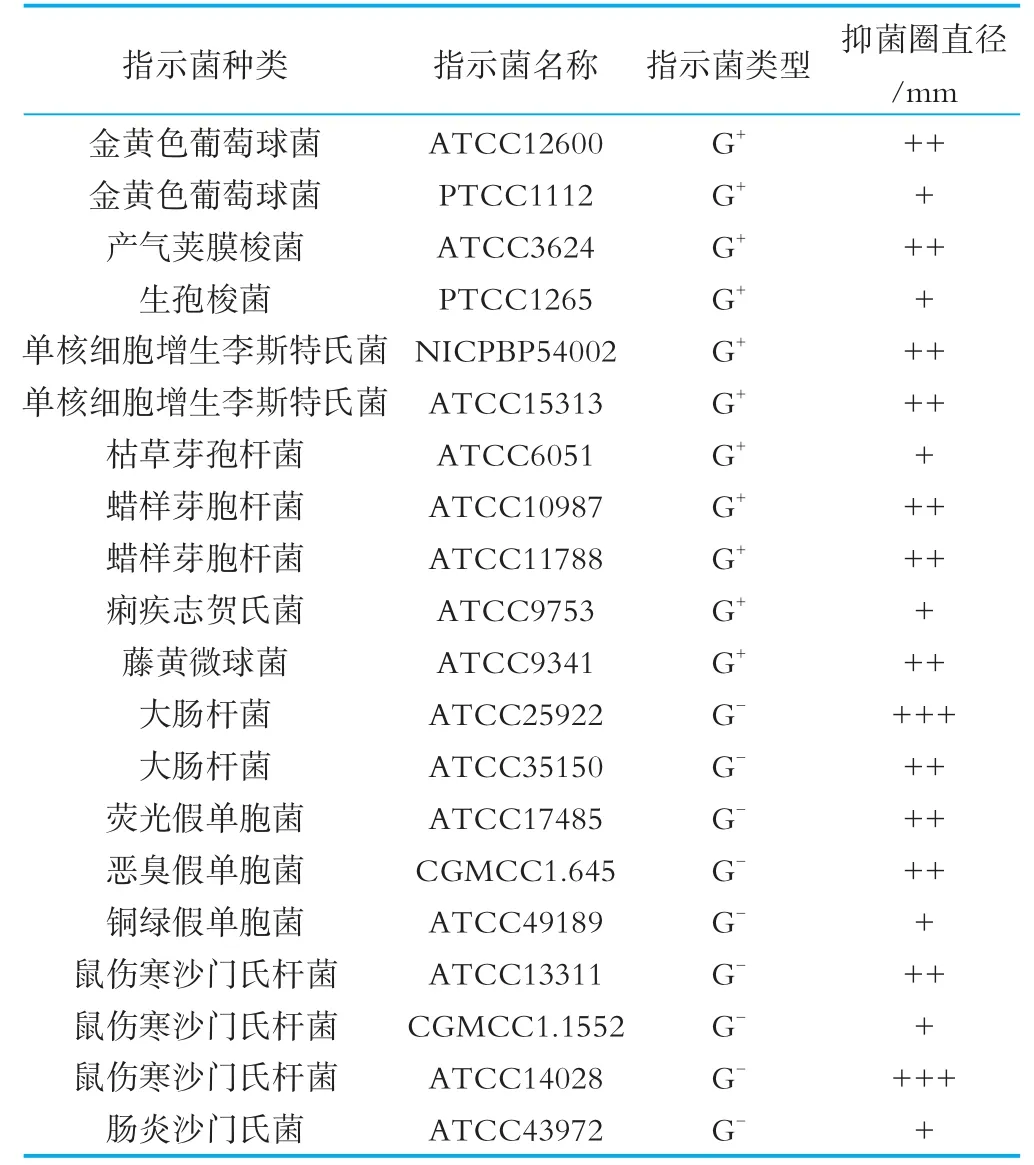
表1 植物乳杆菌MXG-68的抑菌活性

图1 植物乳杆菌MXG-68所产细菌素抑菌圈
2.2 植物乳杆菌MXG-68的动力学曲线
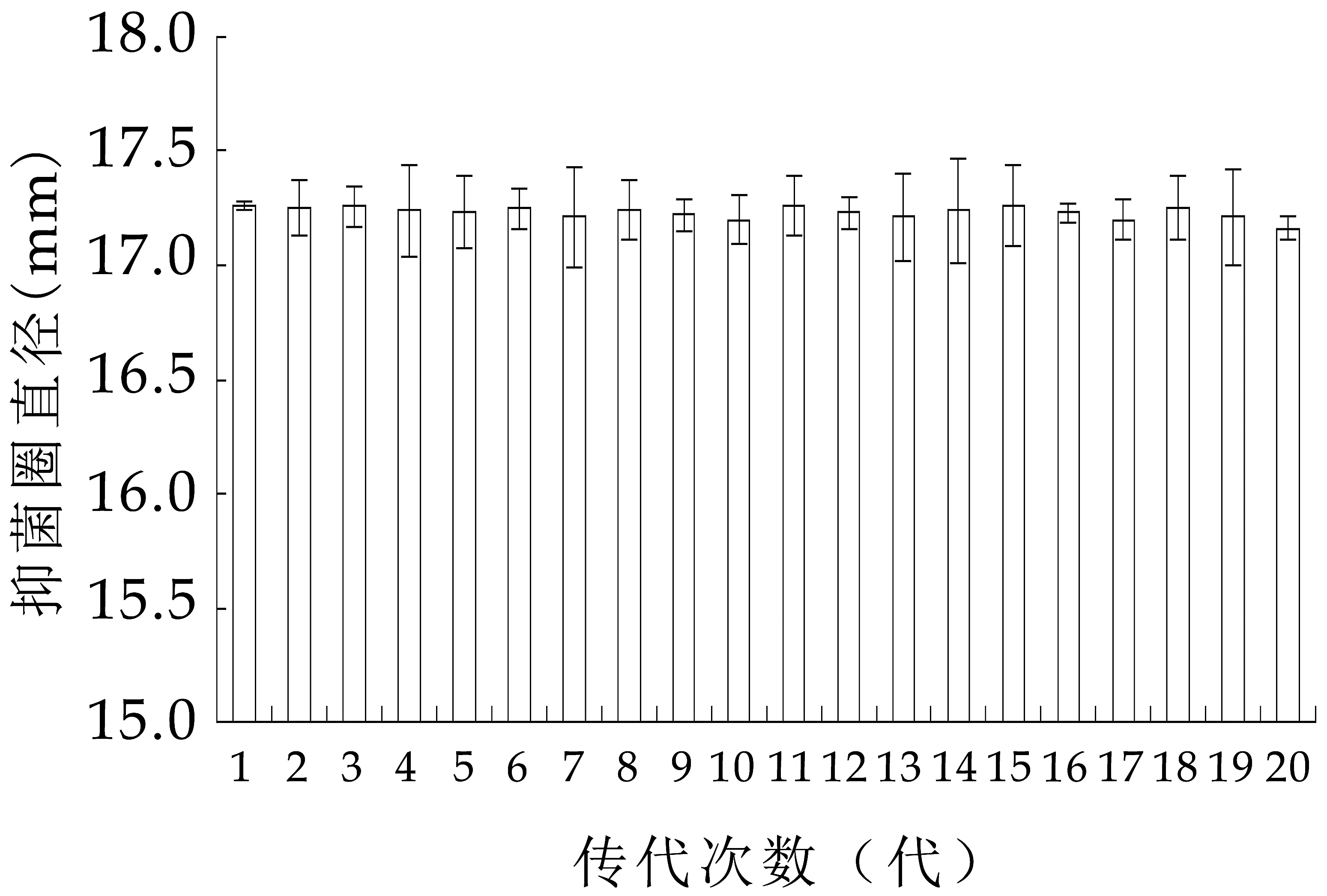
图2 植物乳杆菌MXG-68抑菌活性的传代稳定性
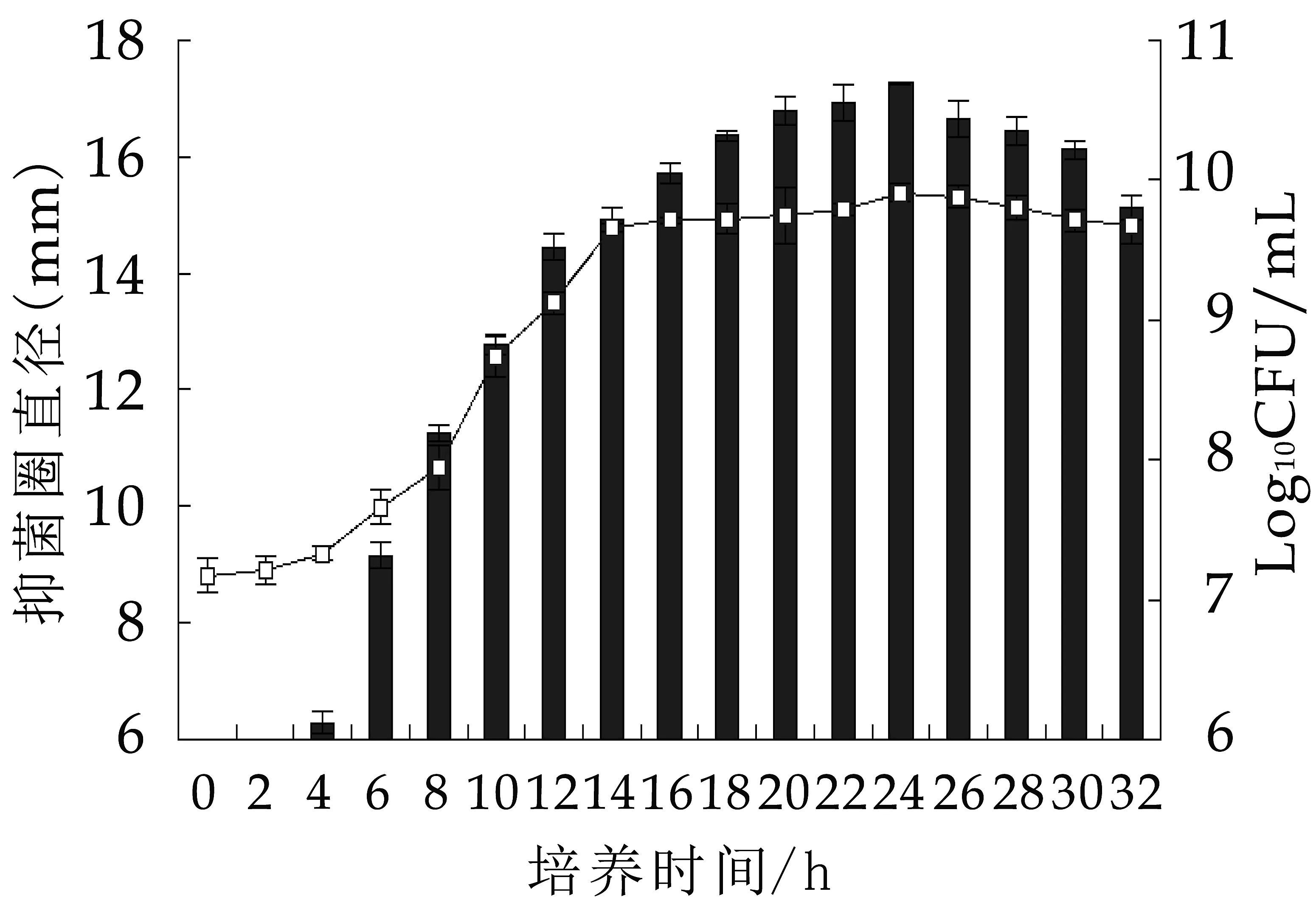
图3 植物乳杆菌MXG-68的生长曲线及发酵曲线
由图3可知,植物乳杆菌MXG-68呈现典型的S型生长曲线,经历一个短暂的延滞期(0~4h),4~14h为对数生长期,14h进入稳定期,24h达到最大生长量。细菌素的合成遵循其生长模型,细菌素合成开始于4 h,在稳定期中部(24 h)达到最大合成量,抗菌活性在4~24 h呈现快速上升趋势,24~32 h呈现缓慢下降趋势。与植物乳杆菌P158相比,植物乳杆菌MXG-68的延滞期较短,菌种活力强,达到最大生长量(提前12 h)和细菌素合成量(提前16 h)的时间短,能有效地提高设备的利用率,适合于工业化应用[15]。
2.3 对人工胃液的耐受性
对人工胃液的耐受性是确保菌株在宿主体内生长和存活的前提,亦是作为益生菌制剂的先决条件。人体及动物胃液的p H一般为1~2,食物在胃中的排空时间一般为4 h,根据此设计植物乳杆菌MXG-68对人工胃液的耐受性试验[16-18]。由图4可知,同一pH条件下,随着培养时间的延长,植物乳杆菌MXG-68的存活率呈现下降趋势。而在同一处理时间内,随着p H的增加,存活率呈现上升的趋势。p H=1的存活率显著低于p H=2~4时的存活率(P<0.01)。所有处理组的存活率均达到47.91%以上,说明植物乳杆菌MXG-68对胃液的耐受性较强。与张开屏的研究结果相类似[19]。
2.4 对人工肠液和胆盐的耐受性
益生菌对肠液及胆盐具有较高的耐受性是发挥益生作用的必要条件,肠液为碱性,p H值一般约为7.6,且正常小肠的胆盐含量为0.03%~0.3%,食物在小肠中的停留时间一般为1~4 h,根据此设计植物乳杆菌MXG-68对人工肠液和胆盐的耐受性试验[20-21]。
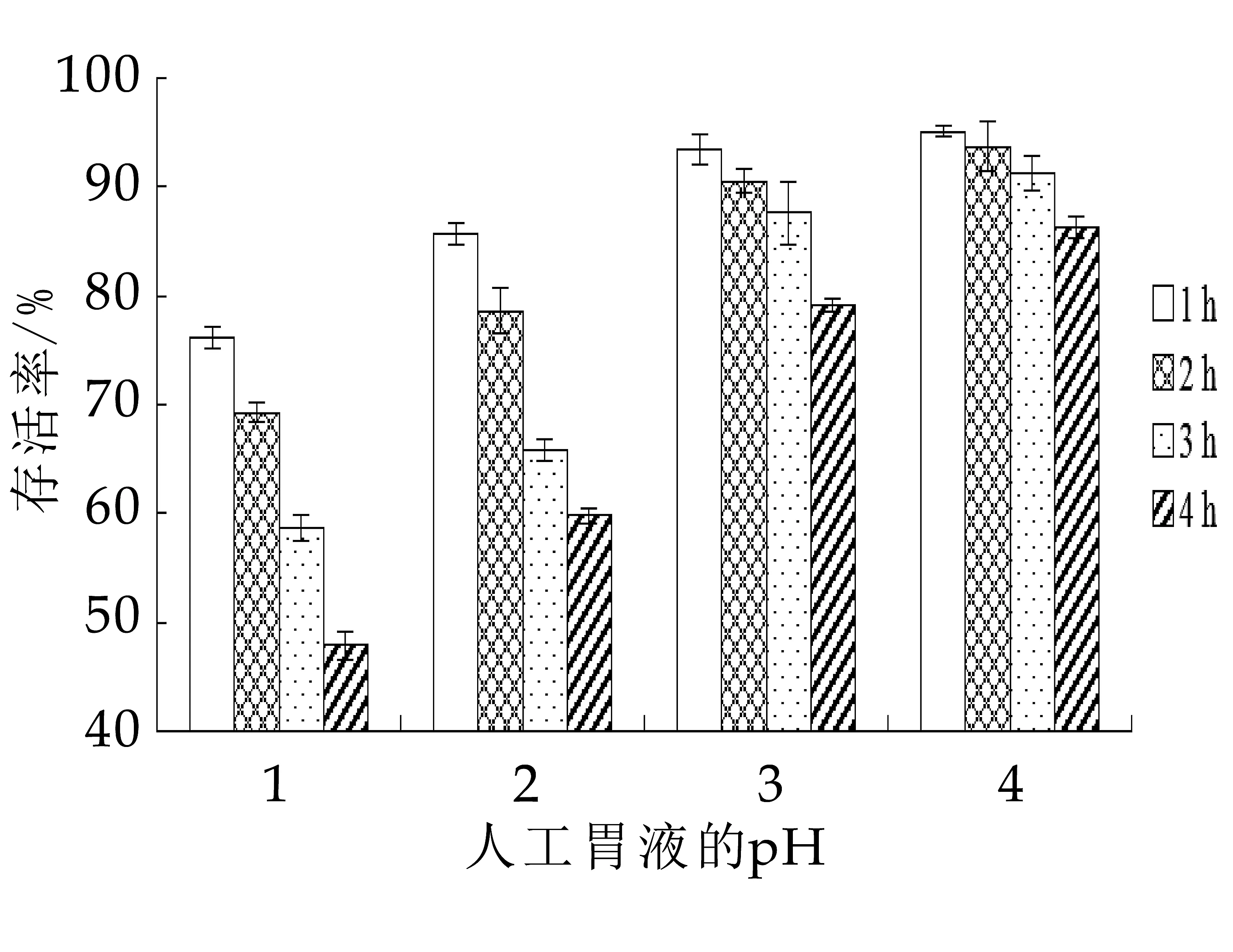
图4 不同pH的人工胃液对植物乳杆菌MXG-68存活率的影响
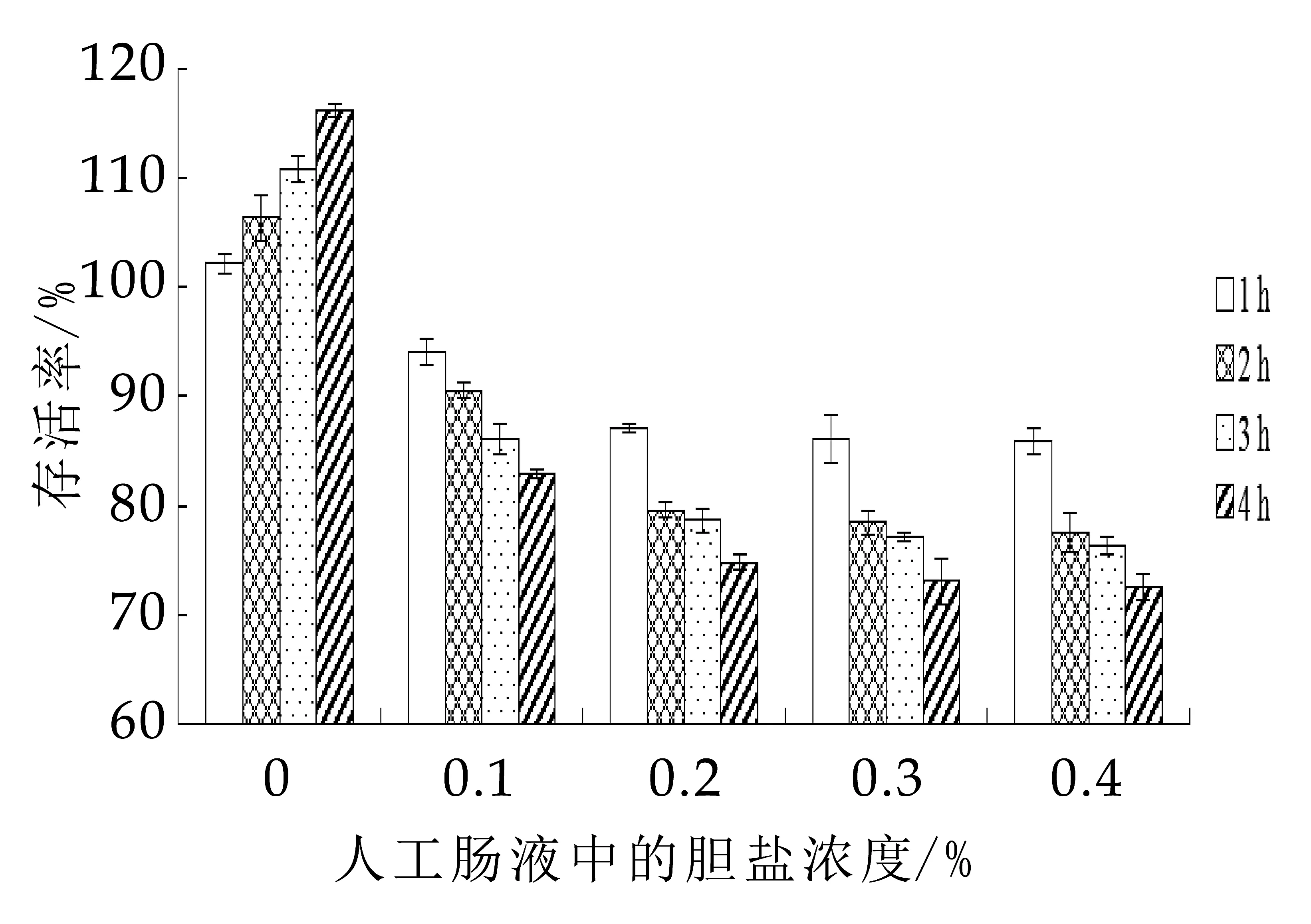
图5 不同胆盐浓度的人工肠液对植物乳杆菌MXG-68存活率的影响
由图5可知,人工肠液和胆盐会导致植物乳杆菌MXG-68的存活率发生不同的变化。枯草芽孢杆菌MX-6在人工肠液对照组的存活率在1~4 h时,呈现上升趋势,此结果与植物乳杆菌R 1对人工肠液的耐受性相吻合。而在0.1%~0.4%胆盐浓度的人工肠液中,随着胆盐浓度的升高,枯草芽孢杆菌MX-6的存活率呈现下降趋势,但胆盐的耐受能力高于植物乳杆菌GF103、植物乳杆菌AR 326及植物乳杆菌DJ-04[22-23]。所有处理组的存活率均达到72.61%以上,说明植物乳杆菌MXG-68对人工肠液和胆盐的耐受性较强。
2.5 植物乳杆菌MXG-68的黏附特性
黏附能力是益生菌定植于宿主肠道并发挥益生作用的前提条件,只有具备高黏附能力才能在适宜条件下迅速繁殖,合成大量的抑菌代谢产物,近而有助于调节胃肠道菌群平衡及激发免疫力。Caco-2细胞的形态及功能与正常小肠上皮细胞很接近,是研究益生菌黏附能力及机制较好的模型[24-26]。将经荧光标记标记的植物乳杆菌MXG-68与Caco-2细胞孵育结束后,经过计算获得植物乳杆菌MXG-68对Caco-2细胞的黏附率高达64%,其黏附率高于周晏阳(42%)和白洁(60%),黏附率不同可能是由于菌株个体差异所造成[27-28]。
2.6 植物乳杆菌MXG-68的耐药性
宿主由于预防或治病为目的会使用抗菌药物,益生菌在应用过程中难免会遇到各种抗菌药物,导致其生长繁殖受到抑制,难以发挥更好的益生作用。且耐药基因存在于质粒上,易出现水平漂移,造成耐药性水平扩散,耐药性是判断菌株是否可成为益生菌制剂的关键条件之一。植物乳杆菌MXG-68对40种抗菌药物表现出敏感性,但敏感的程度不同,对左氧氟沙星表现为低敏,对11中抗菌药物包括头孢噻肟、头孢噻吩、头孢哌酮、头孢唑啉、呋喃妥因、先锋霉素Ⅳ、先锋霉素Ⅴ、先锋霉素Ⅵ、利福平、羧苄青霉素、恩诺沙星表现为中敏,对其他28种抗菌药物均表现为高敏(见表2)。与李平兰、杨建涛的研究结果有所不同[29-30]。
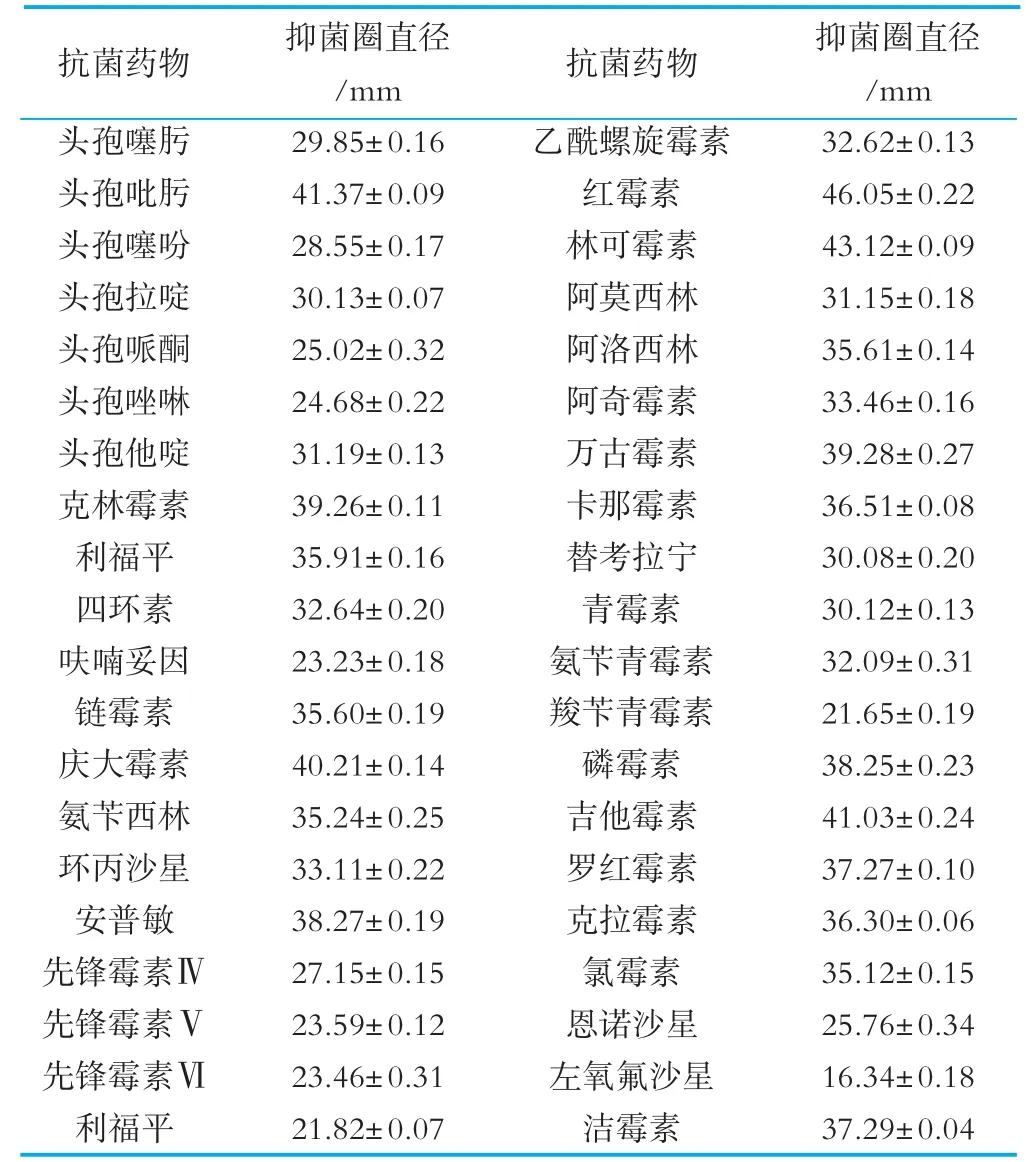
表2 植物乳杆菌MXG-68对40种抗菌药物的敏感性
3 结 论
植物乳杆菌是人及动物肠道中正常的有益菌群之一,是工业生产中选择制备益生菌制剂及食品发酵剂的常用菌种,具有调节肠道菌群平衡、抑制有害菌定植、增强肠黏膜免疫等功能。分析植物乳杆菌的抑菌范围宽窄、耐受性强弱、黏附性强弱及药敏性是益生菌筛选过程中的重要指标,直接决定了其存活率及在肠道停留的时间[31]。本研究综合分析了植物乳杆菌MXG-68的益生特性,结果表明该菌株所产的细菌素同时可抑制革兰氏阳性菌和革兰氏阴性菌,属于广谱细菌素,动力学曲线说明菌株的活力强、达到最大生长量和细菌素合成量所需的时间短,对人工胃液、人工肠液和胆盐具有较强的耐受性,对Caco-2细胞的黏附率高达64%,对40种抗菌药物均表现为敏感。综上所述,植物乳杆菌MXG-68具有作为益生菌的潜力和基本条件,有利于植物乳杆菌及其细菌素作为微生态制剂及新型生物防腐剂的应用,为实现工业化应用奠定基础。

