具有抗氧化功能的副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M9-1的安全性初步评价
王英,范琳琳,施亚萍,李亚辉,王帆,周剑忠
(1.江苏省农业科学研究院农产品加工研究所南京210014;2.南京市脆而爽蔬菜食品有限公司南京211225)
0 引 言
乳酸菌主要来源于传统发酵食品(乳制品、开菲尔、发酵茶、发酵肉、泡菜等),也是肠道微生物的重要菌群。研究表明,乳酸菌具有多种功能作用,在机体的氧化应激、胆固醇降解、免疫力调节、炎症抵抗、肠道菌群的平衡调节和病原菌抑制等方面发挥着重要作用[1-2]。
乳酸菌对发酵制品的风味、感官、质地等方面也发挥这个重要作用[3]。但是也有研究结果显示,有些乳酸菌具有抗生素抗性,甚至出现了多重耐药性[4]。而经过乳酸菌发酵的产品和益生菌制剂一般不再经过二次消毒即可直接食用,如果乳酸菌含有可转移的抗药基因,就可能作为传播的媒介将抗性基因转移给其他肠道细菌,进而对人体健康造成危害。
目前我国没有相关乳酸菌安全性评价的相关准则,但乳酸菌菌株是否有毒性及有害代谢产物检测、耐药性检测、对机体的内在影响等研究也是必不可少的。副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M 9-1来源于传统自然发酵奶食品,具有优良的体外和体内抗氧化能力、发酵性能和抗逆能力,具有潜在的应用价值和前景[5-6]。本研究对两菌株进行耐药性实验、机体指标和有害代谢产物的评价实验以及急性毒理实验,利用体外实验评价这两株菌的安全性,为其以后的开发和应用提供理论的参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株与小鼠
副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M 9-1由江苏省农业科学院农产品加工研究所食品工程研究室保存。
实验动物采用SPF(Specific pathogen-free)级昆明种小鼠,雄性ICR(Institute of Cancer Research),体重20±2 g,由扬州大学动物中心提供(Scxk苏2012-0004)。实验动物普通饲料由青龙山饲料物厂提供。
仪器与试剂:UV-1600PC紫外分光光度计,上海美普达科技有限公司;DYCP-电泳仪,北京六一仪器公司;GIS3500凝胶成像仪,上海天能仪器有限公司;SW-CJ-1C型双人单面净化工作台,苏州净化设备有限公司;SIGMA3K-15台式冷冻离心机,北京五洲东方科技发展有限公司;124S-CW分析天平,赛多利斯科学仪器(北京)有限公司;TOMY SX 500自动灭菌锅,日本Tomy Digital Biology公司。
质粒小量提取试剂盒(DP103),购自Qiagen公司;药敏纸片(链霉素、氨苄西林、万古霉素、四环素、氯霉素、庆大霉素、利福平、多粘菌素、青霉素G、环丙沙星和红霉素),购于杭州滨和微生物试剂有限公司;胰酶、胆盐、L-酪氨酸二钠盐、L-组氨酸盐酸盐、L-鸟氨酸盐酸盐和L-赖氨酸盐酸购自阿拉丁;血平板购自南京便诊生物科技有限公司;其他所用化学试剂均为分析纯级化学试剂,购自南京卓越生物工程有限公司。
1.2 方法
1.2.1 小鼠饲养
小鼠适应一周后,称重,然后随机分成3组(每组10只)。将小鼠同室分笼喂养,采用自然光照,自由采食和饮水。饲养环境温度25±2℃,相对湿度60%。
1.2.2 FM-M 9-1和FM-LP-4培养及菌体处理
无菌条件下,从新鲜培养的FM-M 9-1和FM-LP-4的平板上挑取单菌落至MRS液体试管中,37℃条件下静止培养18~20 h至稳定初期,按3%的接种量转接到含有150 mL MRS液体培养基的三角瓶中培养18 h,上述培养好的菌液5 000 r/m离心5 min收集菌体,用生理盐水洗2次后重悬菌体,调整菌体密度(5.01±0.05)×109CFU/mL,备用。
1.2.3 急性毒理实验
将经过适应性喂养的清洁级昆明雄性小鼠随机分成3组,每组10只。分别编号为FM-M 9-1实验组、FM-LP-4实验组和对照组。将制备好的菌液按每只0.2 mL/10 g体重的剂量进行灌胃,一日3次,每次间隔3 h。对照组灌胃相同量的生理盐水。观察7日内小鼠的活动状态,灌胃结束后称重并用颈椎脱臼法处死小鼠,计算小鼠的肝脏系数和肾脏系数。
1.2.4 FM-M 9-1和FM-LP-4的药敏性测定
耐药性试验:采用药敏纸片扩散法行药敏试验,本实验中选取常见的11种药敏纸片,包括链霉素、氨苄西林、万古霉素、四环素、氯霉素、庆大霉素、利福平、多粘菌素、青霉素G、环丙沙星和红霉素。以大肠杆菌ATCC25922,金黄色葡萄球菌ATCC25923作为质控标准菌。取100μL FM-M 9-1和FM-LP-4菌液分别涂布于MRS固体培养基平板上,待菌液被培养基完全吸收后,将药敏纸片放于培养基上,静置20 min后,倒置放于37℃培养箱中培养20 h后,测量并记录各药敏纸片的抑菌圈直径大小。
1.2.5 FM-M 9-1和FM-LP-4质粒提取
取1.5 m L培养好的菌液,使用TIANGEN质粒小提试剂盒(DP103)提取质粒。提取步骤参照说明书。在菌体破壁处理步骤中,加入溶菌酶。提取样品用琼脂糖凝胶电泳检测,以含有PMG36e质粒的乳酸乳球菌1363为阳性对照。
1.2.6 FM-M 9-1和FM-LP-4生物膜性能测定
菌株的形成生物膜的能力测定的方法参照文献[7]进行,稍作修改,具体方法如下:分别挑取新鲜培养的FM-M 9-1和FM-LP-4的单菌落接种到含有0.25%(m/m)葡萄糖的MRS液体培养基中,30℃条件下培养18~20 h,然后用质量分数0.25%葡萄糖的MRS液体培养基稀释20倍,之后取200μL接种到无菌的96孔板中,37℃条件下培养24 h,用无菌的PBS(p H 7.2~7.4)缓冲液冲洗96孔板,倒置干燥后用1%的结晶紫染色15 min,再次用PBS缓冲液冲洗后加入甲醇和乙醇混合液(80∶20,体积比)溶解,在595 nm条件下测定吸光值。生物膜形成能力采用下面的表示方法表示,吸光值小于1,无成膜能力,吸光值介于1~2之间,成膜能力弱,吸光值在2~3之间,成膜能力中等,吸光值大于3,成膜能力强。
1.2.7 FM-M 9-1和FM-LP-4溶血特性测定
菌株的溶血特性实验的方法参照文献[8]进行,稍作修改。具体方法如下,分别从培养48 h的平板上挑取FM-M 9-1和FM-LP-4单菌落无菌条件下划线接种于含有7%羊血的血平板上,以金黄色葡萄球菌和表皮葡萄球菌为对照,其中金黄色葡萄球菌为β-型,表皮葡萄球菌为γ-型。37℃培养72 h观察溶血圈,菌落周围没有明显变化,其溶血型为γ-型,参照表皮葡萄球菌的溶血现象;在菌落周围有明显的溶血圈的为β-型,参照金黄色葡萄球菌的溶血现象;菌落周围呈现墨绿色为α-型。
1.2.8 FM-M 9-1和FM-LP-4产生物胺性能测定
检测菌株FM-M 9-1和FM-LP-4产生物胺的方法参照文献[9]进行,稍作修改。具体操作方法如下:将FM-M 9-1和FM-LP-4接种至分别含有0.1%(质量分数差)的氨基酸前体(L-酪氨酸二钠盐、L-组氨酸盐酸盐、L-鸟氨酸盐酸盐和L-赖氨酸盐酸盐)的MRS液体培养基中,连续培养10次,以诱导产生脱羧酶。诱导结束后,将菌株在分别含有1%的氨基酸(酪氨酸、组氨酸、鸟氨酸和赖氨酸)的脱羧酶培养基上,以不含氨基酸的脱羧酶培养基作为对照,平板在37℃条件下培养4 d,菌体周围颜色变紫的菌株具有脱羧酶活性,颜色与不含氨基酸的脱羧酶培养基上相同的菌株不具有脱羧酶活性。
1.2.9 FM-M 9-1和FM-LP-4有害代谢产物评价试验
1.2.9.1 吲哚实验。
将活化好的FM-M 9-1和FM-LP-4菌株按2%的接菌量分别接入到蛋白胨水培养基中。37℃培养72 h,加入吲哚试剂8~10滴,观察实验结果。同时做空白实验。
1.2.9.2 硝酸盐还原酶活性检测。
将活化好的FM-M 9-1和FM-LP-4菌株按2%的接菌量分别接入到硝酸盐培养基中37℃培养5 d后,滴加碘化钾和淀粉溶液各10滴,观察实验结果。同时做空白实验。
1.2.9.3 产偶氮还原酶能力的测定。
将过夜活化的FM-M 9-1和FM-LP-4菌液涂布于含有5 mg/L直接蓝71的MRS固体培养基上,置于37℃培养72 h,观察水解圈的产生情况。
1.3 数据分析
实验重复3次,实验结果采用 SPSS 13.0和One-Way(ANOVA)进行统计和显著性分析。
2 结果与讨论
2.1 急性毒理实验
灌胃的7 d内,小鼠的进食、饮水和活动正常,无异常行为,皮毛正常。体重结果显示,实验组的小鼠体重正常,与对照组无显著差异性(见表1)。实验组小鼠的肝脏器系数和肾脏器系数与对照组相比没有明显差异(P>0.05)。
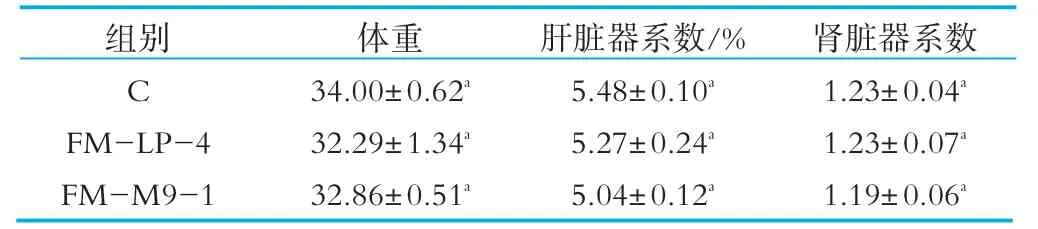
表1 体重和脏器系数(肝和肾)
2.2 耐药性评价试验
随着乳酸菌安全性研究成为关注的热点,乳酸菌对抗生素抗性的研究逐渐增多。本试验测定了FM-M 9-1和FM-LP-4菌株对11种抗生素的敏感性,结果显示:FM-M 9-1和FM-LP-4菌株都对万古霉素、庆大霉素和多粘菌素具有抗性,对其他抗生素都具不同程度的有敏感性,具体结果见表2。
2.3 菌株FM-M 9-1和FM-LP-4质粒提取
肠球菌的抗药基因是乳酸菌抗药性的研究热点,例如红霉素、万古霉素、四环素、氯霉素和庆大霉素耐药相关的基因,这些基因位于可转移性遗传物质上[10]。本研究利用提取试剂盒提取菌株FM-M 9-1和FM-LP-4的质粒,通过琼脂糖凝胶电泳做质粒检测,检测结果显示两菌株所在泳道均未出现荧光条带(见图 1),可以认定FM-M 9-1和FM-LP-4不含有耐药质粒。耐药基因可能存在于细菌DNA上,即不携带有可转移的耐药基因。

表2 FM-M9-1和FM-LP-4药敏试验结果
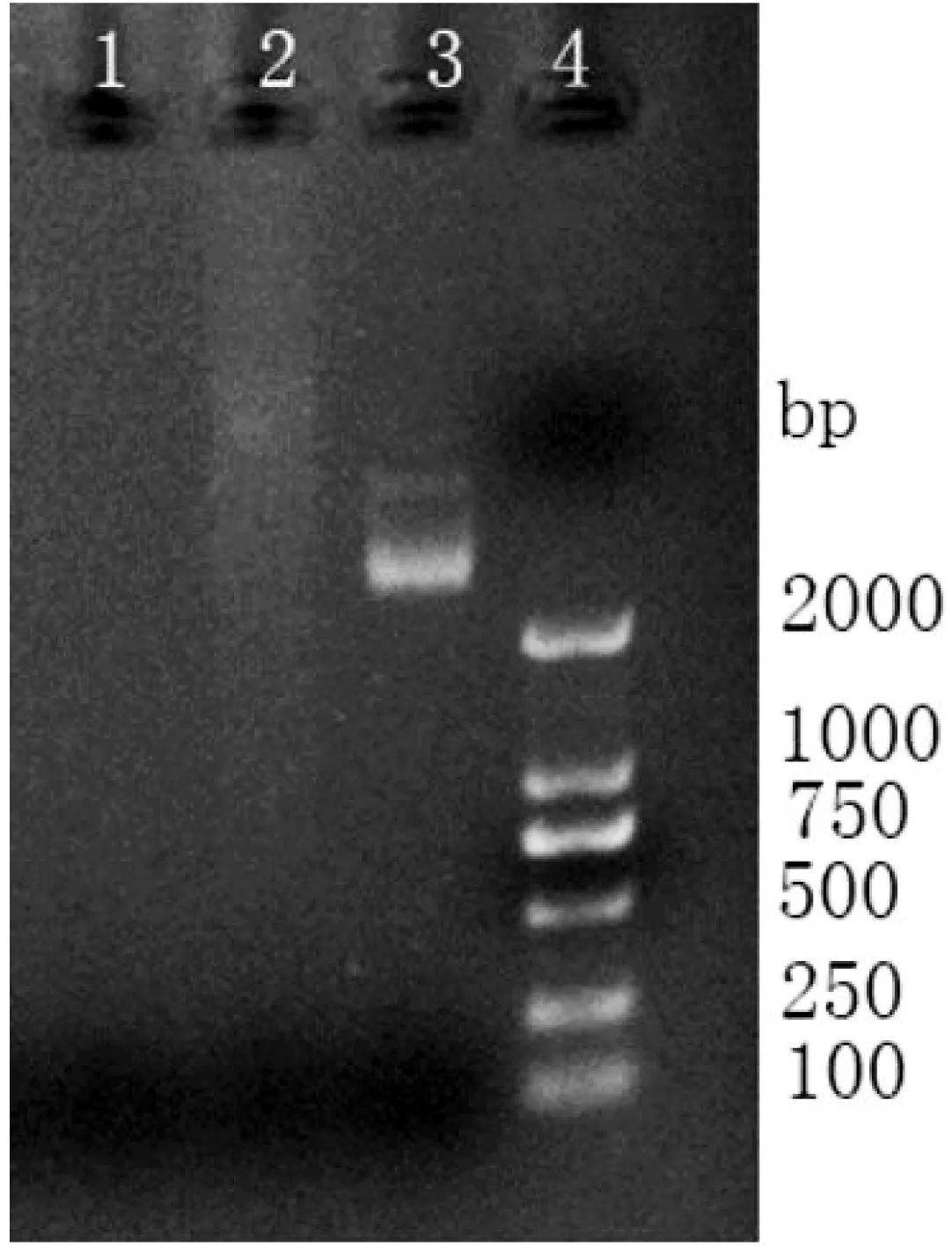
图1 质粒提取试验结果
2.4 菌株FM-M 9-1和FM-LP-4的溶血特性分析
溶血现象的发生可能是由于溶血性细菌侵入引起的,严重时导致败血症的发生。不具有溶血活性是乳酸菌作为安全菌株筛选和使用的一个重要条件[11]。本研究对FM-M 9-1和FM-LP-4的溶血活性进行了研究,研究结果显示,FM-M 9-1和FM-LP-4在7%羊血平板上,37℃培养72 h后长出菌落的周围没有明显变化,说明这两株菌溶血型为γ-型,不具有溶血活性。Maragkoudakis等对干酪乳杆菌和副干酪乳杆菌的溶血特性研究结果显示,菌株大部分是γ-型,少部分是a-型[12]。
2.5 菌株FM-M 9-1和FM-LP-4的生物胺产生能力
正常量的生物胺具有重要的生理作用,是激素、核酸、生物碱等物质的前体,具有维持免疫系统代谢活性和正常的内脏功能,但当超过一定的量就会对人体产生毒副作用[13]。2011年10月欧盟食品安全局(EFSA)发布关于“发酵食品中生物胺”的科学意见,认为组胺和酪胺是最具毒性。另外,生物胺之间的毒性具有协同增加作用。二胺和多胺会抑制单胺的代谢,进而使毒性增强。脱羧酶是生物胺形成过程中的主要酶,因此,检测乳酸菌中是否具有氨基酸脱羧酶活性是乳酸菌应用的一个主要指标。本实验中对FM-M 9-1和FM-LP-4的脱羧酶活性进行检测。检测结果显示,平板在37℃条件下培养4 d,FM-M 9-1和FM-LP-4菌体周围与不含氨基酸的脱羧酶培养基上相同,表明菌株FM-M 9-1和FM-LP-4没有本研究内容中所包含的4种脱羧酶活性。
2.6 菌株FM-M 9-1和FM-LP-4形成生物膜能力
在食品工业中,从卫生和安全的角度来看,菌株成膜是不利因素。因为成膜可以导致食品污染,同时成膜给病原微生物粘附到食品表面提供有利条件。有研究对乳酸菌一些菌株的形成生物膜的能力及相关的功能基因进行报道[14]。本研究中的FM-M 9-1和FM-LP-4的成膜结果显示,两株菌的595 nm的值小于1,无形成生物膜的能力。
2.7 菌株FM-M 9-1和FM-LP-4有毒代谢产物检测
本研究测定了FM-M 9-1和FM-LP-4菌株的有毒代谢产物吲哚类物质、硝酸盐还原酶和产偶氮还原酶能力(见表3)。吲哚实验可以检测菌株是否能分解蛋白质中的色氨酸。色氨酸为人体必需氨基酸,参与人体蛋白质合成、调节免疫功能和促进消化。色氨酸代谢过程发生障碍会引起肝功能衰退、恶性肿瘤等[15]。从表中可以看出,FM-M 9-1和FM-LP-4的代谢产物中没有吲哚类物质。硝酸盐还原酶可以将食物中含有的硝酸盐还原为亚硝酸盐,亚硝酸盐是强致癌物亚硝胺的前体物质,与食品中蛋白质分解中间产物仲胺反应形成亚硝胺,后者可诱发多种癌症如肝癌、胃癌、食道癌和咽癌等[16],从表中可以看出,FM-M 9-1和FM-LP-4菌株都不含有硝酸还原酶或硝酸还原酶无活性。部分乳酸菌代谢产物中含有偶氮还原酶,能够催化偶氮键(R 1-N=N-R 2)断裂。研究结果显示,机体内微生物代谢产物偶氮还原酶也能还原成某些物质为致突变剂或致癌物质[17]。研究结果显示,FM-M 9-1和FM-LP-4菌株都不含有偶氮还原酶或偶氮还原酶无活性。

表3 FM-M 9-1和FM-LP-4有毒代谢产物试验结果
3 结果与讨论
随着对乳酸菌研究的深入,发掘出越来越多的功能特性。目前乳酸菌除了应用到发酵食品中,在微生态益生制剂中的应用也越来越多广泛。虽然大量文献证明,大多数乳酸菌菌株或使用乳酸菌进行食品发酵是安全可行的,但也有少量研究结果显示能够从一些患者体内分离出乳酸菌,可能与尿道感染、心内膜炎等疾病有关[18]。因此,对新筛选出的拟作为食品发酵剂或益生菌剂的乳酸菌进行安全性评价是十分必要的,尤其是用于食品的菌株[19]。乳酸菌的耐药性是目前乳酸菌安全性评价中关注的一个内容,研究结果显示有些乳酸菌对氨基糖苷类、萘啶酸类、万古霉素类、头孢霉素类等抗生素药品有抗性[20]。乳酸菌本身具有的一些固有抗性是有益的,能够作为益生菌剂在肠道菌群调节中发挥作用。但是携带质粒的具有抗药性的乳酸菌,有可能作为传播媒介把抗性基因转移给其他肠道细菌,导致超级细菌的产生,进而对人体健康造成危害[4]。但本实验中副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M 9-1菌株具有万古霉素、庆大霉素和多粘菌素抗性,但没有提取耐药质粒。该研究中菌株的抗药性选择了一些常规的抗生素测定其抗性,对其他的抗生素是否具有抗性在后续的研究中需要继续。
副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M 9-1是来源于新疆传统发酵骆驼奶的两株乳酸菌,均具有优良的抗氧化功能,具有良好的加工稳定性[5-6]。本研究对副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M 9-1安全性进行初步评价,结果显示这两株菌均不具有硝酸盐还原酶活性、偶氮还原酶活性和氨基酸脱羧酶活性(酪氨酸、组氨酸、鸟氨酸和赖氨酸)。形成生物膜能力都比较弱。为了提供更加全面的安全性指标,对菌株的抗药性基因和有毒基因的检测仍需要继续研究。另外,利用动物体内实验评价副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M 9-1的安全性也是后续的研究重点。

