发酵乳杆菌RC4对咸肉亚硝酸盐含量及挥发性风味物质的影响
田启远, 王晓萌, 叶聪艳, 潘 晴, 曾小群*, 潘道东, 沈建良
发酵乳杆菌RC4对咸肉亚硝酸盐含量及挥发性风味物质的影响
田启远1,2,3, 王晓萌1,2,3, 叶聪艳1,2,3, 潘 晴1,2,3, 曾小群1,2,3*, 潘道东1,2,3, 沈建良4
(1.农产品质量安全危害因子与风险防控国家重点实验室, 浙江 宁波 315832; 2.浙江省动物蛋白食品精深加工技术重点实验室, 浙江 宁波 315832; 3.宁波大学 食品与药学学院, 浙江 宁波 315832; 4.浙江卓旺农业科技有限公司, 浙江 湖州 313014)
为降低咸肉中亚硝酸盐含量, 将具有高效降解亚硝酸盐的发酵乳杆菌RC4应用于咸肉制作中, 研究其对咸肉亚硝酸盐含量、品质和风味的影响. 通过单因素实验及正交实验, 对添加发酵乳杆菌RC4的实验组咸肉制作工艺进行优化, 比较接菌组和未接菌发酵对照组在感官评分、亚硝酸盐含量、pH、色差、水分、硫代巴比妥值及挥发性风味成分的差异. 结果表明: 实验组咸肉亚硝酸盐含量降解显著, 降解率为78.60%; 实验组咸肉的最佳发酵条件为接种2.0%(μL·mL-1)的发酵乳杆菌RC4菌液, 18℃发酵10d. 与对照组相比, 实验组咸肉pH降低; 色差及水分含量与对照组差异不显著(>0.05); TBA值的变化量明显小于对照组(<0.05). 在鉴定出的87种挥发性物质中, 庚醛为RC4发酵产生, 苯甲醛等的含量显著高于对照组, 而这几种醛均为特征风味化合物. 由此可知, 在咸肉制备工艺中, 添加发酵乳杆菌RC4能显著降低咸肉的亚硝酸盐含量, 提高咸肉保质期, 增加其特征风味化合物含量.
发酵乳杆菌RC4; 咸肉; 亚硝酸盐含量; 理化指标; 挥发性风味物质
咸肉是我国传统的腌腊肉制品, 历史悠久, 风味独特, 营养丰富, 便于储藏, 深受消费者青睐[1]. 在咸肉加工中, 常使用亚硝酸盐作为添加剂, 其具有发色、保持风味、抗氧化和抑制革兰氏阳性菌生长等特性[2-5]. 但过量食用亚硝酸盐含量超标的咸肉, 会引发高铁血红蛋白症, 并且亚硝酸盐能在体内形成亚硝胺, 诱发机体癌变[6]. 生产中即使按照国家规定标准使用亚硝酸盐, 也会造成肉类制品中亚硝酸盐残留量较高[7]. 因此, 亚硝酸盐残留量高已成为传统腌腊肉制品生产的瓶颈问题, 严重制约了我国腌腊肉制品产业的发展.
乳酸菌是一种常用的食品发酵添加菌, 安全有益, 其代谢产物可以使发酵食品产生良好的风味和口感, 并降低pH, 抑制有害菌种的生长, 因此常常把它作为自然降解亚硝酸盐的理想菌株[8]. 乳酸菌可产生亚硝酸盐还原酶, 催化亚硝酸盐还原, 进而降解亚硝酸盐[9]. 本课题前期研究从新疆酸马奶中筛选出一株具有高效降解亚硝酸盐的发酵乳杆菌RC4, 其在含150mg·L-1亚硝酸盐的培养基中, 19℃培养14h, 可降解82%的亚硝酸盐[10]. 本实验将发酵乳杆菌RC4应用于咸肉发酵中, 研究其对亚硝酸盐降解和咸肉储存性及品质风味的影响, 为制备低亚硝酸盐含量的腌腊肉制品提供技术支持和研究基础.
1 材料与方法
1.1 材料与试剂
新鲜猪肉: 购于宁波大学农贸市场; 发酵乳杆菌() RC4(CGMCC NO.8212): 本实验室保存; NaNO2: 国药集团化学试剂有限公司; 吐温80: 北京索莱宝生物科技有限公司; MRS培养基: 杭州微生物试剂有限公司; TBA检测试剂盒: 杭州江莱生物研究所; 亚硝酸盐检测试剂盒: 广州益满生物科技有限公司.
1.2 仪器与设备
磁力搅拌器HJ-4: 常州申光仪器有限公司; SPME手动进样手柄、75μm CAR/PDMS萃取头: 美国Supelco公司; 7890A-5975C气相色谱-质谱联用仪: 美国Agilent公司; CR 400色差仪: 日本柯尼卡美能达; PL403电子天平: 梅特勒-多利托仪器有限公司; LDZX-50KB立式压力蒸汽灭菌锅: 上海申安医疗器械厂; JB090312-02净化工作台: 苏州华科净化设备有限公司; H2050R-2离心机: 长沙湘仪离心机仪器有限公司; pH计: 梅特勒-托利多仪器上海有限公司.
1.3 方法
1.3.1 菌种扩大培养
取-80℃冰箱保存的发酵乳杆菌RC4活化, 以1%的接种量接种至MRS培养基中, 19℃培养12~ 14h, 2次扩大培养后, 离心收集菌体, 弃培养基, 加生理盐水重悬菌液至原培养基的体积, 于波长600nm测量菌悬液吸光度OD值.
1.3.2 咸肉的腌制
将新鲜猪肉修整后切成为15cm×10cm×2 cm(长×宽×高)的方块, 向原料肉中添加5%的食盐和150mg·kg-1亚硝酸钠[11], 在肉表面均匀擦透, 喷洒菌悬液发酵作为实验组(对照组喷洒相同体积的生理盐水), 腌制12h, 吊挂风干1d.
1.3.3 咸肉的感官评定及亚硝酸盐含量测定
培训10名食品专业学生, 组成感官评定小组, 对煮熟后的咸肉分实验组和对照组进行品尝, 按表1进行感官评分, 并测定亚硝酸盐含量. 感官评定标准在GB 2730-2015[12]的基础上略有改动.
1.3.4 咸肉发酵单因素实验
按照1.3.2的方法制备咸肉, 在预实验基础上进行以下单因素实验. (1)接菌量的优化: 接种量分别为1.4%, 1.6%, 1.8%, 2.0%, 2.2%(μL·mL-1), 19℃发酵8d; (2)发酵温度的优化: 将1.8%(μL·mL-1)发酵乳杆菌RC4菌液喷洒于咸肉中, 于14, 16, 18, 20, 22℃下发酵8d; (3)发酵时间的优化: 以1.8%的接种量, 19℃分别发酵7, 8, 9, 10, 11d. 各对照组咸肉喷洒与菌液相同体积的生理盐水制备. 以此确定最适接种量、发酵温度、发酵时间.
1.3.5 正交实验
由单因素实验结果设计正交试验, 分别测定咸肉的感官评分与亚硝酸盐的含量.
1.3.6 咸肉的验证实验
由正交实验得到的最佳发酵条件, 对咸肉亚硝酸盐含量和感官评分进行验证实验.
1.3.7 咸肉色差的测定
随机选取咸肉任一切面的3个点, 使用色差仪对咸肉的L、a、b值进行检测. 其中,L为明度系数, 变化范围为0~100,L值等于0代表黑色,L值等于100代表白色, 在0~100之间为不同的亮度值; +a值代表红色, -a值代表绿色; +b值代表黄色, -b值代表蓝色.
1.3.8 pH值的测定
称取10g剪碎后的咸肉样品置于50mL离心管中, 加10mL蒸馏水, 匀浆1min, 测定pH值.
1.3.9 水分的测定
参照邢宝田等[13]方法, 称取剪碎后的咸肉样品10g, 置于水分分析仪, 测定咸肉的水分含量.
1.3.10 硫代巴比妥酸值的测定
参照Witte等[14]的方法, 将肉匀浆后过滤, 测定咸肉滤液的硫代巴比妥酸(TBA)值.
1.3.11 挥发性风味物质的测定
挥发性风味成分的提取: 称4.0g切碎的咸肉样品, 放入20mL顶空样品瓶内. 样品瓶通过聚四氟乙烯/硅胶隔膜使其保持密封状态. 在45℃条件下, 平衡25min, 再用75μm CAR/PDMS的萃取头4℃顶空吸附40min. 萃取头在第1次使用前, 需在220℃下老化2h, 采用SPME-GC-MS对咸肉挥发性风味进行分析.

表1 咸肉的感官评分标准
挥发性风味成分的检测及分析: 采用SPME- GC-MS分析咸肉的挥发性风味化合物, GC-MS条件参照周昌瑜等[15]的方法.
挥发性物质分析: 质谱数据测量依据NIST和WILEY 7.0, 相似指数高于80(最大值为100)确认为鉴定化合物.
1.3.12 统计分析
上述实验均重复3次, 每次3组平行, 运用IBM SPSS Statistics 21统计软件进行单因素方差数据分析, 以Mean±SD表示, 使用Origin Graph对试验结果分析作图.
2 结果与分析
2.1 咸肉发酵单因素实验结果
2.1.1 接种量()优化结果
接种1.4%, 1.6%, 1.8%, 2.0%, 2.2%发酵乳杆菌RC4菌液的实验组咸肉亚硝酸盐降解率分别为65.5%, 72.3%, 71.53%, 85.0%, 71.2%; 而各对照组对应时间的亚硝酸盐降解率分别为-4.6%, -2.8%,-6.1%, 0.6%, 10%(图1(a)), 差异极显著(<0.01). 其中, 接种量为2.0%(μL·mL-1)的咸肉亚硝酸盐降解率最高.
2.1.2 发酵温度()优化结果
在14, 16, 18, 20, 22℃下发酵的实验组咸肉, 其NaNO2的降解率分别为27.9%, 28.97%, 55.1%, 33.86%, 31.1%, 而对照组在对应时间降解率分别为-1.01%, -10.7%, 10.57%, -3.89%, 4.0%(图1(b)), 差异显著(<0.05). 可见发酵乳杆菌RC 4在18℃亚硝酸盐降解率最高.
各对照组咸肉的亚硝酸盐含量不减少反而增加, 原因可能是咸肉中的硝酸盐在细菌作用下还原成亚硝酸盐, 增加了其亚硝酸盐含量, 因而降解率为负值[16].
2.1.3 发酵时间()优化结果
实验组咸肉在发酵7, 8, 9, 10, 11d的时间内, 亚硝酸盐降解率分别为51.23%, 46.23%, 35.6%, 73.63%, 52.04%(图1(c)), 而对照组咸肉在其相对应时间的降解率分别为-7.8%, -9.6%, 1.0%, -7.8%, 0.63%. 由此表明, 加菌发酵的咸肉亚硝酸盐降解率高于对照组(<0.05), 发酵10d亚硝酸盐降解率最高.
2.1.4 咸肉发酵工艺优化的正交试验结果
由表2和表3获得最优降解亚硝酸盐实验方案:222, 即发酵温度18℃, 接种量为2.0%, 发酵时间10d. 得到影响亚硝酸盐降解率和感官评分因子主次顺序为:>>, 即接种量>温度>时间.
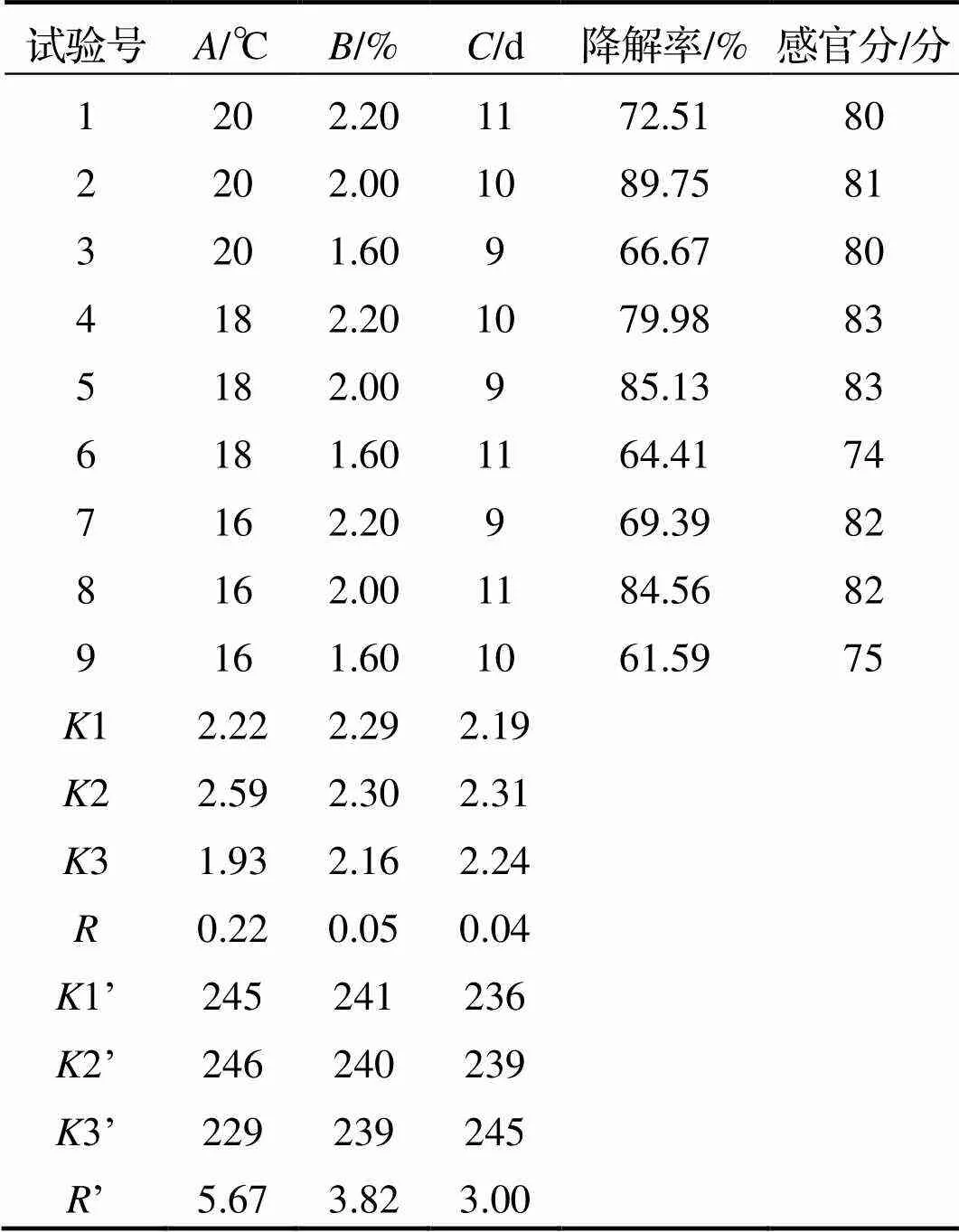
表2 咸肉发酵工艺优化L9(34)正交试验结果
注:、为亚硝酸盐对应数值;’、’为感官评分对应数值.
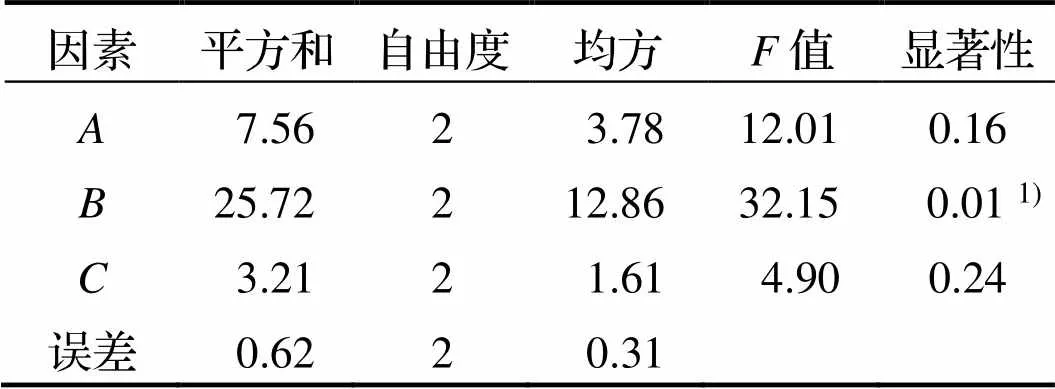
表3 咸肉亚硝酸盐降解率方差分析结果
注: 1)表示显著, 0.01<<0.05.
2.1.5 咸肉的验证实验
在正交实验获得最佳发酵条件下, 添加2.0%的发酵乳杆菌RC4, 18℃发酵10d, 亚硝酸盐残留量为3.22mg·kg-1, 远低于国家规定20mg·kg-1的安全标准.
2.2 添加发酵乳杆菌RC4对咸肉各理化指标的影响
2.2.1 咸肉色差的测定结果
由图2可见, 实验组和对照组咸肉L值、b值均呈下降趋势,a值呈上升趋势. 其中发酵7~11d, 实验组L值在发酵过程中一直高于对照组. 实验组咸肉的a值一直低于对照组, 在16d左右时差值最大; 实验组对照组的b值在20d期间产生一个交点, 此时b值相等.
2.2.2 添加发酵乳杆菌RC4咸肉pH测定结果
pH值是反映肉品质优劣的重要指标之一[17]. 如图3所示, 前7d咸肉pH迅速下降, 发酵7~9d, 对照组咸肉pH从6.90缓慢下降至6.86, 差异不显著(>0.05), 而实验组咸肉的pH在发酵7~11d从6.90下降至6.45, 变化差异显著(<0.05), 这可能是发酵乳杆菌RC4进行乳酸发酵的结果, 符合乳酸菌发酵咸肉的产品特性.
2.2.3 咸肉水分含量的测定结果
如图3所示, 实验组和对照组咸肉水分含量均呈下降趋势, 分别下降了28.01%和29.88%, 实验组水分含量略低, 差异不显著(>0.05).
2.2.4 咸肉硫代巴比妥酸值的测定结果
从图3可知, 除发酵18d左右实验组的TBA值高于对照组外, 整个发酵过程中实验组的TBA值都低于对照组TBA值, 并且只有12~18d时, 实验组TBA值上升速度高于对照组, 其他时间实验组的TBA值上升速度均显著低于对照组(<0.05), 原因可能是发酵乳杆菌抑制了咸肉脂肪的氧化, 有利于延长其保质期[18].
2.2.5 咸肉挥发性风味物质的检测利用
咸肉中共检测出87种挥发性风味物质(表4). 实验组咸肉检测出73种化合物, 其中醇类17种、醛类10种、酮类9种、酯类6种、酸类7种、醚类1种、烃类23种; 对照组咸肉检测出67种化合物, 其中醇类13种、醛类8种、酮类8种、酯类10种、酸类7种、醚类1种、烃类20种. 实验组样品的醛、酮、烃类物质含量较多, 对照组醇、酮、酯类物质含量较多, 其中, 实验组醇类化合物相对含量逐渐减少, 尤其是乙醇含量的降低最为显著, 由10.04%降低为6.62%, 这与醇类物质发生酯化反应或者氧化反应有关. 醇类具有比醛类更高的阈值, 它们对咸肉的风味影响不大[19]. 醛类比醇类对风味有更大的贡献, 醛类物质通常具有植物的青草芳香味以及肉制品特有的脂肪香味[20]. 与对照组相比, 实验组咸肉中醛类物质的总含量除丁二醛与(E)-2-己烯醛81略有减少, 2,4-戊二烯醛、苯甲醛、辛醛、壬醛等物质均有显著增加(<0.05), 它们的阈值较低, 对发酵肉制品风味贡献较大. 值得关注的是, 实验组检测到了对照组不存在的庚醛, 而庚醛具有腌制味、烤肉香、油脂香、柑橘香等独特的气味[19]. 酮类化合物中, C4-C9酮类物质是β-氧化产生的, 具有强烈的气味并具有较低阈值[21], 实验组咸肉中的3-羟基-2-丁酮为代表性的特征风味化合物, 其含量反应了酮类化合物总含量的变化趋势, 表现为甜香及奶制品香. 丙酮等的物质在发酵后未检出, 这可能是由于氧化产生了酸类或者自然风干发酵加速挥发导致[22]. 本试验中检测到的主要挥发性风味物质与刘文营等[23]、Yu等[24]、Yang等[25]的检测结果等基本一致, 在其种类和相对含量上有一定差异, 这可能是发酵咸肉的原材料及发酵成熟条件不同导致的[26].
注: “*”表示差异显著; “-”表示未检测出.
3 结论
咸肉中添加2%(μL·mL-1)具有高效降解亚硝酸盐的发酵乳杆菌RC4, 18℃发酵10d, 获得了感官评分高、亚硝酸盐含量低的咸肉产品, 其pH、水分含量降低, 色泽更鲜红、饱满, TBA增加量减少, 表明发酵乳杆菌有效的降低了酸度、水分, 抑制了脂肪氧化, 从而有利于咸肉保质期的提高. GC-MS分析鉴定出87种挥发性物质, 实验组(73种)比对照组(67种)多6种挥发性物质, 其中醇类、醛类和烃类物质种类数量明显增多, 添加发酵乳杆菌RC4后新产生了庚醛, 这些醛类物质极大的提高了咸肉风味.
[1] 董庆利. 亚硝酸盐对蒸煮香肠品质的影响及其抑菌模型与机理的研究[D]. 南京: 南京农业大学, 2007.
[2] 张颖璐, 周敬阳, 徐倩倩, 等. 超高压对发酵兔肉干腌渍发色的研究[J]. 食品研究与开发, 2018, 39(7):120- 125.
[3] 邵利君. 腌制肉糜在热处理及模拟胃液中亚硝酸盐变化及亚硝胺生成特点研究[D]. 无锡: 江南大学, 2010.
[4] 管世敏. 降解亚硝酸盐乳酸菌的分离筛选及其在泡菜发酵中的应用研究[D]. 上海: 上海师范大学, 2009.
[6] Bryan N S, Alexander D D, Coughlin J R, et al. Ingested nitrate and nitrite and stomach cancer risk: An updated review[J]. Food and Chemical Toxicology, 2012, 50(10): 3646-3665.
[7] 杜宏宇, 丁原春, 林春艳, 等. 肉类制品中亚硝酸盐残留量较高的解决措施[J]. 科技视界, 2016(5):90-91.
[8] Wu R, Yu M, Liu X, et al. Changes in flavour and microbial diversity during natural fermentation of suan-cai, a traditional food made in Northeast China[J]. International Journal of Food Microbiology, 2015, 211: 23-31.
[9] 姚荷, 谭兴和, 张春艳, 等. 发酵蔬菜中乳酸菌降解亚硝酸盐的研究进展[J]. 中国酿造, 2018, 37(7):22-25.
[10] Zeng X Q, Pan Q, Guo Y X, et al. Potential mechanism of nitrite degradation byRC4 based on proteomic analysis[J]. Journal of Proteomics, 2019, 194:70-78.
[11] 董庆利, 郭黎洋, 龚海斌, 等. 亚硝酸盐对猪肉腌制过程中颜色的影响[J]. 食品与发酵工业, 2006, 32(7):37- 41.
[12] GB 2730-2015. 腌腊肉制品卫生标准[S].
[13] 邢宝田, 宋顺华, 刘玲, 等. 水分速测仪与标准烘干法测定种子水分的比较分析[J]. 黑龙江农业科学, 2015 (3):117-119.
[14] Witte V C, Krause G F, Bailey M E. A new extraction method for determining 2-thiobarbituric acid values of pork and beef during storage[J]. Journal of Food Science, 1970, 35(5):582-585.
[15] 周昌瑜, 蒋娅婷, 曹锦轩, 等. 热处理时间对鸭肉肌原纤维蛋白凝胶的风味吸附能力影响[J]. 现代食品科技, 2016, 32(3):218-224.
[16] 丁娟芳, 杨嘉, 朱淑云, 等. 扬州酱菜中降解亚硝酸盐乳酸菌的筛选、鉴定及性能研究[J]. 中国酿造, 2018, 37(12):87-91.
[17] 郭兆斌, 韩玲, 余群力. 牦牛肉成熟过程中肉用品质及结构变化特点[J]. 肉类研究, 2012, 26(2):8-11.
[18] 商学兵. 银杏叶提取物对发酵猪肉香肠储存稳定性的影响[J]. 中国食品添加剂, 2016(1):104-108.
[19] 唐静, 张迎阳, 吴海舟, 等. 传统腌腊肉制品挥发性风味物质的研究进展[J]. 食品科学, 2014, 35(15):283- 288.
[20] 李晓燕, 王卫, 白婷, 等. 直投式发酵微生物对自控风干牛肉挥发性风味成分的影响[J]. 中国调味品, 2019, 44(1):45-49.
[21] Gao P, Wang W X, Jiang Q X, et al. Effect of autochthonous starter cultures on the volatile flavour compounds of Chinese traditional fermented fish (Suan yu)[J]. International Journal of Food Science & Technology, 2016, 51(7):1630-1637.
[22] 白菊红. 乳酸菌发酵牦牛肉灌肠过程中主要物质变化规律的研究[D]. 成都: 西南民族大学, 2017.
[23] 刘文营, 张振琪, 成晓瑜, 等. 干腌咸肉加工过程中品质特性及挥发性成分的变化[J]. 肉类研究, 2016, 30(1): 6-10.
[24] Yu A N, Sun B G, Tian D T, et al. Analysis of volatile compounds in traditional smoke-cured bacon(CSCB) with different fiber coatings using SPME[J]. Food Chemistry, 2008, 110(1):233-238.
[25] Yang Y, Zhang X, Wang Y, et al. Study on the volatile compounds generated from lipid oxidation of Chinese bacon (unsmoked) during processing[J]. European Journal of Lipid Science & Technology, 2017, 119:512-521.
[26] Zhang J, Zhen Z, Zhang W, et al. Effect of intensifying high-temperature ripening on proteolysis, lipolysis and flavor of Jinhua ham[J]. Journal of the Science of Food & Agriculture, 2010, 89(5):834-842.
Application ofRC4 on salted meat for nitrite degradation and quality improvement
TIAN Qiyuan1,2,3, WANG Xiaomeng1,2,3, YE Congyan1,2,3, PAN Qing1,2,3, ZENG Xiaoqun1,2,3*, PAN Daodong1,2,3, SHEN Jianliang4
( 1.State Key Laboratory for Managing Biotic and Chemical Threats to the Quality and Safety of Agro-products, Ningbo 315832, China; 2.Key Laboratory of Animal Protein Food Processing Technology of Zhejiang Province, Ningbo 315832, China; 3.College of Food and Pharmaceutical Sciences, Ningbo University, Ningbo 315832, China; 4.Zhejiang Zhuowang Agricultural Technology Co., Ltd., Huzhou 313014, China )
() RC4 with efficient nitrite degradation ability were applied to prepare salted meat and decrease its nitrite content. The effects ofRC4 on the nitrite content, quality and flavor of salted meat were examined. Single-factor experiments and orthogonal experiments were used to optimize the processing technology of experimental group salted meat by including. The sensory score, nitrite content, pH, color difference, moisture, thiobarbital (TBA) value and volatile flavor components were detected to compare the experimental and control group. The results showed that the optimal fermentation conditions for the experimental group salted meat were as follows: inoculating 2.0%(μL·mL-1)on salted meat and fermenting for 10d at 18℃. The nitrite content of the experimental group and that of the control group was 3.22 and 15.28 mg·kg-1respectively. The nitrite content of the experimental group was 21.07% of the control group, 78.60% lower than prior to fermentation. During fermentation of the experimental group, the pH decreased from 6.9 to 6.45. The color and the water content were not significantly different from the control group (>0.05). The TBA value increment was significantly lower than the control group (<0.05), which indicated that lipid oxidation was significantly inhibited by adding. A total of 87 kinds of volatile substances were identified. Aldehydes, alcohols, acids and ketones significantly affected the flavor of salted meat. Heptaldehyde produced byfermentation was not detected in the control group. Heptaldehyde, benzaldehyde, octanal and furfural obviously increased in the experimental group and these compounds are characteristic flavor compounds in the experimental group. Conclusion: By includingRC4 with nitrite degradation characters in processing salted meat can significantly reduce the nitrite content of salted meat and increase its quality and flavor.
RC4; bacon; nitrite content; physical and chemical indicators; volatile flavor substances
TS251.5
A
1001-5132(2020)01-0038-07
2019−04−30.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
国家自然科学基金(41641052, 41406165); 浙江省公益技术研究计划(LGN19C200011); 浙江省教育厅科研项目(Y201941438).
田启远(1995-), 男, 山东临沂人, 在读硕士研究生, 主要研究方向: 发酵食品加工. E-mail: 1115132131@qq.com
曾小群(1982-), 女, 四川仁寿人, 博士/副教授, 主要研究方向: 发酵食品加工. E-mail: zxqun3447@126.com
(责任编辑 章践立)

