表面增强拉曼光谱结合不同纳米基底快速检测酸性橙Ⅱ
王晓辉,徐涛涛, 2,黄轶群,欧已铭, 4,赖克强, 2,樊玉霞, 2*
1. 上海海洋大学食品学院,上海 201306 2. 上海海洋大学食品热加工工程技术研究中心,上海 201306 3. 长沙理工大学化学与生物工程学院,湖南 长沙 410076 4. 上海中侨职业技术学院食品学院,上海 201514
引 言
酸性橙Ⅱ(2-萘酚偶氮对苯磺酸钠)属于化工染料,工业上主要用羊毛、皮革、蚕丝、纸张的染色,医学上常用于组织切片的染色。由于其具有致癌致畸性,酸性橙Ⅱ被禁止添加于食品中。因其色泽鲜艳、着色力强、价格低廉,仍有商家为降低成本将其用于辣椒粉、腐竹、卤肉或者烤鸭的着色,引起人体中毒[1]。目前,检测酸性橙等色素类物质的方法主要有高效液相色谱法[2-3]、薄层色谱扫描法[4]、紫外吸收光谱法[5]和酶联免疫吸附法[6]等,这些方法存在前处理复杂、分析时间较长、灵敏度不高等缺点。表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)作为一种新兴的分子光谱技术,具有快速、灵敏、指纹识别等特点,该技术在细胞检测[7]、医学诊断[8]、微生物识别[9]、痕量化学物质检测[10-11]等领域已被广泛应用并展现出广阔的前景。
SERS信号的增强很大程度上取决于拉曼基底的性能,与其结构、尺寸、形貌、粗糙程度等因素有关,常见的SERS增强基底主要有固体Q-SERS基底[12]、KlariteTM基底[13]、不同形状金属纳米溶胶基底、各向异性纳米粒子基底和化学自组装基底[14]。纳米增强基底因其形状、结构、材料等差异,对不同目标分析物其增强性能也有差异。固体基底因其结构稳定,基底本身具有较好的一致性,因此其重复性较好。核壳结构复合基底充分利用“热点效应”提高其增强性能。金纳米棒是最近研究热门的SERS基底之一,由于避雷针等电磁增强效应,能使分析物SERS信号增强,从而提高分析方法的灵敏度。本研究基于SERS光谱结合不同纳米材料增强基底对酸性橙Ⅱ进行了检测研究。对比了不同激光激发光源的影响,分析了不同纳米材料基底增强性能差异,并基于不同基底对酸性橙Ⅱ标准溶液系列浓度进行了检测,建立了定量分析模型。
1 实验部分
1.1 仪器与试剂
标准品酸性橙(纯度≥98%)购置于Sigma-Aldrich公司。纳米材料制备所需试剂包括十六烷基三甲基溴化铵(CTAB)(纯度99%)、氯金酸(纯度99.99%)、L-抗坏血酸(纯度>99.9%)、硼氢化钠(纯度≥99%)、硝酸银(纯度>99%)等购置于Sigma-Aldrich和百灵威科技有限公司。使用Nicolet DXR显微共聚焦拉曼光谱仪(美国Thermo Fisher Scientific公司)获取样品光谱,采用JEM-2100F型场发射透射电子显微镜(日本JEOL公司)对纳米材料进行表征。
1.2 方法
1.2.1 金纳米材料的制备
(1)金纳米颗粒溶胶
根据Frens方法[15],取50 mL氯金酸(2×10-4mol·L-1)溶液置于100 mL圆底烧瓶中,油浴中搅拌加热至沸腾,加入0.74 mL柠檬酸钠(1%W/W),搅拌加热至酒红色,制备出粒径约为(18.0±2.0) nm的金纳米溶胶,自然冷却至室温保存备用。通过调整柠檬酸钠的用量可制备不同粒径的金纳米颗粒溶胶。
(2)金纳米棒溶胶
参照文献[16]硝酸银辅助种子生长法制备。首先,金种制备过程: 在10 mL 0.1 mol·L-1CTAB溶液中加入2.5×10-4mol·L-1氯金酸和600 μL 0.01 mol·L-1冰浴的硼氢化钠溶液,剧烈搅拌10 min后,25 ℃陈化2.5 h。
金纳米棒合成: 在CTAB (9.5 mL, 0.1 mol·L-1)溶液中, 依次加入硝酸银(20 μL, 0.01 mol·L-1), 氯金酸(0.5 mL, 0.01 mol·L-1)和抗坏血酸(55 μL, 0.1 mol·L-1),搅拌均匀后加入12 μL制备的金种,将此混合液于27 ℃陈化14~16 h。
离心浓缩: 取1.5 mL金纳米棒溶胶于离心管中,12 000 r·min-1离心10 min,去除上清液,加入超纯水,再离心10 min,去除上清液,再加入一定量的超纯水,涡旋混匀,待用。
1.2.2 标准溶液的配制
酸性橙Ⅱ标准品用乙腈溶解后,配成浓度为100 mg·L-1的储备液,-20 ℃避光保存。用乙腈和水的混合液(1∶1,V/V)将其稀释成系列浓度的标准溶液(酸性橙Ⅱ浓度范围为0.05~10.0 mg·L-1),密封后4 ℃避光保存备用。
1.2.3 光谱采集条件
用洗净的玻璃片将色素标准品固体粉末平铺均匀后采集其拉曼图谱。将标准溶液与等量金纳米颗粒溶胶,或离心浓缩后的金纳米棒溶胶混匀,取5 μL于载玻片表面,50 ℃烘干后用于SERS检测。
光谱采集条件: 波长633 nm He-Ne激光源,光源功率2 mW,波长为780 nm半导体激光源,光源功率 100 mW,曝光时间为2 s,曝光次数为3次,采集图谱波数为400~2 000 cm-1,分辨率为4.7 cm-1。
为确保实验数据的有效性,每个浓度样品在基底上随机采集任意10个点获得10条谱图,平均后作为样品光谱,在不同批次的基底上每个浓度样品重复采集4次,获得样品谱图进行数据分析。
2 结果与讨论
2.1 酸性橙Ⅱ的拉曼图谱

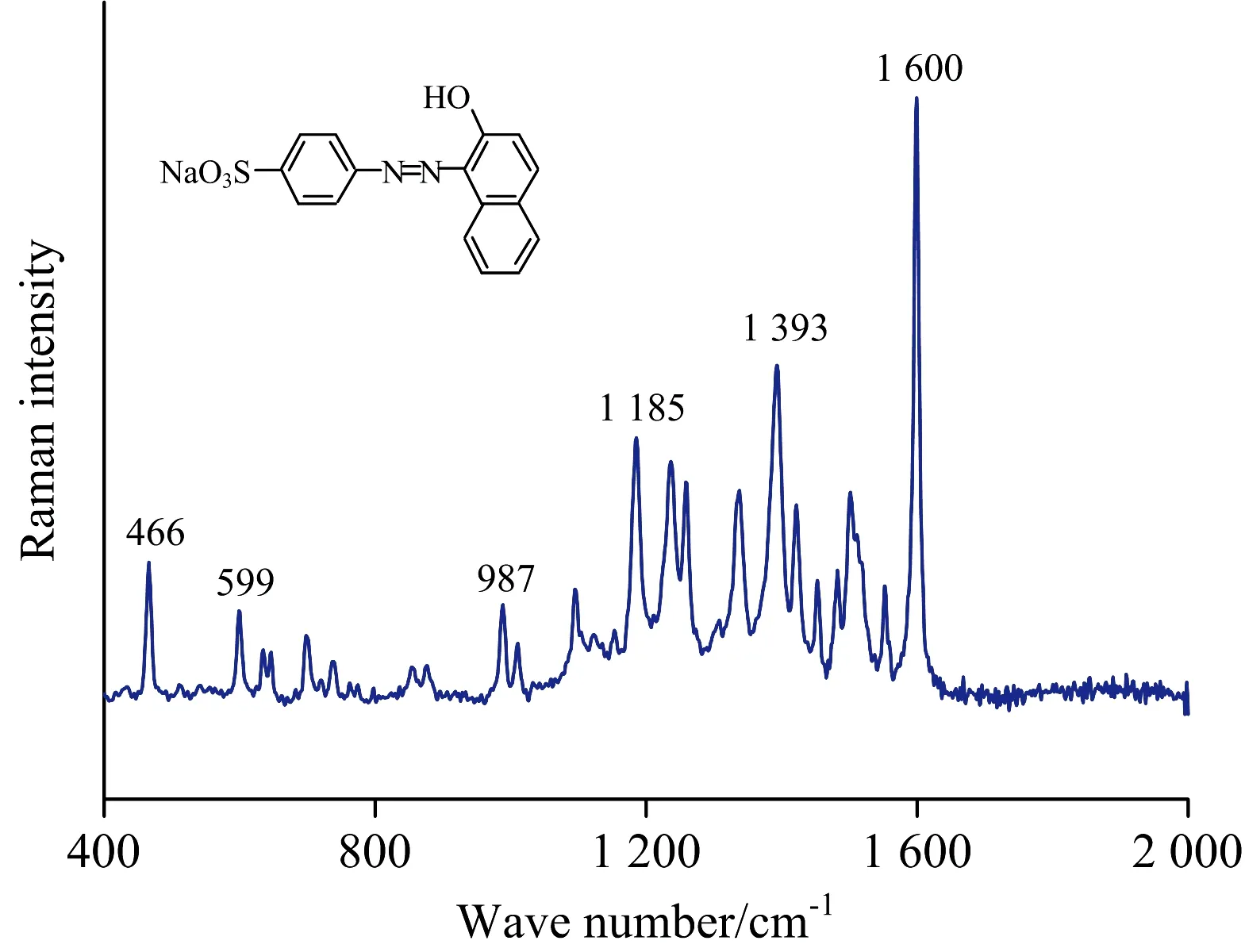
图1 酸性橙Ⅱ分子结构式及固体拉曼谱图
2.2 不同纳米基底的表征
研究采用了KlariteTM金纳米固体基底(Renishaw Diagnostic Ltd.英国)、实验室制备的金纳米颗粒、金纳米棒溶胶基底作为SERS增强基底。KlariteTM固体基底外观结构及结构表征如图2所示,其表面是具有金膜覆盖的倒金字塔纳米结构,固定于玻璃片上,增强活性面积为4 mm×4 mm的正方形,金膜均匀,结构稳定,具有良好的重复性。

图2 KlariteTM基底及结构[20]
图3为金纳米颗粒和金纳米棒的透射电镜图。从电镜图中可看出合成的金纳米粒子具有良好的分散性、粒径分布较均匀。以100个纳米粒子为基数计算金纳米颗粒的平均粒径为(18.0±2.0) nm,金纳米棒的横纵比为1.8[长(40.1±3.8) nm,宽(21.8±2.1) nm)]。
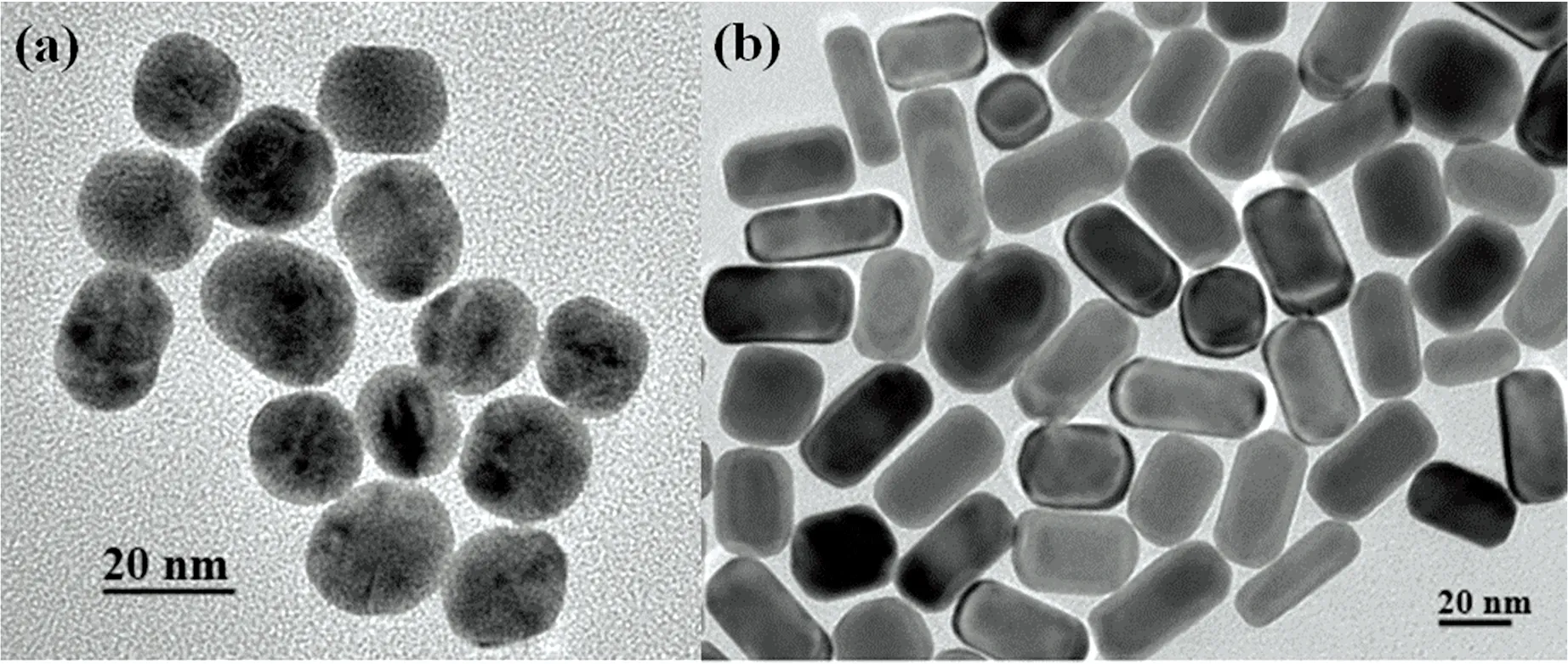
图3 (a)金纳米颗粒和(b)金纳米棒基底透射电镜图
2.3 SERS结合不同纳米基底对酸性橙Ⅱ的检测分析
2.3.1 不同激光光源、不同基底对酸性橙Ⅱ分析的影响
基于金纳米颗粒溶胶基底,对比分析了633和780 nm两种激光光源对酸性橙Ⅱ溶液的SERS增强性能。图4为酸性橙Ⅱ基于不同激光光源的SERS谱图。从图4 可以看出,同一较低浓度(0.1 mg·L-1)时,两种激光光源采集酸性橙Ⅱ的SERS信号差异不大,但780 nm的激发光源采用了更高的激光功率为100 mW,而633 nm激发光源功率只需2 mW。同等条件基于较高浓度(0.5 mg·L-1)进一步分析,基于633 nm的激发波长酸性橙Ⅱ具有更高强度的SERS信号。由于不同波长的激光具有不同的激发能量,对不同结构的分子,具有不同的激发效应,导致产生的拉曼光谱强度存在明显差异。因此,该结果表明633 nm的激光光源更有利于酸性橙Ⅱ的SERS分析检测。
在确定激光光源之后,对比分析了KlariteTM、金纳米颗粒及金纳米棒三种纳米增强基底对酸性橙Ⅱ溶液的SERS增强效果,结果如图5所示。不同基底获得的酸性橙Ⅱ溶液的SERS谱图展示出类似的特征峰,说明不同基底本身对酸性橙Ⅱ溶液的SERS信号响应类似,但不同粒径纳米颗粒基底增强效应存在较明显的差异。采用2种不同粒径的金纳米粒子对酸性橙Ⅱ进行分析,对比发现,基于粒径约为55 nm的Au纳米粒子采集获得的5 mg·L-1酸性橙Ⅱ溶液的SERS强度几乎等同于粒径约为20 nm的Au纳米粒子采集获得的1 mg·L-1酸性橙Ⅱ溶液的SERS强度,由此可见,小粒径的纳米粒子溶胶基底对酸性橙Ⅱ的SERS增强效果优于大粒径的纳米粒子溶胶基底。比较KlariteTM、20 nm的金纳米颗粒溶胶基底及金纳米棒基底对1 mg·L-1的酸性橙Ⅱ分析,发现SERS强度差异不大,金纳米颗粒基底增强性能稍显优势,但三种基底对酸性橙Ⅱ溶液均具有较好的增强效果,可用于SERS分析。

图4 酸性橙Ⅱ基于不同激光光源的SERS谱图
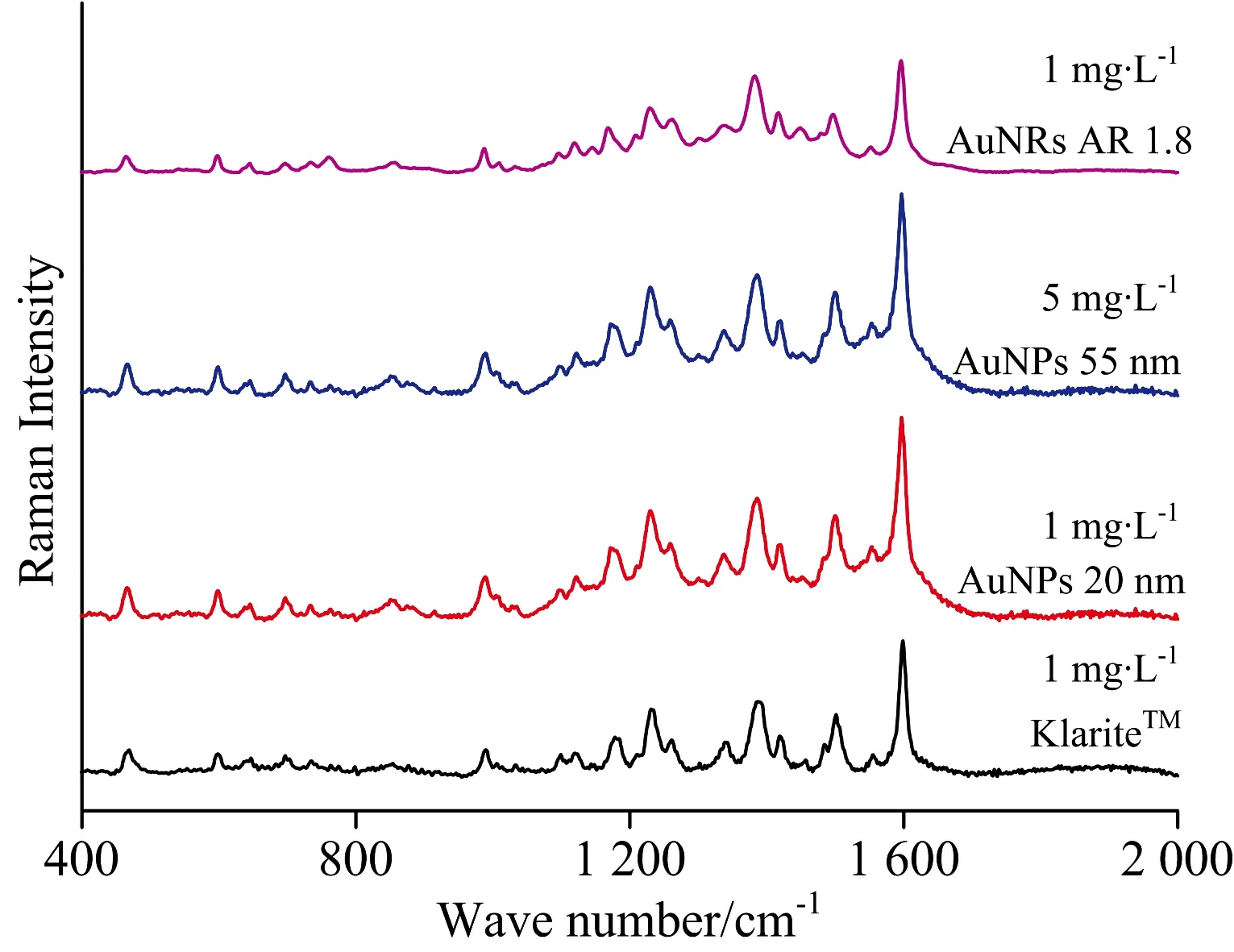
图5 基于不同纳米基底酸性橙Ⅱ的SERS谱图
2.3.2 不同基底对酸性橙Ⅱ的检测
不同基底,因其结构性能差异,导致不同结构目标分子在基底表面吸附行为存在差异,从而产生增强性能的差异性。基于KlariteTM金纳米固体基底、金纳米颗粒溶胶及金纳米棒溶胶基底结合SERS对不同浓度梯度的酸性橙 Ⅱ标准溶液体系进行了检测研究,结果如图6所示,基于3种不同基底酸性橙Ⅱ主要特征峰峰位基本一致,随着溶液浓度的增加,特征峰的强度逐渐增强。基于KlariteTM基底,浓度为0.1 mg·L-1时,多数特征峰无法识别,仅位于1 598 cm-1的特征峰可以辨别,可认为基于KlariteTM金纳米固体基底,SERS对酸性橙Ⅱ溶液的最低检测浓度为0.2 mg·L-1。
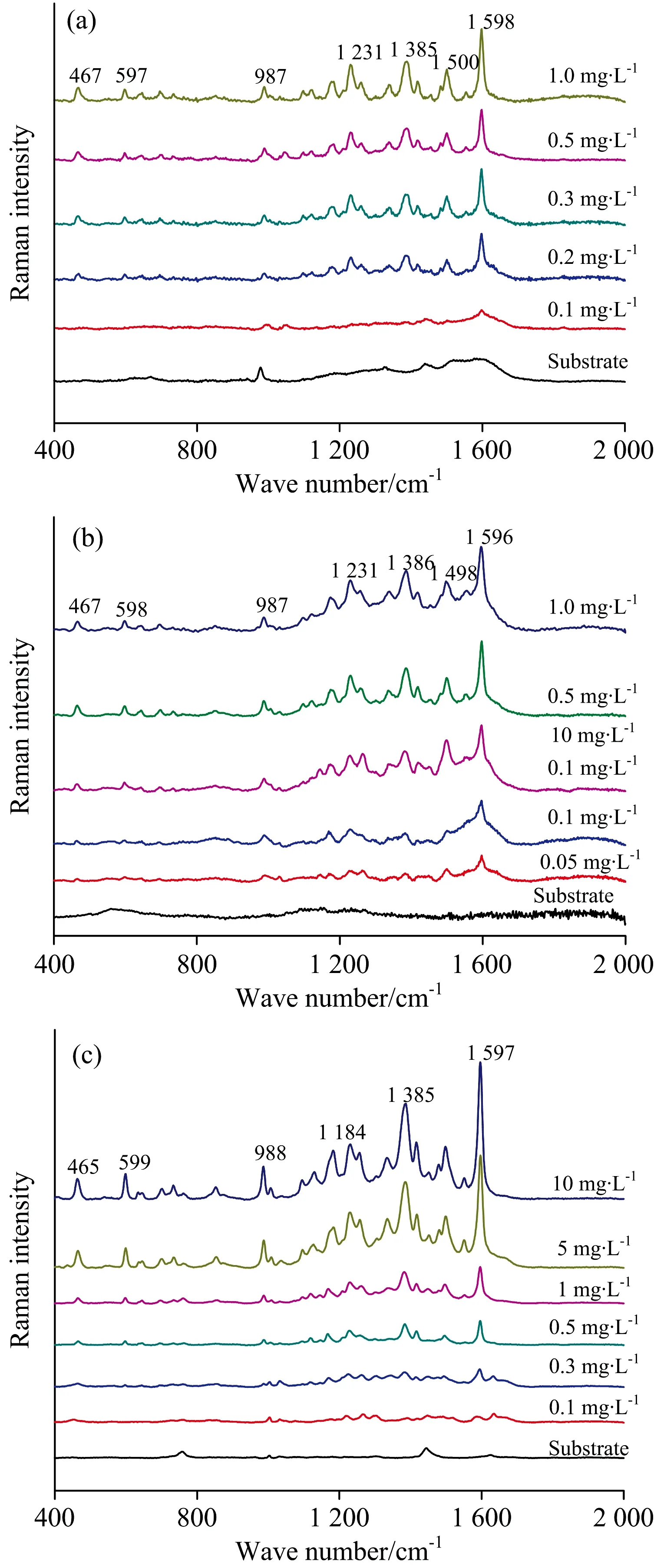
图6 酸性橙标准溶液的SERS检测
Fig.6RepresentativeSERSspectraofOrangeⅡstandardsolutionsbasedon(a)KlariteTM, (b)AuNPs,and(c)AuNRs
如图6(b)和(c)所示,基于金纳米颗粒溶胶基底,酸性橙Ⅱ溶液浓度为0.1 mg·L-1时,位于467,1 231,1 498和1 596 cm-1的特征峰均可以辨别,SERS结合金纳米颗粒溶胶对酸性橙Ⅱ的最低检测浓度为0.1 mg·L-1。酸性橙Ⅱ标准溶液浓度为0.1 mg·L-1时,基于金纳米棒采集的SERS光谱位于988,1 184,1 385和1 597cm-1附近的特征峰仍能清晰辨认,因此,基于金纳米棒基底SERS对酸性橙Ⅱ的最低检出浓度同为0.1 mg·L-1。
2.3.3 酸性橙Ⅱ的定量分析
SERS强度随着酸性橙Ⅱ浓度的增加而增强,因此,尝试建立SERS图谱特征峰强度与色素浓度间线性回归模型,用于酸性橙Ⅱ的定量分析。选取1 184,1 385和1 597 cm-1三个特征主峰,酸性橙Ⅱ标准溶液浓度与单个SERS特征峰强度之间的线性回归模型结果如表1所示。决定系数R2范围为0.861~0.938,RMSE为0.88~1.15 mg·L-1,RPD为2.5~4.0,1 597 cm-1特征峰强度与浓度之间的线性回归模型最佳,以上结果表明SERS可用于酸性橙Ⅱ的定量分析,为实际样品中酸性橙Ⅱ的定量分析提供了理论依据。

表1 特征峰强度与酸性橙Ⅱ浓度间的线性回归模型
3 结 论
应用表面增强拉曼光谱结合不同纳米基底对酸性橙Ⅱ进行了检测分析,对比了不同波长激发光源对酸性橙Ⅱ的SERS检测影响,分析了不同纳米基底增强性能,并基于不同基底对酸性橙Ⅱ标准溶液进行了检测,该方法可为痕量酸性橙Ⅱ及同类色素的检测提供快速、准确、灵敏的分析检测途径,主要结论:
(1)实验室自制金纳米颗粒和金纳米棒基底分散性良好,尺度一致; 波长为633 nm的激发光源对酸性橙Ⅱ的SERS检测更加有效; 不同粒径金纳米颗粒对酸性橙Ⅱ的增强性能差异显著,小粒径纳米颗粒增强效果更好。
(2)SERS结合KlariteTM固体基底、粒径为(18.0±2.0) nm的金纳米颗粒,横纵比为1.8的金纳米棒对酸性橙Ⅱ的最低检出浓度分别为0.2,0.1和0.1 mg·L-1; 基于SERS特征峰强度和酸性橙Ⅱ浓度相关性,建立了定量分析模型,最优线性回归模型的决定系数R2为0.933,RMSE=0.88 mg·L-1,RPD=4.0。

