液浸速冻对牡蛎水分迁移及品质的影响
梁钻好,陈海强,梁凤雪,罗宏悦,谢彦安,余 铭,
(1.阳江职业技术学院食品与环境工程系,广东 阳江 529566;2.广东省食品低温加工工程技术研究中心,广东 阳江 529566;3.阳江市程村镇政府,广东 阳江 529821;4.阳西县程村镇红光蚝协会,广东 阳江 529821)
牡蛎,又被称为蚝、生蚝,是目前我国乃至世界产量最大的经济贝类[1]。牡蛎以鲜销为主,但是高含水量(约80%)的牡蛎离水只能存活3~5 d,开壳后的牡蛎肉更不耐贮存[2]。冷冻能有效延长牡蛎肉的货架期[3],但冷冻过程中大冰晶的形成、水分的迁移与冻结会导致蛋白质变性、细胞机械破损,解冻后汁液流失严重,影响肉质和口感[4]。冰晶的大小和分布与冷冻速率密切相关,冷冻速率越大,食品内部通过-1~-5 ℃“最大冰晶生成”温区的时间越短,形成细小的胞内晶。因此,冷冻速率是影响冷冻产品品质的重要因素,寻找一种快速冷冻技术是解决牡蛎由于冷冻变性而导致品质下降的主要途径。在食品工业中,目前常用的快速冷冻方式有鼓风冷冻、平板速冻、流化床冷冻和低温冷冻,它们的共同点是以气体作为传热介质。由于液体传热系数是气体的20多倍;因此,与传统的空气对流冷冻方式相比,把食品直接浸泡在制冷液中的液浸速冻方式具有冷冻速率快、冷冻均匀、能耗低、干耗小的优势,形成的冰晶细小致密且分布均匀,避免了冰晶膨大引起的机械损伤和细胞脱水[5]。研究证明,一些果蔬[6-8]、浆汁[5]、水产[9-11]通过液浸速冻技术冷冻可最大限度保留食品原有的感官和品质。虽然关于液浸速冻方面的研究还不够系统,但该技术是目前快速冷冻技术中比较具有产业化前景的技术[8]。
低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)通过测定质子在磁场中的弛豫特性来研究样品中水分的含量、分布、迁移及其他相关品质性质[12],其灵敏度高,且为无损检测,在肉类[13]、水产[14-15]、果蔬[12]、酸奶[16]等多种食品的品质鉴定中均有应用。如通过利用LF-NMR研究食品水分迁移与分布特性,可以得出粉末的分子质量与吸湿性的关系并以此推定贮藏稳定性[17],或是跟踪干燥过程的水分动态从而监测干燥速率和食品干燥过程中的质构特性[18-19]。本研究基于LF-NMR技术分析牡蛎冻结后水分含量及迁移的变化,表征冷冻方式对牡蛎品质的影响。
1 材料与方法
1.1 材料与试剂
冷冻液为体积分数95%乙醇溶液;牡蛎由红光蚝协会提供。
牛血清白蛋白、Ca2+-ATPase测试盒 南京建成生物工程研究所;氯化钾、硫酸铜、酒石酸钾钠、氢氧化钠、氯化钠均为分析纯。
1.2 仪器与设备
MesoMR23-040V-I NMR成像分析仪 苏州纽迈分析仪器股份有限公司;KQ-01液浸式速冻机 广东科奇超速冻科技有限公司;小型气流式速冻机 常州凯曼制冷设备有限公司;CT3质构仪 美国博勒飞公司;TR-52i温度记录仪 日本TANDD公司;BD/BC-768Q卧式冰柜 雪花(北京)科技有限公司;BC/BD-208DT卧式冷柜 合肥美菱股份有限公司;JD-8S型真空包装机厦门捷鼎机械设备有限公司;SY204分析天平 上海佑科仪器仪表有限公司;FJ200-SH数显高速分散均浆机上海标本模型厂;TGL-18M台式高速冷冻离心机 广东省农垦集团进出口有限公司。
1.3 方法
1.3.1 原料预处理、冻结与解冻
清洗干净的牡蛎开壳,挑选新鲜无损伤、大小一致(质量为7~12 g)的牡蛎肉进行独立真空包装(真空时间约20 s,牡蛎不变形)。样品于4 ℃冰柜预冷1 h,后随机分成5 组进行不同的冷冻处理:1)对照(鲜样);2)-18 ℃冰柜中静置冷冻;3)气流速冻机中冷冻(冻结温度根据液浸速冻最优温度选择);4)液浸速冻,冻结温度分别为-10、-18、-25、-35、-45 ℃和-55 ℃;5)-80 ℃超低温冷冻。
当牡蛎中心温度冻至-18 ℃以下时,停止冻结,将样品迅速转移至-18 ℃冰柜中贮藏待用(24 h以内)。测定指标前先把牡蛎样品转移至4 ℃冰柜中解冻2 h,用于理化指标的测定。对照组直接用于理化指标的测定。
1.3.2 冻结曲线和冻结速率的测定
冻结曲线和冻结速率的测定参考文献[20]。将温度记录仪传感探头插至牡蛎肉的中心位置,每隔1 s记录一次温度,待样品中心温度降至-18 ℃以下终止冻结,根据牡蛎肉中心温度随时间的变化,绘制冻结曲线。冻结速率采用国际制冷协会提出的方法(式(1))计算。
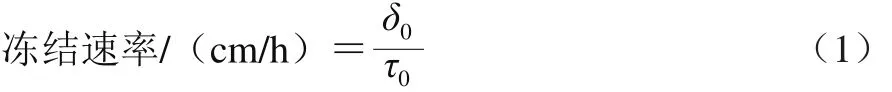
式中:δ0表示食品表面与热中心的最短距离/cm;τ0表示食品表面达到0 ℃后至热中心温度达初始冻结点以下10 ℃所需的时间/h。
1.3.3 理化指标测定
1.3.3.1 汁液流失率的测定
汁液流失率的测定参考文献[21]。用滤纸吸干牡蛎表面水分或汁液,分别称量解冻前后牡蛎质量,汁液流失率按式(2)计算。

1.3.3.2 蒸煮损失率的测定
蒸煮损失率的测定参考文献[22]。牡蛎样品85 ℃恒温水浴20 min,冷却至室温后用滤纸吸干表面水分或汁液,分别称量蒸煮前后牡蛎质量。蒸煮损失率按式(3)计算。

1.3.3.3 盐溶性蛋白含量的测定
盐溶性蛋白含量的测定参考文献[9]。准确称取3.00 g样品,加入30 mL 0.6 mol/L KCl溶液(4 ℃预冷),冰水浴中均质4 min,4 ℃离心(5 000 r/min、20 min),取上清液3 mL,加入9 mL去离子水(4 ℃预冷)使肌动球蛋白沉淀,4 ℃离心(5 000 r/min、20 min),取沉淀,加入3 mL 1.2 mol/L KCl溶液(4 ℃预冷),继续4 ℃离心(5 000 r/min、20 min),取上清液备用。采用双缩脲法测定盐溶性蛋白含量。
1.3.3.4 Ca2+-ATPase活力的测定
Ca2+-ATPase活力的测定参考文献[9]。准确称取3.00 g样品,加入9 倍体积的8.5 g/L NaCl溶液(4 ℃预冷),在冰水浴中均质捣碎,4 ℃离心(5 000 r/min,10 min),取上清液,加入8.5 g/L NaCl溶液稀释到合适的质量浓度,按Ca2+-ATPase测试盒说明书上的方法进行测定。
1.3.3.5 弹性的测定
以整只牡蛎为测定对象,沸水加热3 min熟化,取出沥水,待降至室温后采用CT3质构仪测定。设置参数如下:探头型号TA44,测前探头下降速率2.00 mm/s,测试速率1.50 mm/s,测后探头回程速率1.50 mm/s,形变50.0%,触发值25 g;实验类型:压缩。
1.3.3.6 LF-NMR的测定及成像分析
选取质量约为10.00 g的整只牡蛎,滤纸吸干表面汁液,称质量,真空包装,进行NMR测定,然后冻结处理,解冻后吸干表面汁液再次进行NMR测定。
测定方法:放入玻璃试管(口径40 mm),然后将样品管置于核磁探头中,使用CPMG序列测定横向弛豫时间T2。其中参数设置如下:磁体温度32 ℃;重复采样等待时间TW=2 500.00 ms;重复采样次数NS=8;回波时间TE=0.20 ms;回波个数NECH=12 500;采样带宽SW=200 kHz。模拟增益RG1=20.0 db;数字增益DRG1=3 db;前置放大器增益PRG=1 db。
核磁共振成像(magnetic resonance imaging,MRI)分析,参数设置:层数=1;层厚=3.0 mm;视野FOV=100 mm×100 mm;重复采样次数Average=2;重复采样等待时间TR=2 000.00 ms;回波时间TE=18.125 ms。根据鲜样和处理样的各峰信号幅度变化计算不同状态水分的损失率。
1.4 数据处理与分析
实验数据采用Execl 2010软件进行处理和作图,横向弛豫时间T2反演图采用Origin 8.0软件作图。统计学分析采用SPSS 17软件进行单因素方差分析。
2 结果与分析
2.1 冻结温度对液浸速冻牡蛎的品质影响
冻结过程中大冰晶的形成会对牡蛎肉的细胞造成机械损伤,导致细胞持水性能变差,表现为解冻后汁液流失和蒸煮损失严重、弹性变差或无弹性。如表1所示,冻结温度对牡蛎解冻后的汁液流失率和弹性影响不显著(P>0.05),可能是由于液浸速冻传热快,冻结速率较快(牡蛎冻至中心温度低于-18 ℃用时2~15 min)。蒸煮损失方面,-10 ℃冷冻的牡蛎蒸煮损失略大,-55~-18 ℃之间的差异不显著。总体而言,液浸速冻对冷冻牡蛎的汁液流失率、蒸煮损失率、弹性影响不大,可维持牡蛎良好的持水能力。
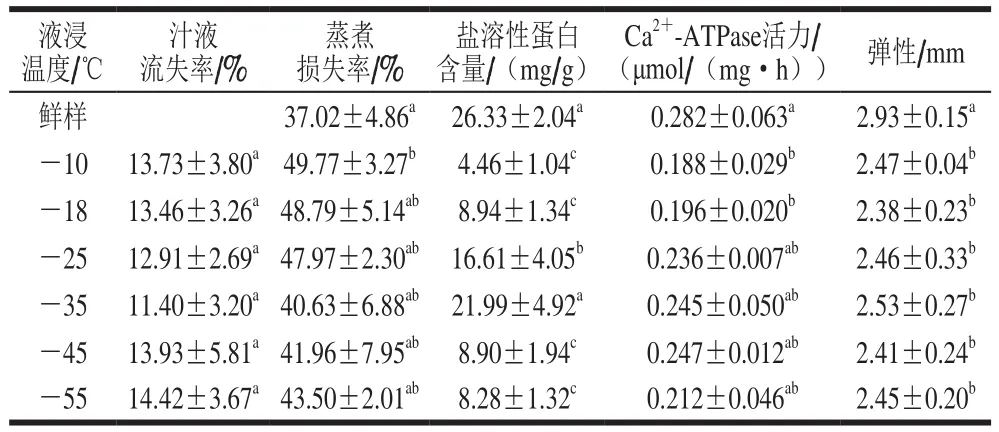
表1 不同温度下液浸速冻的牡蛎品质(n=6)Table 1 Quality of oysters subjected to immersion freezing at different temperatures (n= 6)
牡蛎蛋白由水溶性的肌浆蛋白、盐溶性的肌原纤维蛋白和不溶性的基质蛋白组成。冷冻过程中的蛋白变性主要是由肌原纤维蛋白变性引起的,牡蛎在冻结过程中,肌原纤维蛋白发生冷冻变性导致其盐溶性发生变化,盐溶性蛋白含量减少[23]。Ca2+-ATPase活性来源于肌原纤维蛋白中的肌球蛋白,可表征肌原纤维蛋白头部S-1片段的性质,是衡量蛋白质冷冻变性程度的另一重要指标[24]。由表1可知,与鲜样相比,冷冻牡蛎的盐溶性蛋白含量以及Ca2+-ATPase活力均有不同程度的下降,表明在冷冻过程中牡蛎的肌原纤维蛋白发生变性[25-26]。液浸渍温度从-10 ℃降到-35 ℃过程中,随着冻结速率加快,牡蛎盐溶性蛋白含量和Ca2+-ATPase活力的下降程度降低,-35 ℃冻结的牡蛎样品盐溶性蛋白含量和Ca2+-ATPase活力与鲜样最接近,二者之间无显著差异(P>0.05)。但随着冻结温度继续降低,牡蛎的盐溶性蛋白含量反而下降,这可以解释为冻结速率过快,小冰晶过细,在冻藏过程中会因为冷藏设备的温度波动而导致部分小冰晶更容易融化,融化后的冰水又在低温下重新结冰,即发生融化再重结晶的现象[27],此时再结晶更容易被旁边的冰晶吸收,形成大冰晶。在此过程中,可能有以下原因导致蛋白变性:大冰晶的挤压导致蛋白聚集变性;水分迁移形成大冰晶的过程导致蛋白质的水合状态发生改变;体系水化程度降低导致蛋白质开链[28]。
总体分析,-35 ℃冻结的牡蛎汁液流失和蒸煮损失较少,可保持牡蛎肉固有的良好弹性,盐溶性蛋白含量和Ca2+-ATPase活力与鲜样无显著差异(P>0.05),品质保持最佳。
2.2 冻结方式对牡蛎水分迁移变化的影响
根据2.1节冻结温度筛选,确定-35 ℃为最优液浸速冻温度,同时对比-18 ℃静置冷冻、-35 ℃气流冷冻和-80 ℃超低温冷冻效果。
2.2.1 冻结曲线

图1 牡蛎冻结曲线Fig. 1 Freezing curve of oysters

表2 牡蛎不同冷冻方式的冻结速率(n=3)Table 2 Freezing speeds of different freezing methods of oysers (n= 3)
由图1和表2可知,-35 ℃液浸速冻的牡蛎中心温度降至-18 ℃仅需要5.48 min,用时最短,冻结曲线最为陡峭,冻结速率最大,高达13.03 cm/h,按冻结速率等级划分,属于超速冻结(冻结速率>10 cm/h)。-35 ℃液浸速冻的冻结速率是-18 ℃静置冷冻的40.7 倍,分别是-35 ℃气流冷冻和-80 ℃超低温冷冻的5.54、5.94 倍。-35 ℃气流冷冻和-80 ℃超低温冷冻的冻结曲线也较为陡峭,二者的冻结速率和牡蛎中心温度通过-1~-5 ℃最大冰晶生成区的时间无显著性差异(P>0.05),属于快速冻结(食品中心温度通过-1~-5 ℃最大冰晶生成区的时间不超过30 min)。-18 ℃静置冷冻属于慢速冻结(冻结速率<0.5 cm/h,食品中心温度通过-1~-5 ℃最大冰晶生成区的时间超过30 min),其冻结曲线在-1~-5 ℃区间非常平缓。
大部分食品中心温度从-1 ℃降至-5 ℃时,近80%的水分可冻结成冰,此温度范围称为“最大冰晶生成区”。一般冻结速率越快,通过-1~-5 ℃温区的时间越短,冰层向内伸展的速率比水分移动速率要快时,其冰晶就越细小,冰晶分布越接近新鲜物料中原来水分的分布状态。-35 ℃液浸速冻的牡蛎通过最大冰晶生成区时间仅需2.15 min,其冻结速率比-35 ℃气流冷冻或-80 ℃超低温冷冻快约5 倍。
2.2.2 冻结方式对牡蛎水分分布的影响
鲜样和冻结后解冻的牡蛎样品LF-NMR横向弛豫时间T2反演的标准谱图见图2。横向弛豫时间T2反映了样品内部氢质子的自由度及其所受束缚力的大小,且与其成反比关系[12]。牡蛎的T2反演图有4 个峰,分别标记为T21、T22、T23、T24。其中T21(0.2 ms)为强结合水,T22(2.3~3.5 ms)为弱结合水,T23(57~73 ms)为不易流动水,T24(460~650 ms)为自由水。4 种冻结方式的牡蛎解冻后的T21峰和T22峰与鲜样差异不大,但T24峰的幅度均有明显降低,而T23峰幅度也有不同程度的降低。这表明,冻结对牡蛎的结合水影响不大,解冻后自由水大量流失,不易流动水因冻结方式不同,损失率不同。

图2 牡蛎冻结前与解冻后的横向弛豫时间T2反演图Fig. 2 Signal amplitude curves as a function of transverse relaxation time T2 for oysters before freezing and after thawing

图3 牡蛎解冻后的不同状态水分的损失率Fig. 3 Water loss of oysters after thawing
牡蛎在解冻后不易流动水和自由水与鲜样对比有不同程度的损失,表现为汁液流失。图3A显示,4 种冻结方式中,-18 ℃静置冷冻的牡蛎解冻后不易流动水损失率显著高于其他组(P<0.05),高达12%以上,其次是-35 ℃气流冷冻和-80 ℃超低温冷冻,损失率分别为6.70%和4.75%,二者无显著差异(P>0.05),-35 ℃液浸速冻牡蛎的不易流动水损失率最少(2.11%),仅分别为-35 ℃气流冷冻和-80 ℃超低温冷冻的31.5%、44.4%。自由水束缚力最小,4 种冻结方式的牡蛎解冻后自由水损失率在81%~87%之间,差异不显著(P>0.05)。
不易流动水存在于牡蛎肌原纤维细胞间质和肌原纤维细胞内,冻结解冻可能导致牡蛎肌纤维蛋白结构变化,引起水分迁移、变化[29]。而且不易流动水是牡蛎水分的主要存在状态,约占3 种水分的90%(通过T2反演图峰面积计算),因此这部分水的损失直接影响到整体的汁液流失率。冻结方式导致牡蛎解冻后不易流动水损失率的差异可以归结于冻结速率,-18 ℃静置冷冻方式的冻结速率最慢(图1),冻结速率最小,细胞间隙的冰晶最大,刺破细胞膜,产生许多通道,可以使细胞内容物在解冻时流出[30-31];与此相反,液浸速冻速率最快,液浸速冻牡蛎的水分损失最少。
2.2.3 不同冻结方式牡蛎的MRI
MRI伪彩图中的颜色深浅反映了质子密度不同引起的弛豫时信号强弱差别[32]。由图4中可知,-35 ℃液浸速冻的牡蛎解冻后,肉体内部有大面积黄红色区域,表明该区域水分含量较高,与鲜样对比的信号差值图显示,肉体边缘信号差值较低(绿色),内部基本无信号差值(蓝色),即解冻后牡蛎样品边缘有少量汁液流失,肉体内部的水分含量和分布与鲜样的差异不大。这一结果与上述液浸速冻牡蛎不易流动水损失最少的结论一致。其他3 种冻结方式处理的牡蛎解冻后,NMR信号值普遍较低,仅有零星小面积的黄色区域,与鲜样对比的信号差值图整体偏蓝绿色,或略微带黄色。这表明其他3 种冻结方式处理的牡蛎解冻后整体均有汁液流失,细胞持水性减弱。

图4 牡蛎鲜样与解冻后的MRI伪彩图Fig. 4 Magnetic resonance images of fresh oysters and frozen-thawed oysters
3 结 论
本研究采用液浸速冻方式冻结牡蛎,对解冻后的牡蛎进行品质分析,得出液浸速冻的最佳冻结温度为-35 ℃,此冻结温度下的牡蛎汁液流失和蒸煮损失较少,能较好地保持牡蛎肉固有的良好弹性,盐溶性蛋白含量和Ca2+-ATPase活力与鲜样之间无显著差异(P>0.05),品质保持最佳。而且按冻结速率区分,-35 ℃液浸速冻属于超速冻结。以-18 ℃静置冷冻、-35 ℃气流冷冻和-80 ℃超低温冷冻作对照,通过LF-NMR测定冻结后解冻的牡蛎水分含量和分布,结果表明:不同冻结方式的牡蛎解冻后的不易流动水和自由水均有明显损失,冻结方式对牡蛎自由水损失率无显著影响,但对不易流动水损失率影响显著,其中-35 ℃液浸速冻牡蛎的不易流动水损失率最小,仅分别为-35 ℃气流冷冻和-80 ℃超低温冷冻的31.5%和44.4%。MRI成像也得出类似结论。

