胡麻粕多酚对肠癌细胞凋亡的促进作用
张立超,杨宇菲,李汉卿,剌晓琴,李卓玉,,,
(1.山西大学生物医学研究院,山西 太原 030006;2.山西大学生物技术研究所,山西 太原 030006;3.山西大学生命科学学院,山西 太原 030006)
胡麻(Linum usitatissimun L.)是一种在温带气候区广泛分布的一年生植物,此种作物抗寒、耐旱、适应性广、经济价值高[1]。胡麻籽是我国的重要油料作物之一,在食品和饲料中应用广泛。胡麻粕是胡麻籽榨油后的剩余产物,主要作为一种物美价廉的蛋白饲料使用。胡麻粕主要由以下3 个部分组成:1)蛋白质,富含精氨酸和谷氨酰胺;2)胡麻胶,主要成分为醛糖二糖酸,由非还原糖和乙醛酸组成,具有良好的持水能力和高黏度;3)酚类化合物,如p-香豆酸、阿魏酸、木脂素等[3]。目前国内有关胡麻粕生物活性功能的研究相对较少。
植物多酚是植物体内一种主要的次生代谢产物,广泛存在于水果、蔬菜、谷物、豆类、坚果、茶、咖啡和葡萄酒等食物中[4-5]。植物多酚由一个或多个羟基结合一个或多个酚环形成,根据化合物的结构,多酚主要分为类黄酮、酚酸和木脂素类[6-7]。流行病学研究表明,富含多酚的饮食可以预防多种人类疾病;多酚对人体健康具有许多有益作用,主要包括抗菌、抗炎、抗病毒、抗癌、促进血管舒张和免疫调节活性[8]。一些癌症相关的研究结果也表明,多种多酚成分具有抗癌的特性[9]。
结肠癌是世界上最频发的恶性肿瘤之一[10]。2015年中国癌症统计显示,结直肠癌位居全国癌症发病及死亡率的第5位[11]。目前,结肠癌的治疗方式主要是以手术治疗为主,以化疗、放疗以及药物靶向治疗等为辅的综合治疗手段[12]。然而,由于肿瘤转移以及耐药性等问题,结肠癌治疗的预后效果较差[13]。这就使得寻找新的结肠癌治疗药物成为研究的重点。本研究旨在探究胡麻粕是否具有抗癌活性及其作用机制。
1 材料与方法
1.1 材料与试剂
胡麻粕购于山西省神池县。人结肠癌细胞株HCT-116、DLD1和人正常结肠上皮细胞株FHC均为山西大学生物技术研究所903实验室保存。
RPMI-1640和F12培养基 美国Thermo Scientific公司;无噬菌体胎牛血清 武汉博士德生物公司;Annexin V-FITC细胞凋亡检测试剂盒 南京碧波生物科技有限公司;活性氧(reactive oxygen species,ROS)检测试剂盒 江苏凯基生物技术公司;二甲基亚砜(dimethy sulfoxide,DMSO)、噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)、福林-酚试剂、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 北京索莱宝科技公司;N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC) 美国MedChem Express公司;4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)、结晶紫染色液、免疫染色固定液、细胞线粒体分离试剂盒碧云天生物技术公司;Bax、Bak、Bcl-XL、Bcl-2、细胞色素c(cytochrome c,Cyt c)抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白抗体 美国Cell Signaling Technology公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和Actin抗体 艾比玛特生物医药(上海)有限公司;X光胶片 美国Kodak公司;其他试剂均为国产分析纯。
1.2 仪器与设备
5810R高速冷冻离心机 德国Eppendorf公司;DHG-9070A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;ELGA超纯水仪 威立雅水处理技术(上海)有限公司;SB25-12DTD超声波清洗机 宁波新芝生物技术股份有限公司;DMI1倒置显微镜 德国徕卡公司;SHZ-DIII真空旋转蒸发仪 巩义市予华仪器有限责任公司;LSRFortessa X-20流式细胞仪 美国BD公司;ELX800酶标仪 美国伯腾仪器有限公司;coolsafe100-4真空冷冻干燥机 美国Thermo Scientific公司。
1.3 方法
1.3.1 胡麻粕多酚的提取
采用超声提取法从胡麻粕中提取多酚[14]。将胡麻粕粉碎,过40 目筛,在60 ℃蒸馏水中水浴脱胶多次,40 ℃干燥,石油醚脱脂,获得脱胶脱脂胡麻粉备用。取一定量的脱胶脱脂胡麻粉,按照1∶80的料液比将其加入体积分数54%乙醇提取剂中,在超声功率240 W、提取温度57 ℃的条件下提取40 min。5 000 r/min离心5 min,弃去沉淀收集上清液。将上清液在50 ℃条件下旋转蒸发浓缩25 min,将浓缩液放置于-80 ℃过夜,然后进行冷冻干燥,获得胡麻粕多酚粉末。
1.3.2 胡麻粕多酚质量浓度的测定
采用福林-酚比色法,以没食子酸为标准品,标准溶液的质量浓度为0、20、60、100、150、200、300、400、500、600 μg/mL。取0.1 mL标准溶液或样品和0.4 mL去离子水于离心管中。加0.1 mL福林-酚试剂,混匀静置6 min。再加入1 mL质量分数7% Na2CO3和0.8 mL去离子水,混匀静置90 min。采用紫外-可见分光光度计测定各个溶液在760 nm波长处的吸光度。获得的标准曲线方程为y=2.832 8x+0.100 8(R2=0.993 6),通过标准曲线计算样品中多酚的质量浓度。
1.3.3 细胞培养
HCT-116细胞在F12培养基中培养,DLD1细胞和FHC细胞在1640培养基中培养,培养基中均添加质量分数10%胎牛血清和1%青链霉素。所有细胞均放置于37 ℃、5% CO2的潮湿培养箱中培养。
1.3.4 细胞存活率的测定
将HCT-116、DLD1以及FHC细胞向每孔200 μL细胞培养液中添加4×103个,分别接种到96 孔培养板中,并在37 ℃的细胞培养箱中培养12 h。然后将96 孔板取出,弃掉各孔中的旧培养基,向其中添加新的培养基并用不同质量浓度(0.00、0.05、0.10、0.20、0.30、0.40 mg/mL)的胡麻粕多酚溶液(溶于培养基中)处理细胞48 h后,弃掉旧培养基并向各孔添加200 μL新培养基,然后将0.02 mL 5 mg/mL MTT加入到96 孔板中,与细胞一同孵育4 h。吸去板中培养基再加入0.1 mL DMSO,振荡10 min。使用酶标仪在570 nm波长处测定各孔吸光度,以不添加胡麻粕多酚为对照,按下式计算细胞存活率。
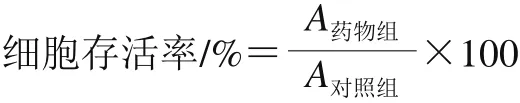
1.3.5 克隆形成能力的测定
将HCT-116、FHC和DLD1细胞分别用胰蛋白酶消化并接种于6 孔培养板中,每孔8×103个,置于培养箱中培养24 h,然后向其中加入不同质量浓度(0.00、0.10、0.25、0.40 mg/mL)的胡麻粕多酚。72 h后弃掉板中培养基,用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗两次,免疫荧光染色固定液固定20 min,弃掉固定液并用结晶紫染色15 min,用PBS洗涤并照相。
1.3.6 细胞凋亡检测
将DLD1和HCT-116细胞接种在培养皿中,培养12 h后,分别向其中加入3 mL新培养基以及不同质量浓度(0.00、0.10、0.25、0.40 mg/mL)的胡麻粕多酚溶液。继续培养48 h后用胰蛋白酶溶液将细胞消化2 min,然后收集细胞于离心管中,1 000 r/min离心5 min。弃上清液收集细胞,用PBS清洗2 次。取5×105个重悬的细胞置于EP管中,1 000 r/min离心5 min,弃上清液收集细胞。使用Annexin V-FITC细胞凋亡检测试剂盒,按质量比1∶20配制AnnexinV-FITC与结合液的混合液。每个样品中加入200 μL混合液,吹散细胞,室温避光放置30 min。再以质量比1∶60配制碘化丙啶(propidium iodide,PI)与结合液的混合液,每个样品中加300 μL。4 ℃避光放置5 min后用流式细胞仪对样品进行检测。
1.3.7 蛋白表达量的测定
为了进一步探究胡麻粕多酚对结肠癌细胞凋亡的影响机制,采用Western blotting法检测胞内Bak、Bcl-XL、Bcl-2、Bax等凋亡相关蛋白的表达量,并运用Image J软件对蛋白免疫印迹结果的灰度进行分析。将DLD1和HCT-116细胞接种在培养皿中,培养12 h后,加入不同质量浓度(0.00、0.10、0.25、0.40 mg/mL)的胡麻粕多酚溶液,培养48 h后离心收集细胞。向细胞沉淀中加入一定量的细胞裂解液,于冰上裂解30 min,在4 ℃下12 000 r/min离心15 min,收集上清液,用BCA法测蛋白质量浓度。SDS-聚丙烯酰胺凝胶电泳分离蛋白质,电泳结束后,用蛋白转移装置将蛋白转到聚偏二氟乙烯膜上。用甲醇洗膜,室温摇动,吹干,再次将膜置于甲醇中,振荡5 min。然后将膜置于牛奶封闭液中封闭,一抗孵育过夜,清洗一抗,二抗孵育2 h,曝光检测蛋白表达量。
采用Western blotting法检测胞内Cyt c的表达量。用不同浓度胡麻粕多酚DLD1和HCT-116细胞48 h,去除培养基并用PBS洗一遍,用胰酶消化细胞,1 000 r/min离心5 min收集细胞。加入一定体积的线粒体分离试剂轻轻悬浮细胞,冰浴15 min。把细胞悬液转移到玻璃匀浆器中,匀浆30 次左右。取2 μL细胞匀浆,加入台盼蓝染色液,混匀后显微镜下观察台盼蓝染色阳性(蓝色)细胞的比例。当阳性比例超过50%时即可停止匀浆。把细胞匀浆在600×g、4 ℃离心10 min。收集上清液,再11 000×g、4 ℃离心10 min,获得的上清液即为胞浆。用BCA法测蛋白质量浓度。SDS-聚丙烯酰胺凝胶电泳分离蛋白质,电泳结束后,用蛋白转移装置将蛋白转到聚偏二氟乙烯膜上。用甲醇洗膜,室温摇动,吹干,再次将膜置于甲醇中,振荡5 min。然后将膜置于牛奶封闭液中封闭,一抗孵育过夜,清洗一抗,二抗孵育2 h,曝光检测Cyt c表达量。
1.3.8 细胞内ROS水平检测
将DLD1、HCT-116和FHC细胞用不同质量浓度(0.00、0.10、0.25、0.40 mg/mL)的胡麻粕多酚处理。为了验证胡麻粕多酚是否通过诱导ROS的生成而抑制结肠癌细胞增殖,采用NAC对细胞进行预处理(向培养液中加入NAC使其终浓度达到6 mmol/L,再加入0.40 mg/mL胡麻粕多酚处理细胞)。将所有组别细胞培养48 h后去除细胞培养液,加入用无血清培养基稀释的2,7-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA),37 ℃细胞培养箱中孵育20 min,用无血清培养基漂洗3 次,用荧光酶标仪在激发波长488 nm、发射波长525 nm处检测DCF的荧光强度,用来表征ROS的生成量。
1.4 数据统计与分析
每个样品至少进行3 次重复实验。数据均采用SPSS 17.0软件处理,进行单因素方差分析,P<0.05为差异显著。采用Origin软件作图。
2 结果与分析
2.1 胡麻粕多酚对DLD1、HCT-116和FHC细胞增殖的影响
如图1A所示,低质量浓度的胡麻粕多酚即对DLD1和HCT-116细胞的增殖产生了抑制作用,随着胡麻粕多酚质量浓度的升高,抑制作用明显增强,且呈浓度依赖性。胡麻粕多酚对于HCT-116和DLD1细胞的IC50分别为0.17 mg/mL和0.36 mg/mL。然而低质量浓度的胡麻粕多酚对FHC细胞的增殖没有明显抑制作用,胡麻粕多酚对FHC细胞增殖的IC50为1.41 mg/mL。图1B结果显示,不同质量浓度的胡麻粕多酚对结肠癌细胞DLD1和HCT-116的克隆形成都具有不同程度的抑制作用,且呈浓度依赖性,然而低质量浓度时胡麻粕多酚对FHC细胞的克隆形成能力没有明显的抑制作用。
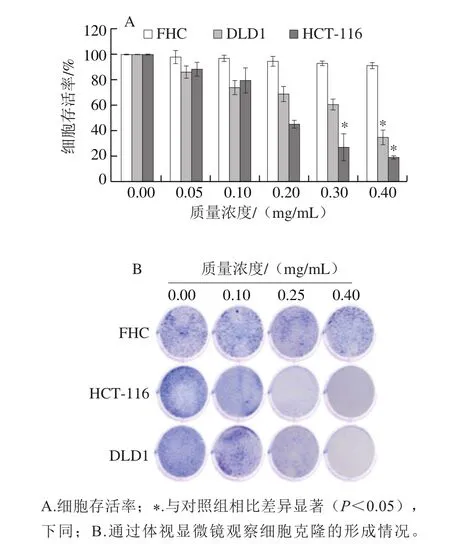
图1 胡麻粕多酚对肿瘤细胞增殖的影响Fig. 1 Effect of flax meal polyphenols on tumor cells proliferation
2.2 胡麻粕多酚对DLD1和HCT-116细胞凋亡的影响
细胞凋亡是指为维持有机体内环境稳定,由基因控制的细胞自主、有序的死亡[15]。在细胞凋亡早期,膜磷脂酰丝氨酸由脂膜内侧翻向外侧。Annexin V与磷脂酰丝氨酸有高度亲和力,可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的细胞膜特异性结合,用于检测细胞凋亡早期的细胞膜变化。PI是一种核酸染料,能透过凋亡晚期和死细胞的细胞膜,因此Annexin V和PI结合使用可以区分凋亡早、晚期的细胞及死细胞。如图2所示,经不同质量浓度的胡麻粕多酚处理后,DLD1和HCT-116细胞都发生了不同程度的凋亡,且随着胡麻粕多酚质量浓度的升高,细胞凋亡率呈上升趋势。用0.25 mg/mL和0.40 mg/mL的胡麻粕多酚处理HCT-116细胞48 h后,其凋亡率(Q2+Q4)分别达到82.4%和84.4%,相比于0.00 mg/mL组具有明显的凋亡现象。当用0.25 mg/mL和0.40 mg/mL胡麻粕多酚处理DLD1细胞48 h后,其凋亡率分别达到54.1%和80.9%。以上数据显示,胡麻粕多酚能够促进结肠癌细胞凋亡,且具有浓度依赖性。
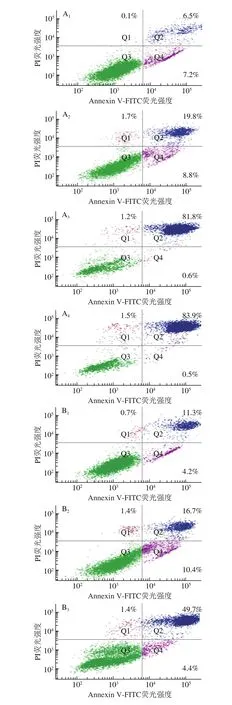
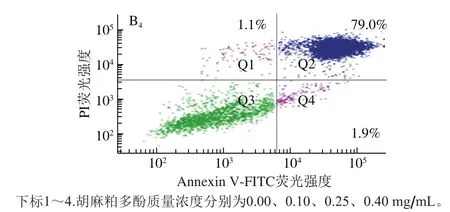
图2 胡麻粕多酚对HCT-116(A)和DLD1(B)细胞凋亡的影响Fig. 2 Effect of different concentrations of flax mea lpolyphenols on the apoptosis of HCT-116 (A) and DLD1 (B) cells
2.3 胡麻粕多酚对DLD1和HCT-116细胞内凋亡相关蛋白表达的影响
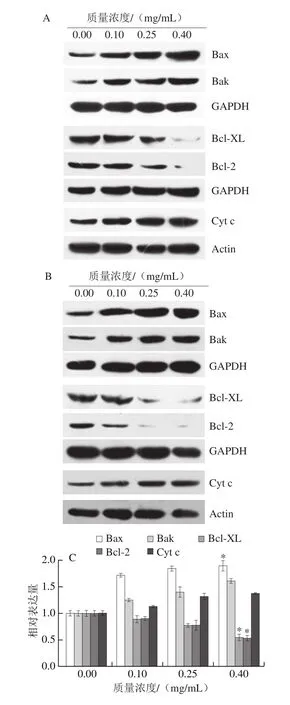
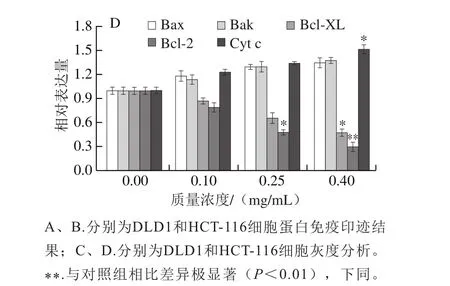
图3 胡麻粕多酚对结肠癌细胞凋亡相关蛋白表达的影响Fig. 3 Effect of flax meal polyphenols on the expression of apoptosisrelated proteins in colon cancer cells
图3 结果显示,胡麻粕多酚能够促进促凋亡因子Bax和Bak在DLD1和HCT-116细胞内的表达;与0.00 mg/mL组相比,0.40 mg/mL胡麻粕多酚处理DLD1和HCT-116细胞后,胞内的Bax表达量显著升高,Bak的表达量升高但不显著。与此同时,随着胡麻粕多酚质量浓度的升高,胞内抑凋亡因子Bcl-2和Bcl-XL的表达受到明显抑制。在胡麻粕多酚质量浓度为0.40 mg/mL时,胞内Bcl-2和Bcl-XL的表达量出现显著下调。在细胞凋亡的内源途径中,Cyt c的释放是关键。图3结果显示,胡麻粕多酚的刺激能够引起线粒体内Cyt c的释放,从而使得胞浆内Cyt c的表达量升高,且呈现浓度依赖性。综上,胡麻粕多酚能够通过线粒体凋亡途径促进结肠癌细胞凋亡。
2.4 胡麻粕多酚对DLD1和HCT-116细胞内ROS水平的影响
DCFH-DA标记DLD1、HCT-116和FHC细胞后,通过测定胞内DCF的荧光强度可以检测细胞内的ROS生成量。如图4A所示,用不同质量浓度的胡麻粕多酚(0.00、0.10、0.25、0.40 mg/mL)处理DLD1、HCT-116细胞48 h后,其能浓度依赖性地诱导DLD1和HCT-116细胞产生ROS。经0.4 mg/mL胡麻粕多酚处理后,DLD1和HCT-116细胞内ROS水平分别增加4.0 倍和5.5 倍。此外,研究显示胡麻粕多酚处理对FHC细胞内ROS的产生无明显影响。经0.40 mg/mL胡麻粕多酚处理后,FHC细胞内ROS水平增加约0.5 倍。由图4B可知,相比于对照组,经6 mmol/L NAC处理后DLD1、HCT-116和FHC细胞内的ROS生成量没有显著变化。用NAC和0.40 mg/mL胡麻粕多酚联合处理细胞48 h明显逆转了胡麻粕多酚增加DLD1和HCT-116细胞内ROS水平的作用。图4C显示,NAC和胡麻粕多酚的联合使用减弱了胡麻粕多酚对DLD1和HCT-116细胞增殖的抑制作用。综上,胡麻粕多酚抑制结肠癌细胞的活性依赖于诱导细胞内ROS的生成。
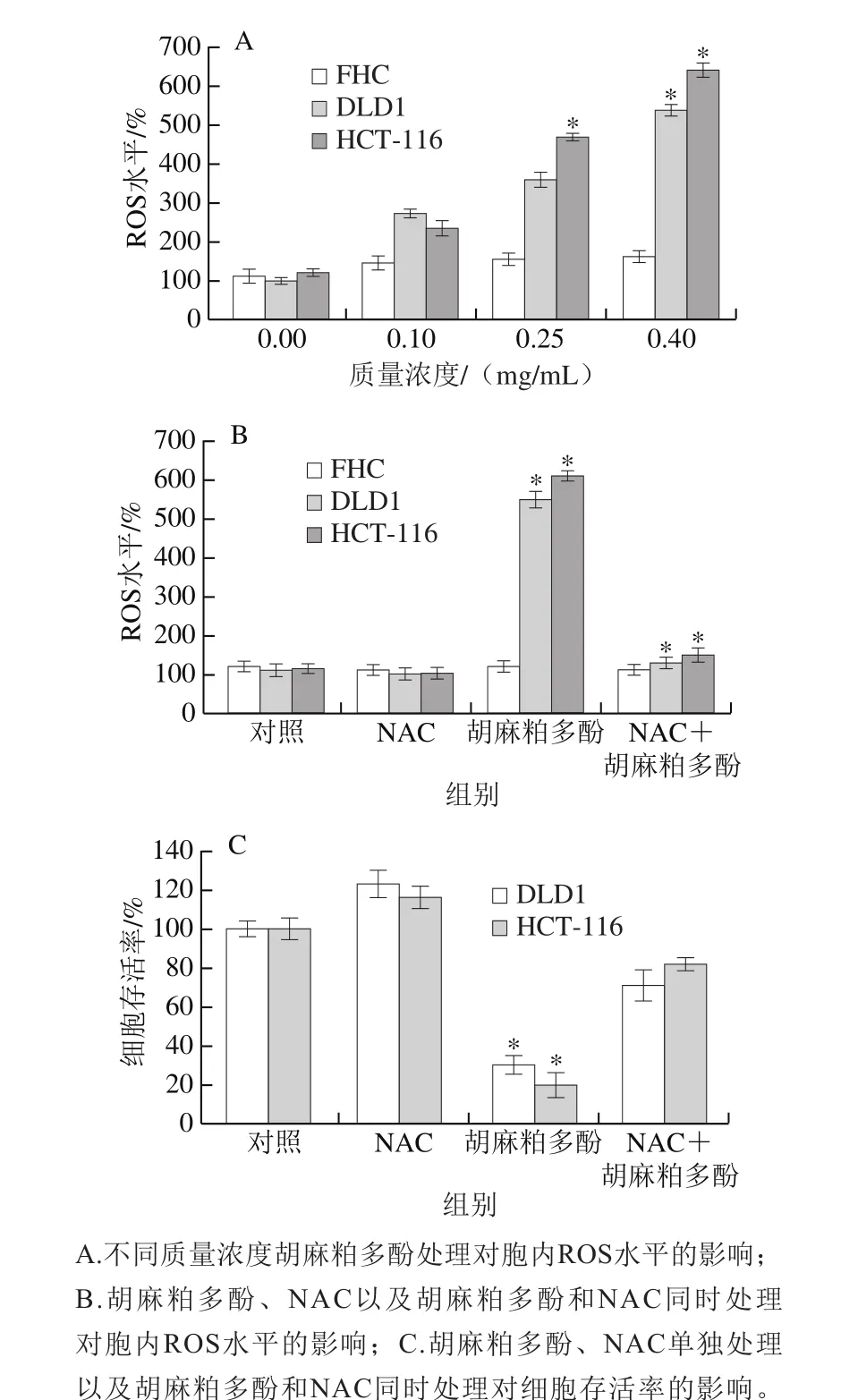
图4 胡麻粕多酚对人结肠癌细胞内ROS水平及存活率的影响Fig. 4 Effect of flax meal polyphenols on intracellular ROS levels and survival rate of human colon cancer
3 讨 论
本研究以大量种植的经济作物胡麻榨油后的副产物胡麻粕为研究材料。在农业方面,胡麻粕目前主要被用作动物饲料,生物利用率极低[16]。然而,胡麻粕中酚酸类物质含量较高,具有极大的开发潜力[17]。本研究采用超声提取法从胡麻粕中获得胡麻粕多酚,发现其具有良好的抗肿瘤作用。这为胡麻粕的生物学应用开拓了广阔的前景,深度开发后能够极大提高胡麻粕的附加值及经济效益。
细胞凋亡是一个主动的由基因决定的结束细胞生命的过程,所以也常被称为细胞编程死亡[18]。Caspases依赖性细胞凋亡途径主要分为由死亡受体起始的外源途径和由线粒体起始的内源途径[19-20]。在线粒体凋亡途径中,Cyt c的释放是关键,源于线粒体外膜通透性的改变[21-22]。本研究检测了胡麻粕多酚对影响线粒体外膜通透性的Hcl-2蛋白家族促凋亡因子Bax、Bak,以及抑凋亡因子Bcl-2和Bcl-XL蛋白表达水平的调控,发现胡麻粕多酚促进了Bax和Bak蛋白表达,抑制了Bcl-2和Bcl-XL蛋白表达,同时胡麻粕多酚促进Cyt c从线粒体释放进入细胞胞浆,证明胡麻粕多酚促进的细胞凋亡属于线粒体凋亡途径。
植物多酚一直以来都被认为是抗氧化成分,具有清除氧自由基的能力[23-26]。值得注意的是,本研究结果表明,胡麻粕多酚能够促进ROS水平的升高,从而促进肠癌细胞的线粒体凋亡,发挥肿瘤细胞抑制活性。有研究表明,酚类化合物既可以作为抗氧化剂,也可以发挥促氧化效应,这取决于其作用浓度和细胞环境[27]。在各种类型的肿瘤细胞中,多酚的促氧化效应与其促凋亡效应有关。在高pH值和具有氧化还原活性的过渡金属存在的情况下,酚类化合物可以作为促氧化剂[28]。许多恶性肿瘤细胞中铜离子浓度较高,而铜离子和多酚之间进行氧化还原的循环体系可以产生ROS,促进DNA断裂以及细胞凋亡[10]。目前已有研究发现,木犀草素、芹菜素和白藜芦醇等植物多酚能够抑制细胞增殖,并诱导不同癌细胞凋亡,利用金属螯合剂清除亚铜离子或者细胞内ROS都能够在很大程度上阻止多酚类物质引起的细胞死亡[29]。因此,植物多酚与铜离子的这种调节机制解释了多酚类化合物对癌细胞的特异性杀伤机制。本研究发现胡麻粕多酚能够在结肠癌细胞中同时发挥促氧化作用和促凋亡作用。因此,推测胡麻粕多酚是通过与细胞内的金属离子结合从而导致ROS水平升高,进一步诱导癌细胞凋亡,相应的机制研究将是下一步工作的重点。

