不同巴氏杀菌条件下的牛源乳铁蛋白对IEC-6细胞增殖的影响
席恩泽,赵 晓,崔东影,盛 雪,李梦寒,许晓曦
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
婴儿出生时肠道发育尚未成熟,肠道免疫发育缓慢[1],这使得他们更容易发生各种并发症,包括乳糖不耐受、产后生长受限、感染和坏死性小肠结肠炎等。母乳含有许多生物活性成分,有助于婴儿肠道生长和发育,其中重要的一种组分就是乳铁蛋白[2]。乳铁蛋白属于转铁蛋白家族,是一种分子质量为78 kDa的非血红素铁结合糖蛋白,含有约690 个氨基酸残基[3]。除了促进肠道细胞生长和发育外,乳铁蛋白还具有抗菌、抗真菌、抗病毒、抗菌、抗氧化、抗炎、抗寄生虫、抗过敏和抗癌特性[4-5]。因此,关于乳铁蛋白调节肠道免疫功能的研究近年来受到了学者的广泛关注。目前,乳铁蛋白已成为婴儿配方奶粉的主要功能性添加成分,而针对牛源乳铁蛋白对婴儿肠道及免疫的影响尚鲜有探究。迄今为止,母乳喂养是保留乳中免疫蛋白生物活性的最佳方法。但由于各种原因,仍有至少一半的新生儿及婴儿无法通过母乳喂养获得相应的营养物质及免疫功能,需要通过配方奶粉及配方乳替代母乳。传统的配方奶粉及配方乳为了保证产品的安全性必须进行较高温度的热处理,从而导致蛋白质变性、维生素损失等问题,并会产生一些美拉德反应产物。此外,热处理会诱导乳蛋白的变性和聚集,从而改变其生物活性和结构特性[6]。乳铁蛋白具有热敏性,其铁结合能力高度依赖于独特结构,热处理可能对其免疫活性产生影响。
热处理对乳铁蛋白的结构、铁结合能力[7]、抑菌功能[8]、促成骨细胞增殖和分化功能[9]的影响是目前研究的热点。但至今对巴氏杀菌后乳铁蛋白影响肠道免疫的机制,特别是肠细胞增殖方面的探讨仍鲜见报道。因此,本研究旨在探讨乳铁蛋白在常见巴氏杀菌条件下被婴儿胃肠液进一步水解后的免疫功能,并进一步探究乳铁蛋白对肠道免疫的作用机制。以期为乳铁蛋白作为营养添加剂在婴儿配方食品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
牛鲜乳来源乳铁蛋白 美国Hilmar公司;胃蛋白酶、胰蛋白酶 北京索莱宝生物技术公司;大鼠小肠隐窝上皮细胞(IEC-6) NTCC典型培养物保藏中心;DMEM培养基和胰酶 美国Gibco公司;胎牛血清加拿大MULTICELL公司;磷酸盐缓冲液 北京BioTopped公司;CCK-8试剂盒 南京建成生物工程研究所;细胞周期与细胞凋亡检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、双抗 上海碧云天生物技术公司;培养细胞/细菌总RNA提取试剂盒 北京天根生化科技有限公司;PrimeScriptTMRT Reagent Kit with gDNA Eraser、SYBR Premix Ex TaqTMKit 大连宝生物工程有限公司;引物 上海生工生物工程股份有限公司。
1.2 仪器与设备
HF90型CO2培养箱 北京市六一仪器厂;AE-31型倒置显微镜 麦克奥迪实业集团有限公司;BPG-9070A鼓风干燥箱 上海一恒科技有限公司;MHBS-1096A酶标仪 南京DeTie公司;BSA224S分析天平 德国Sartorius公司;DSX-280B高压灭菌锅 上海申安公司;3K15高速冷冻离心机 德国Sigma公司;FACSAria流式细胞仪 美国BD公司;Step One Plus实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国赛默飞世尔公司。
1.3 方法
1.3.1 乳铁蛋白加热处理及实验分组
准确称取1 g牛源乳铁蛋白,溶于10 mL超纯水中,置于铝盒中水浴加热,加热条件分别为63 ℃、30 min,72 ℃、15 s和85 ℃、15 s。实验分为5 组,分别为空白组、未热处理组、63 ℃/30 min组、72 ℃/15 s组和85 ℃/15 s组。空白组为基础培养基,未热处理组为添加不经过热处理的乳铁蛋白水解液。
1.3.2 体外模拟婴儿胃肠道消化
按照文献[10]所述方法模拟消化环境,并稍作改动。模拟胃液:用1 mol/L盐酸调至pH 4,加入蒸馏水定容至100 mL,加入0.8 g胃蛋白酶,然后将1.3.1节中的乳铁蛋白液加入模拟胃液。保持37 ℃,在摇床中振荡孵育1.5 h。模拟肠液:将上述模拟胃液用1 mol/L氢氧化钠调至pH 6.5,加入6.8 g K2HPO4、1 g胆盐[11]和1 g胰蛋白酶,继续37 ℃恒温振荡孵育2 h,85 ℃水浴加热5 min使酶灭活[12]。
1.3.3 细胞培养
将IEC-6细胞培养于含质量分数5%胎牛血清、1%双抗的DMEM培养液中,置于CO2细胞培养箱中培养。
1.3.4 不同条件巴氏杀菌后的乳铁蛋白水解液对IEC-6细胞增殖的影响
将未热处理组和3 种热处理组的乳铁蛋白水解液溶于含质量分数1%胎牛血清的DMEM培养液中,配制不同质量浓度的乳铁蛋白水解液刺激IEC-6细胞。将1.3.3节所培养的细胞调至1×104个/mL,每孔100 μL接种到96 孔培养板中,饥饿处理24 h后,分别添加不同质量浓度的乳铁蛋白水解液,培养24、48 h后吸除培养液,每孔加入100 μL含质量分数10% CCK-8的1%胎牛血清DMEM培养液,37 ℃孵育2 h,酶标仪450 nm波长处振荡60 s测定OD值,比较各组OD值以判断4 种处理方式的乳铁蛋白水解液(未热处理、63 ℃/30 min、72 ℃/15 s和85 ℃/15 s组)作用于细胞的最佳质量浓度。细胞增殖率计算公式如下。

1.3.5 不同条件巴氏杀菌后的乳铁蛋白水解液对IEC-6细胞周期的影响
将1.3.3节所培养细胞接种于细胞培养皿中,细胞浓度为2×105个/mL,饥饿处理,当细胞融合至70%后,加入最佳质量浓度的乳铁蛋白水解液,分别培养24、48 h后,按照细胞周期试剂盒说明书进行操作,将所收集的细胞置于流式细胞仪进行检测,并采用ModFit LT软件进行分析。
1.3.6 不同条件巴氏杀菌后的乳铁蛋白水解液对IEC-6细胞凋亡的影响
将1.3.3节所培养的细胞接种于细胞培养皿中,细胞浓度为1×105个/mL,饥饿处理,当细胞融合至70%后加入最佳质量浓度的乳铁蛋白水解液,分别培养24、48 h后,按照细胞凋亡试剂盒说明书进行操作,将所收集的细胞置于流式细胞仪进行检测。
1.3.7 不同条件巴氏杀菌后的乳铁蛋白水解液对细胞周期相关基因表达的影响
将1.3.3节所培养的细胞接种于细胞培养皿中,细胞浓度为4×106个/mL,饥饿处理,当细胞融合至80%后,加入最佳质量浓度的乳铁蛋白水解液进行培养,并按照试剂盒步骤提取细胞RNA、反转录cDNA、添加引物。采用两步法PCR扩增标准程序,扩增反应参数为:95 ℃预变性30 s;95 ℃变性3 s,60 ℃退火30 s,循环40 次。结果采用仪器自带软件进行分析,采用2-ΔΔCt法计算[13]。PCR引物如表1所示。

表1 实时荧光定量PCR引物Table 1 Primers used for qPCR
1.4 数据统计与分析
数据均使用Statistix 8软件进行单因素方差分析,并用Origin 8.5软件作图,结果以平均值±标准差表示。
2 结果与分析
2.1 巴氏杀菌后的牛源乳铁蛋白水解液对IEC-6细胞增殖的影响
实验初期质量浓度选定范围为0~1 mg/mL中几个关键点质量浓度。结果显示细胞增殖率以0.1 mg/mL为分界线,当质量浓度小于0.1 mg/mL时细胞增殖率逐渐增大;当质量浓度大于0.1 mg/mL时细胞增殖率呈现降低趋势。最终选定最佳质量浓度范围为0~0.1 mg/mL内几个关键点质量浓度进行实验,并计算分别培养24、48 h时的细胞增殖率,结果如图1所示。
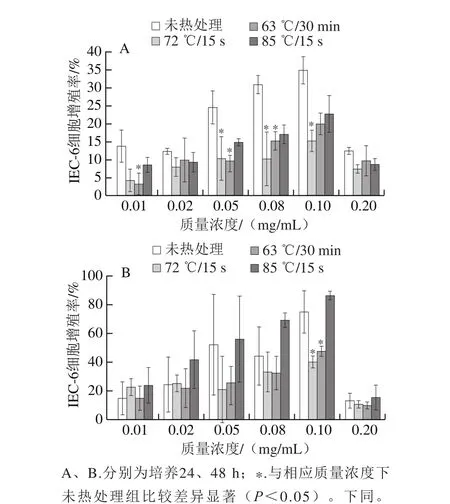
图1 巴氏杀菌后乳铁蛋白水解液对IEC-6细胞增殖的影响Fig. 1 Effect of lactoferrin hydrolysates on the proliferation of IEC-6 cells
如图1所示,随着乳铁蛋白水解液质量浓度的升高,IEC-6细胞增殖率逐渐升高,且呈剂量依赖,在质量浓度为0.1 mg/mL时细胞增殖率达到最大;当质量浓度在0.1 mg/mL以上时细胞增殖率开始呈现下降趋势。综合24 h和48 h细胞增殖率数据来看,与未热处理的牛源乳铁蛋白水解液相比,除了63 ℃/30 min组,其他2 种热处理方式对乳铁蛋白的免疫活性没有明显的破坏作用,加热并没有使乳铁蛋白的免疫活性基团完全失活,4 种处理方式下的乳铁蛋白水解液最佳增殖质量浓度均为0.1 mg/mL。
2.2 巴氏杀菌后的牛源乳铁蛋白水解液对IEC-6细胞周期的影响
细胞周期进程涉及G0期、G1期、S期、G2期和M期。在G0期时细胞静止、停止分裂。在G1期时,细胞的大小、体积增加,并准备在S期发生细胞DNA合成与复制。G2期是DNA合成和有丝分裂之间的间隙,确保细胞准备就绪。进入M阶段时细胞有序地分裂成两个子细胞[14]。
细胞周期分布比例通常被认为是细胞存活、生长和增殖的主要参数。为探究3 种巴氏杀菌处理方式下牛源乳铁蛋白水解液对肠细胞增殖的机制,采用质量浓度为0.1 mg/mL的牛源乳铁蛋白水解物分别作用于IEC-6细胞24、48 h后,通过流式细胞术分析其对细胞周期的影响及各周期所占比例。
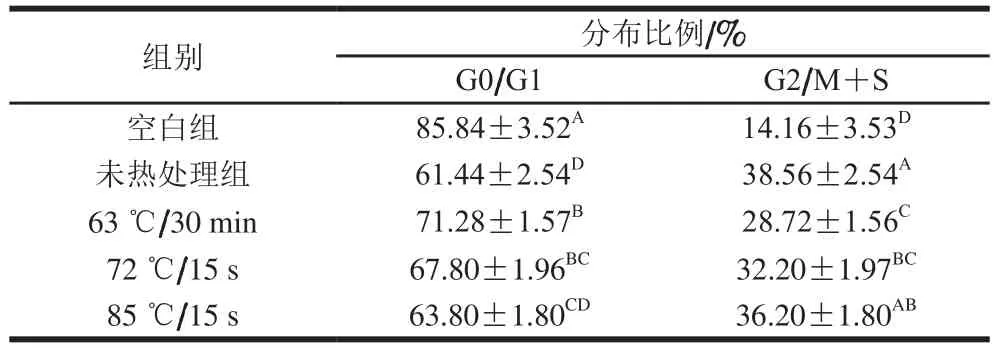
表2 0.1 mg/mL乳铁蛋白水解液作用24 h对IEC-6细胞周期的影响Table 2 Effect of 0.1 mg/mL lactoferrin hydrolysates on cell cycle of IEC-6 cells incubated for 24 h

表3 0.1 mg/mL乳铁蛋白水解液作用48 h对IEC-6细胞周期的影响Table 3 Effect of 0.1 mg/mL lactoferrin hydrolysates on cell cycle of IEC-6 cells incubated for 48 h
如表2、3所示,用63 ℃、30 min,72 ℃、15 s和85 ℃、15 s热处理条件下的乳铁蛋白水解液处理IEC-6细胞24 h后,与空白组相比,G0/G1期分布比例由85.84%分别降至61.44%、71.28%、67.80%和63.80%;处理48 h后分别从85.11%下降到61.64%、74.61%、73.58%和69.97%,且差异显著(P<0.05)。表明牛源乳铁蛋白通过降低细胞G0/G1期比例来促进肠道细胞增殖。与未热处理的乳铁蛋白水解液相比,除85 ℃/15 s组外,其余2 种热处理方法均显著降低IEC-6细胞在G2/M+S期的比例(P<0.05),表明85 ℃、15 s对乳铁蛋白的免疫活性基团无明显破坏。
2.3 巴氏杀菌后的牛源乳铁蛋白水解液对IEC-6细胞凋亡的影响

表4 0.1 mg/mL乳铁蛋白水解液作用24 h对IEC-6细胞凋亡的影响Table 4 Effect of 0.1 mg/mL lactoferrin hydrolysates on cell apoptosis of IEC-6 cells incubated for 24 h

表5 0.1 mg/mL乳铁蛋白水解液作用48 h对IEC-6细胞凋亡的影响Table 5 Effect of 0.1 mg/mL lactoferrin hydrolysates on cell apoptosis of IEC-6 cells incubated for 48 h
程序性细胞死亡简称细胞凋亡,与许多调节细胞增殖和组织稳态的生理生长控制机制有关,是细胞死亡的主要形式[15]。如表4、5所示,与空白组相比,经0.1 mg/mL牛源乳铁蛋白水解液处理24、48 h后,IEC-6细胞凋亡率尤其是晚期凋亡率明显降低。与未热处理组相比,3 种巴氏杀菌方式对乳铁蛋白活性无明显破坏作用。但随着实验时间的延长,乳铁蛋白水解液抑制细胞凋亡的作用开始减弱。
2.4 巴氏杀菌后的牛源乳铁蛋白水解液对细胞周期相关基因表达量的影响
由于4 种牛源乳铁蛋白水解物均可促进IEC-6细胞增殖,本实验试图从基因水平阐明这种增殖作用的潜在机制。因作用24、48 h的增殖趋势相同,本实验采用0.1 mg/mL牛源乳铁蛋白水解液刺激IEC-6细胞24 h,通过荧光定量PCR计算细胞周期相关基因表达量以阐明增殖机制。


图2 巴氏杀菌后乳铁蛋白水解液对细胞周期相关基因表达量的影响Fig. 2 Effect of lactoferrin hydrolysates on cell-cycle gene expression in IEC-6 cells
如图2所示,p21是抑制细胞周期进程的重要基因之一[16],PCR结果显示,与空白组相比,除63 ℃/30 min组外,在其他3 种乳铁蛋白水解液作用下,p21表达水平显著降低(P<0.05)。Cyclin E1可与其激酶CDK2结合,是调节细胞从G1期到S期过渡的重要基因[17]。与空白组相比,除63 ℃/30 min组外,cyclin E1基因表达量在其他3 种牛源乳铁蛋白水解液中均显著增加(P<0.05),这表明牛源乳铁蛋白可推进细胞周期进程。细胞周期蛋白Cyclin B1/CDK1复合物是细胞进入有丝分裂的关键调节因子,大量的底物蛋白质被Cyclin B1/CDK1复合物在进入有丝分裂之前磷酸化,有丝分裂的调节与Cyclin B1/CDK1复合物的活性有关。PCR结果显示,与空白组相比,cyclin B1和CDK1基因在种牛源乳铁蛋白水解液作用下表达水平均升高。结果表明,4 种乳铁蛋白水解液通过提高cyclin B1、CDK1、cyclin E1基因表达量,降低基因p21表达量,促进细胞增殖。
与未热处理组相比,除85 ℃/15 s外,其余2 种热处理方式下的乳铁蛋白水解液均能显著降低cyclin B1、CDK1和cyclin E1的表达水平(P<0.05),显著提高p21的表达水平(P<0.05),抑制细胞周期进程,但抑制作用显著低于空白组。由此说明巴氏杀菌虽可降低乳铁蛋白的免疫活性,但并未使其完全失活。
3 讨 论
随着冷链基础设施的完善和“防腐保鲜防热伤害保活性”理念的普及[18],巴氏杀菌乳成为液体乳发展的必要趋势。通过对巴氏杀菌乳和超高温瞬时灭菌乳的比较可知,随着热处理强度的增加,乳中的功能性成分如α-乳白蛋白和乳铁蛋白的含量不断减少,而巴氏杀菌乳只是轻微的热处理,在保证卫生安全的同时,更多地保留了牛奶中的活性物质[19]。
目前的研究只停留在加热诱导变性方面,这会使乳中天然蛋白含量减少,但并没有直接证据表明会使其功能丧失[20]。因此,进一步研究热处理是否破坏乳中免疫活性蛋白的免疫功能十分必要。另外,关于热处理对乳铁蛋白影响的研究虽多,但主要集中于结构[21]、铁结合能力和抑菌性等,对其免疫活性虽有涉及[22],但关于肠道免疫活性方面鲜有研究。本研究着眼于肠道免疫,利用体外实验优化工艺参数,为新型乳制品加工提供基础研究数据。
实验结果表明,与未热处理的乳铁蛋白水解液相比,3 种巴氏杀菌方式并没有使乳铁蛋白完全失活,仍可促进IEC-6细胞的增殖。通过提高cyclin B1、CDK1、cyclin E1基因表达量,降低p21基因表达量,增加细胞在G2/M和S期所占比例,推进细胞周期进程,降低细胞凋亡率。本研究结果表明,乳铁蛋白通过促进肠道细胞增殖调节肠道免疫。巴氏杀菌可能使乳铁蛋白的活性基团暴露,使乳铁蛋白形成一种展开的中间构象,其构象与未经过热处理的乳铁蛋白不同,但仍具有生物活性[23]。且婴儿消化道中的消化液,尤其是胃蛋白酶,不能将乳铁蛋白完全消化,在婴儿的小肠中仍存在完整的乳铁蛋白[24]。乳铁蛋白被肠道上皮细胞表面的乳铁蛋白接受器所识别后,进入细胞核并与特定的DNA结合位点结合,调节DNA的转录[25],从而显著地促进肠道上皮细胞的增殖。产后早期是新生儿肠胃结构和功能发育的关键时期,乳铁蛋白可以促进婴儿肠道上皮细胞的增殖,进而改善婴儿的消化吸收能力,提高婴儿肠道免疫活性[2]。
最新研究表明,采用添加乳铁蛋白的婴儿配方粉喂养0~4 周健康新生儿,并进行为期1 年的随访调查,发现乳铁蛋白可降低新生儿患下呼吸道感染尤其是哮喘的概率,且在出生后6 周体质量增长迅速[26]。乳铁蛋白作为一种多功能免疫蛋白,已被证实在临床方面具有辅助治疗作用,可预防或治疗由细菌、真菌等引起的感染[27-28]。新生儿尤其是早产儿免疫系统尚未成熟,适当补充乳铁蛋白可减少婴儿促免疫力类药物的使用,避免给婴儿肝肾造成负担。
本研究从婴儿肠道免疫角度出发,体外模拟婴儿肠胃环境,利用乳铁蛋白水解液刺激肠道细胞得出最佳剂量,与以往直接使用乳铁蛋白刺激肠道细胞而忽略体内消化这一重要步骤的做法[29-30]相比更符合人体正常消化代谢规律。下一步的研究应该以此剂量为参照,结合肠道微生物利用率,通过动物及人体喂养实验,最终确定婴儿配方食品中乳铁蛋白的最佳添加剂量,使其真正起到提高婴儿免疫力的作用,为婴儿配方食品的生产及产品品质的提升提供科学的研究数据。
4 结 论
巴氏杀菌后牛源乳铁蛋白均可通过增加基因cyclin B1、CDK1和cyclin E1的表达水平,降低p21的表达水平促进IEC-6细胞增殖,减缓细胞凋亡。巴氏灭菌虽可部分损伤乳铁蛋白的免疫活性基团,但不能使其完全失活。选择适宜的工艺参数如72 ℃、15 s和85 ℃、15 s可最大化地保留乳铁蛋白的免疫活性。通过体外实验得出乳铁蛋白水解液促进婴儿肠道免疫的最佳剂量为0.1 mg/mL。巴氏杀菌可以很好地保留生鲜乳中免疫蛋白的免疫活性,这为现阶段乳制品加工工艺参数设计以及营养补充剂添加量提供理论依据,为国内本土生鲜乳加工利用提供新的方向。

