ALDH1在食管鳞癌组织中的表达及与预后的关系
孔金玉,原 翔,刘怡文,孙 蔚,谷变利,兰子君,高社干
中国是世界上食管癌发病率和病死率最高的国家,其中河南省是食管癌高发区[1]。食管癌中90%以上为鳞状细胞癌[2]。肿瘤干细胞是肿瘤发生的始动细胞,是肿瘤发生、发展、侵袭、转移、复发及耐药的决定因素[3]。ALDH1在癌组织中的表达异常亦为众多研究文献所证实[4]。ALDH1在癌组织的表达情况,通常也提示肿瘤的恶性程度,并且与预后有关[5]。但目前很少有研究ALDH1在食管鳞癌组织中的表达及预测食管癌患者临床预后的文献报道。本研究通过检测ALDH1在食管鳞癌组织中的表达情况,探讨其与食管鳞癌的临床病理特征和预后的关系,为食管癌早期诊断、分子靶向治疗以及更为确切的预测临床预后提供理论依据。
1 资料与方法
1.1 一般资料本研究为回顾性研究,收集2012年1月至2012年12月河南科技大学第一附属医院肿瘤科手术切除的食管鳞癌患者的组织标本100例,其中男62例,女38例;年龄42~79岁,平均61岁,中位年龄62岁;高分化26例,中分化56例,低分化18例;淋巴结转移者28例;TNM分期Ⅰ/Ⅱ期74例,Ⅲ期26例。肿瘤标本取自原发灶,取出后甲醛固定,石蜡包埋。所有患者均经病理学确诊为食管鳞癌,且术前均未接受放化疗及免疫治疗,并于术前获得患者书面知情同意。
1.2 主要试剂与仪器ALDH1兔抗人多克隆抗体(ab72543)购自美国Abcam公司;免疫组织化学SP超敏试剂盒、DAB显色剂购自北京中杉金桥生物技术有限公司;柠檬酸抗原修复液(pH6.0)、苏木精、中性树胶购自索莱宝生物科技有限公司;光学显微镜购自尼康生物有限公司。
1.3 免疫组织化学法检测食管鳞癌中ALDH1蛋白的表达取石蜡包埋的食管鳞癌组织标本,制成4 μm厚石蜡切片;于60 ℃溶蜡1.5 h,二甲苯脱蜡3次,每次10 min,100%乙醇、95%乙醇、95%乙醇、85%乙醇梯度水化,经0.01 mol·L-1柠檬酸盐缓冲液抗原高压热修复。用免疫组织化学SP试剂盒(北京中杉金桥生物科技有限公司 SP-9000)检测ALDH1蛋白表达。兔抗人ALDH1多克隆抗体浓度为1∶200。以0.01 moL·L-1的PBS(pH7.5)代替一抗作为阴性对照。观察食管鳞癌组织中ALDH1蛋白的表达,以组织中显示棕黄色为ALDH1表达阳性。根据组织切片胞质及胞核着色的强度和染色面积进行综合评分,将“-”定为阴性,“+”“++”和“+++”定为阳性。
1.4 随访根据病历信息记录电话、地址等,采用门诊及电话的方式进行随访,电话随访失败,则通过地址单位及街道或村委会再次联系随访,死于其他疾病、失访或随访截止时间仍存活视为截尾数据,随访截止时间为2017年6月15日。100例患者中死亡60例,均死于食管癌相关的并发症或复发、远处转移;失访2例,失访率为2.00%。总生存期(overall survival,OS)定义为从肿瘤确诊起至末次随访或者任何原因引起的死亡。
1.5 统计学处理采用SPSS 19.0统计学软件进行分析,采用卡方检验比较ALDH1在食管鳞癌组织中的表达与临床病理特征的相关性。应用Kaplan-Meier法绘制生存曲线并以Log-rank检验生存时间之间的差异,以COX比例风险模型进行单因素和多因素分析,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 ALDH1在食管鳞癌组织中的表达情况应用免疫组化SP法检测100例食管鳞癌组织中ALDH1蛋白的表达。结果发现ALDH1蛋白质主要位于细胞质,阳性染色呈棕黄色颗粒;ALDH1在食管鳞癌组织中的阳性率为58.00%(58/100),见图1。
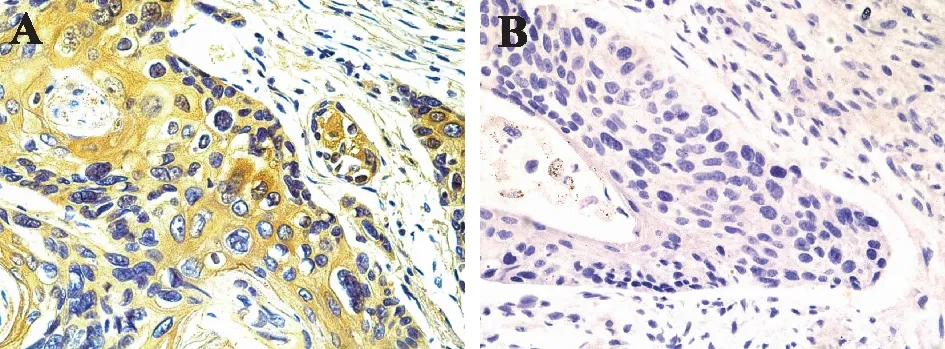
A:ALDH1阳性;B:ALDH1阴性。图1 食管鳞癌组织中ALDH1的表达(DAB染色,×400)
2.2 ALDH1表达与食管鳞癌患者临床病理特征的关系应用χ2检验分析ALDH1蛋白表达与食管鳞癌临床病理特征的相关性,结果发现ALDH1蛋白表达与肿瘤淋巴结转移和临床分期显著相关(P<0.05)。有淋巴结转移组中ALDH1阳性率为71.43%,显著高于无淋巴结转移组(45.83%),差异具有统计学意义(χ2=5.302,P<0.05)。早期患者(Ⅰ期)中ALDH1蛋白表达阳性率为33.33%,显著低于晚期(Ⅲ期)患者(84.62%),差异具有统计学意义(χ2=13.670,P=0.001)。而食管鳞癌组织中ALDH1蛋白表达与年龄、性别及分化程度无显著相关性,见表1。
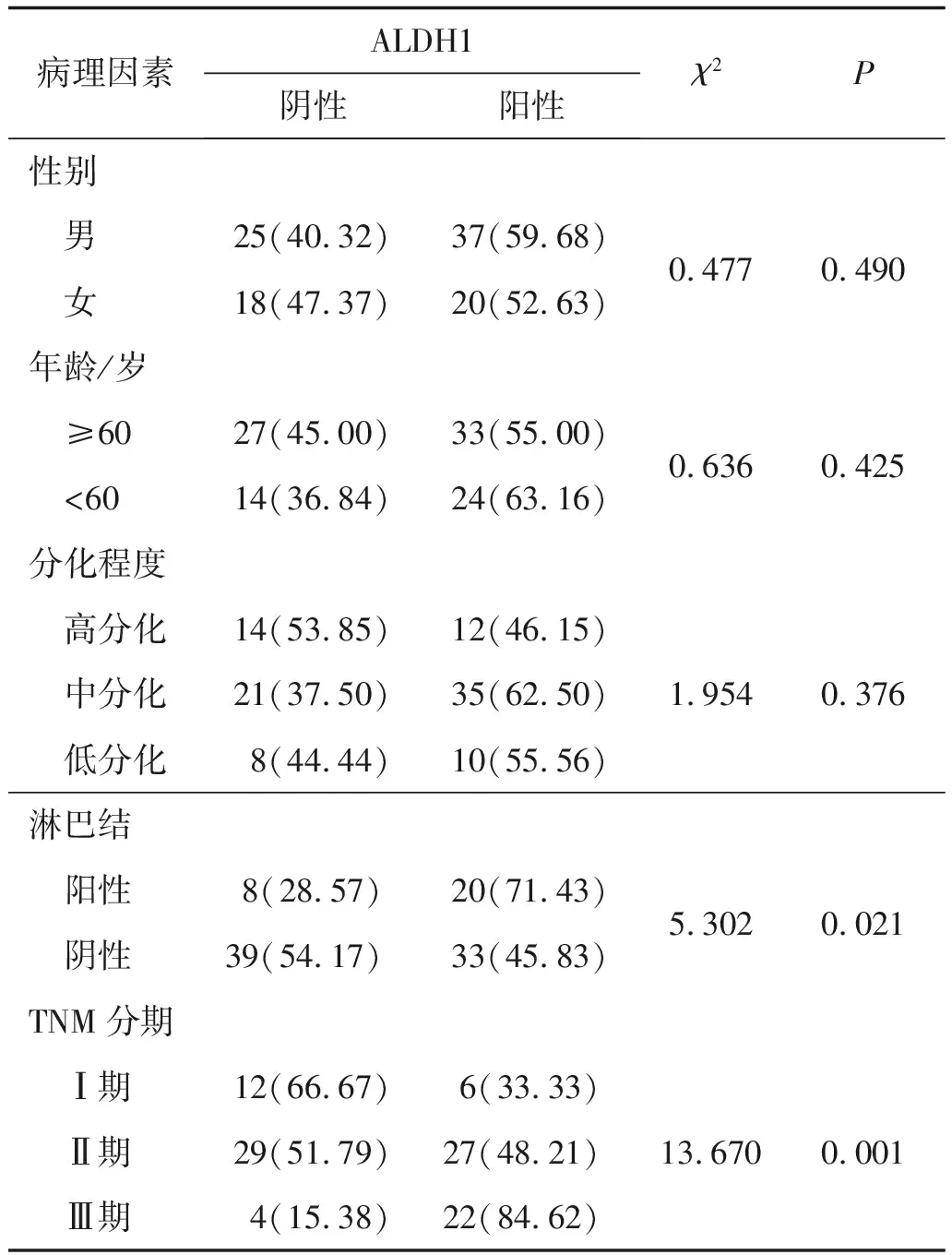
表1 ALDH1蛋白表达与食管鳞癌患者临床病理特征的关系 例(%)
2.3 ALDH1在食管鳞癌组织中的表达与预后的关系应用Kaplan-Meier绘制生存曲线并以Log-rank检验生存时间之间差异,分析ALDH1蛋白表达与食管鳞癌患者预后的相关性,结果发现100例食管鳞癌患者术后ALDH1蛋白阴性表达组5 a生存率(51.00%)明显高于阳性组(23.00%),提示ALDH1蛋白阳性组生存预后较差(χ2=8.623,P=0.003)。见图2。
应用COX回归分析100例成功完成术后随访的食管鳞癌患者,单因素分析结果显示淋巴结转移、临床分期及ALDH1表达与总生存期相关(P<0.05);COX多因素分析结果显示,ALDH1表达是食管鳞癌独立的危险因素(P<0.05),见表2。
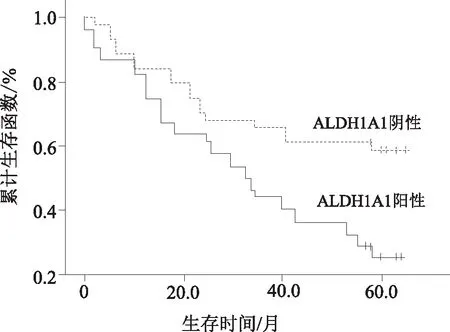
图2 ALDH1表达在食管鳞癌中的生存曲线
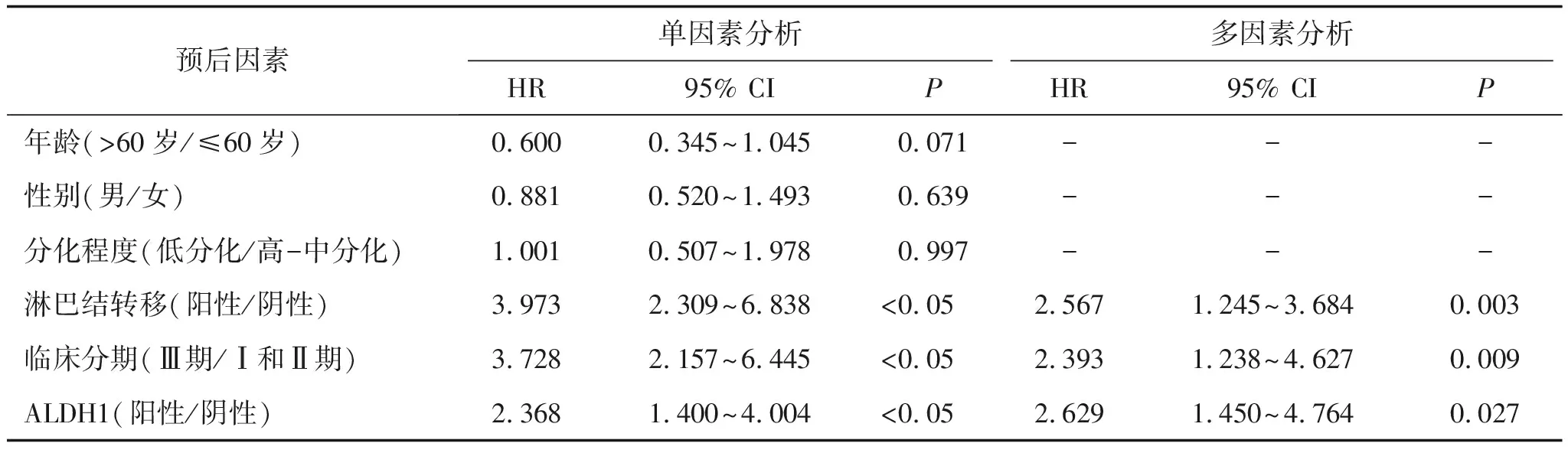
表2 食管鳞癌患者预后影响因素的COX回归分析
3 讨论
食管癌在我国环太行山脉附近的省份明显高发,其中河南林州是食管癌世界高发区[6],因食管癌早期临床表现缺乏特异性,出现症状时大多已属于晚期(Ⅲ/Ⅳ期),往往错过了最佳治疗时期,预后较差,5 a生存率为30%[7]。随着诊疗技术的不断提高,食管鳞癌5 a生存率有所提高,但总体死亡率仍居高不下。因此,寻找具有特异性和敏感性的肿瘤标志物将有利于食管癌的早期发现,为食管癌治疗提供可能的新靶点,具有极其重要的意义。
ALDH1位于细胞质,是一种含锌酶类,可通过氧化视黄醇参与细胞的生长和分化。2007年Ginestier等[8]发现ALDH1是乳腺癌干细胞的标记物,揭开了ALDH1在干细胞领域研究的篇章。此后,在结直肠癌、头颈部鳞状细胞癌、贲门癌、肺癌、膀胱癌等多种肿瘤干细胞中均发现有ALDH1表达[9-14]。目前已证实ALDH1是结肠癌、乳腺癌、肺癌、卵巢癌等的通用标志物[15-18]。其与患者临床治疗及预后的相关性研究亦逐步展开。
本研究表明ALDH1位于细胞质中,食管鳞癌组织中有一定的高表达率(58.00%),与现有ALDH1在其它肿瘤组织中的表达情况一致。同时有研究发现其在肿瘤组织中表达或活性与患者的预后具有显著的相关性,Ma等[19]发现ALDH1高表达患者的预后明显差于ALDH1低表达患者。宫颈癌组织中ALDH1高表达是一个独立的危险因素,它预示着较低的生存率[20],在头颈部肿瘤方面Chen YC等[10]研究也发现,在头颈部鳞癌的治疗过程中AIDH1高表达患者显示出明显的治疗耐受,而低表达患者在受到相同治疗时,表现出较好的治疗效果,且预后优于ALDH1高表达患者。本研究发现ALDH1蛋白的表达与肿瘤的临床TNM分期和淋巴结转移密切相关,提示ALDH1表达阳性的患者临床分期晚、易于转移。这与国外的研究基本一致[21-22]。同时,也说明了食管鳞癌干细胞具有较强的分化、生长能力,能够直接导致患者的复发与远处转移。
本研究ALDH1表达、淋巴结转移情况、TNM分期与患者生存率相关,是影响食管鳞癌患者生存率的独立预后指标,这与国外的研究相同[23]。这也说明,ALDH1作为食管鳞癌肿瘤干细胞的标志物,能够同淋巴结转移、TNM分期一样,预测食管鳞癌患者的临床预后。
总之,ALDH1 在食管鳞癌中有高表达现象, 且其表达与患者的临床预后密切相关。ALDH1表达与食管鳞癌预后关系的机制目前尚不明确,但是多种恶性肿瘤组织ALDH1过表达,而且ALDH1 蛋白阳性表达的患者总生存率低。ALDH1可能作为食管鳞癌肿瘤干细胞的标志物,且有望成为食管癌干细胞研究和靶向治疗的新方向。

