牙龈卟啉单胞菌通过上调S100A2促进食管鳞癌的侵袭性
焦叶林,刘其伟,阮豪杰,陈 攀,许海军,李孟祥,齐义军,高社干
食管鳞癌(Esophageal squamous cell cancer, ESCC)是全球食管癌的主要组织学类型[1],是中国癌症死亡四大原因之一,占所有食管癌90%以上[2]。由于大多数患者在最初诊断时已经发生了转移,尽管接受了多种治疗方案,ESCC患者的5 a总生存率仅有10%[3]。因此,寻求预防、早期诊断和靶向治疗的分子标志物至关重要。
慢性感染是肿瘤形成与发展的重要因素之一,约有20%肿瘤与感染相关[4-5]。口腔牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)不仅能够引起牙周炎,还与多种全身性疾病密切相关。P.gingivalis富集于ESCC组织并与ESCC低分化、淋巴结转移及预后不良显著相关,提示P.gingivalis可能促进了ESCC演进过程[6]。P.gingivalis感染ESCC细胞前后共鉴定出255个差异表达蛋白质分子,其中S100A2表达上调。本研究进一步分析了ESCC组织中P.gingivalis与S100A2表达一致性,并探讨了S100A2沉默后阻断P.gingivalis对ESCC的促进作用。
1 材料和方法
1.1 实验试剂RPMI 1640培养基(Hyclone,货号 SH30809.01B),胎牛血清(Hyclone,货号SV30184.02),GAM细菌培养基(日水制业株式会社,货号05433),RIPA裂解液(Sigma,货号R0278),Bradford蛋白定量试剂盒(康为,货号CW0013),PVDF膜(Millipore),显色液ECL(康为,CW0049A),β-actin抗兔一抗(CST,货号4970S),S100A2抗兔一抗(Abcam,货号ab109494),HRP标记羊抗兔二抗(Earth,货号110581),细胞侵袭迁移实验使用Transwell迁移小室(Corning,货号3422),Transwell浸润小室(BD,货号354480),细胞转染siRNAs由上海吉玛公司合成生产,免疫组化(Immunohistochemistry,IHC)采用链霉素抗生素蛋白-过氧化物酶连接法,DAB(索莱宝,货号DA1010)。
1.2 细胞株、菌株和组织来源本研究中ESCC细胞系KYSE70细胞由本实验室冻存,P.gingivalisATCC 33277来源于ATCC细胞库,ESCC组织标本来源于河南科技大学第一附属医院2012年至2017年47例ESCC 患者手术标本。
1.3 方法
1.3.1 细胞培养KYSE70用含10%胎牛血清的RPMI 1640培养基在37 ℃、5% CO2培养箱中培养,实验所使用的细胞均处于对数生长期。
1.3.2P.gingivalis培养和感染P.gingivalis用GAM培养基、37 ℃厌氧条件下(85% N2,10% H2和CO2)培养。P.gingivalis感染细胞用MOI 10。
1.3.3 细胞增殖、迁移、侵袭实验于96孔板每孔接种2000个,每组3复孔,分别在P.gingivalis感染后4、6、8、12、24、48、72 h终止培养,用MTT法检测细胞活性,绘制细胞生长曲线。细胞迁移和侵袭实验采用迁移小室,小室上层接种5.0×104个细胞,培养24~48 h后终止实验,固定、0.2%结晶紫染色,显微镜下随机选取5个视野计数。
1.3.4 细胞转染实验siS100A2细胞转染,5 pmol siRNAs和8 μL siRNA-mate混合、室温孵育10 min,然后加入目标细胞,继续培养48~72 h。
1.3.5 蛋白提取细胞培养至收集时,预冷PBS洗3次,加入适量蛋白裂解液,冰上静置5 min,用细胞刮收集细胞于Ep管,4 ℃、13 000 r·min-1离心10 min,收集上清即提取蛋白,Bradford法测定蛋白浓度,-20 ℃保存备用。
1.3.6 Western-bloting配制5%浓缩胶和12%分离胶,蛋白样品30 μg电泳分离,电转至PVDF膜,5%脱脂牛奶室温封闭1 h,一抗4 ℃过夜孵育,二抗室温孵育1 h,ECL显色。
1.3.7 免疫组化采用链霉素抗生素蛋白—过氧化物酶连接法,PBS 1∶500稀释S100A2一抗,DAB显色、苏木素复染检测组织表达。
1.4 统计学处理统计学分析均采用SPSS 17.0统计学软件分析,免疫组化结果分析采用卡方检验,检验水准为P<0.05。
2 结果
2.1P.gingivalis诱导S100A2蛋白水平上调P.gingivalis感染ESCC细胞24 h后,Western blot检测到ESCC细胞KYSE70中S100A2蛋白表达明显上调(见图1)。
2.2 S100A2沉默阻断了P.gingivalis诱导的ESCC细胞的恶性生物学行为siS100A2转染后,MTT细胞增殖实验(图2A)、迁移实验(图2B)和侵袭实验(图2C)检测对照细胞和siS100A2转染KYSE70细胞增殖、迁移和侵袭能力,发现P.gingivalis感染明显增强对照细胞的增殖、迁移和侵袭能力,转染siS100A2的KYSE70细胞的增殖、迁移和侵袭能力明显降低,均有统计学意义(P<0.01)。
2.3 ESCC组织中S100A2表达及S100A2与P.gingivalis丰度相关性IHC检测47例ESCC组织中S100A2表达,发现ESCC组织中S100A2的表达(图3A)明显高于癌旁(图3B)。卡方分析ESCC中S100A2表达与P.gingivalis相关性,统计学分析结果显示ESCC中S100A2表达与P.gingivalis丰度呈正相关,P<0.01(图3B)。
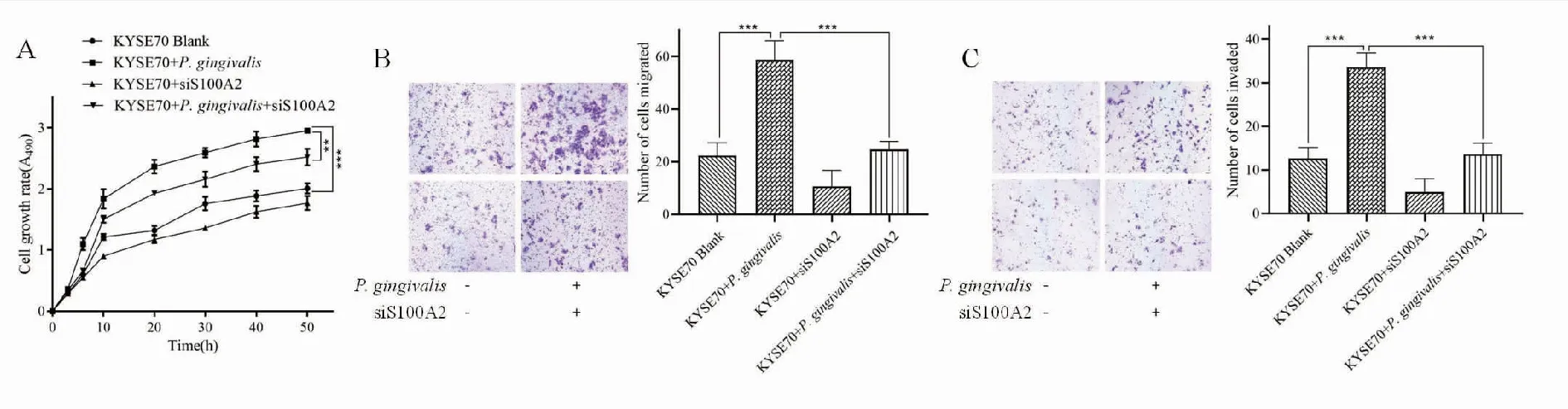
图2 P. gingivalis感染KYSE70细胞、siS100A2转染后KYSE70及对照细胞增殖(A)、迁移(B)和侵袭能力(C)变化
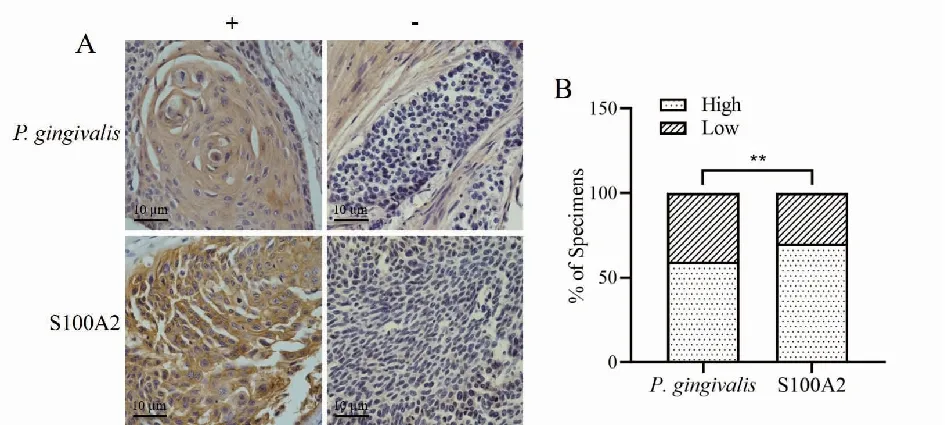
图3 IHC检测ESCC组织中S100A2表达和P. gingivalis丰度(A)、S100A2和P. gingivalis相关性(B)
3 讨论
由于ESCC早期阶段缺乏典型临床症状,目前尚缺乏特异、敏感的ESCC肿瘤标志物分子,而食管胃镜筛查患者依从性差,并且还需专业医务人员,因此,大多数ESCC患者首次就诊时已发展至中晚期,大于50%中晚期病人就诊时已呈现出影像学可见的转移灶[7-9]。因此,明确ESCC病因、鉴定ESCC分子标志物,是有效预防ESCC发生、降低ESCC发生率、提高早期诊断ESCC及靶向治疗的基础。
上消化道微生态紊乱是ESCC 发生发展的重要因素之一[4-6]。正常的食管微生态主要由以链球菌为主的革兰氏阳性菌构成,而食管炎或Barrett’s食管的微生态以革兰氏阴性的厌氧菌为主[10]。流行病学研究表明,口腔P.gingivalis丰度与ESCC发生风险呈正相关,并且ESCC患者口腔微生态多样性显著减少[7-11]。ESCC组织中P.gingivalis丰度明显高于癌旁组织,并且与淋巴结转移呈正相关,与分化程度、生存期呈负相关。
S100A2是 S100 蛋白家族中重要成员,其表达异常与多种肿瘤发生发展相关。S100A2基因位于与上皮细胞分化有关的染色体 1q.21,具有多种生物学功能,如蛋白磷酸化、细胞支架构建及细胞内外钙离子平衡等[12]。此外,研究者也发现 S100A2的异常表达与肿瘤的演进过程相关,如:胃癌中S100A2表达缺失可导致肿瘤的发生,并与肿瘤大小、分化、淋巴转移及预后有关[12-13]。然而,与之相反的是,在大肠癌中,S100A2的过表达增加肿瘤侵袭性[12-14]。Cao等应用IHC分析ESCC中S100A2表达,发现S100A2 mRNA、蛋白的阳性表达率分别为77.5%和72.5%,而正常食管黏膜全部表达S100A2蛋白及 mRNA,S100A2表达下调与肿瘤分化和淋巴转移呈负相关[15-16]。相比正常食管黏膜组织,Barrett’s食管癌中S100A2 蛋白表达量明显增高[15-17]。本研究表明,P.gingivalis能够诱导S100A2表达上调,ESCC组织中P.gingivalis丰度与S100A2表达呈正相关,且S100A2表达降低后,抑制了P.gingivalis诱导的ESCC细胞增殖、迁移及侵袭能力增加。
本研究结果表明,中国华北ESCC高发区P.gingivalis是重要的病因学因素之一,S100A2可能是P.gingivalis促进ESCC演进过程中的重要参与分子之一,是ESCC潜在分子治疗靶点。

