基于下甲状旁腺分型的计划性分离技术在甲状腺乳头状癌中央区清扫中的运用
侯大卫, 徐海娥, 袁冰, 刘建辉, 鲁一兵, 柳明, 王子君, 钱祝银
中央区清扫(central neck dissection, CND)是甲状腺乳头状癌(papillary thyroid carcinoma, PTC)手术治疗的重要组成部分。研究显示中央区淋巴结清扫可以降低甲状腺乳头状癌中央区淋巴结的复发率,但会增加甲状旁腺损伤的可能[1]。目前对于甲状旁腺损伤尚缺乏适宜的激素替代治疗方案,主要治疗手段是补充维生素D和钙剂[2]。尽管给予足够的治疗,甲状旁腺功能减退仍会导致部分患者出现反复低钙症状,引起肾功能减退和脑基底节钙化等病理损害,甚至增加患者的死亡风险[3-4]。因此,CND过程中如何保护甲状旁腺功能至关重要。
相对上甲状旁腺而言,下甲状旁腺(inferior parathyroid glands, IPGs)的解剖变异较大,在CND过程中对IPGs定位和血供保留更困难[5-6]。本研究根据IPGs相对位置和血供特点对其进行分型,并根据IGPs分型计划性地分离甲状腺下极区域,在行甲状腺全切加CND中对IPGs进行策略性保护,效果较好,报道如下。
1 资料与方法
1.1 一般资料 选取2015年1月至2017年12月在南京医科大学第二附属医院接受甲状腺全切加CND的PTC患者159例,手术均由同一组甲状腺专科医师完成。排除标准:①二次手术患者;②合并肾功能不全的患者;③严重消化吸收功能障碍患者;④术前甲状旁腺激素(PTH)或血钙不在正常值范围者。159例患者中89例采用传统精细化被膜分离技术[7]保护甲状旁腺(2017年前手术,A组);70例在传统精细化被膜分离技术基础上加用甲状腺下极区域计划性分离和IPGs策略性保护技术(2017年后,为B组)。
1.2 IPGs分型及其血供特点 A型(甲状腺相关型,占57%):IPGs临近或粘附于甲状腺下极背面,与临近甲状腺组织共享同一下动脉分支(偶尔为上动脉或最下动脉分支)。其血供来自下动脉主要分支者为A1型,血供来自下动脉细小分支者或无法确定血供来源者为A2型。B型(胸腺相关型,占36%):IPGs位于胸腺或胸腺甲状腺韧带内或粘附其表面,常与胸腺共享甲状腺下动脉的分支。IPGs同时位于甲状腺背面和胸甲韧带内者归为B型。甲状腺下极背面(称之为“一面”)和胸腺及胸甲韧带所在的带状区域(称之为“一带”)是IPGs最为常见的分布区域。C型(迷走型,占7%):最常位于气管食管沟,偶尔位于颈鞘表面、颈前肌群的深面,血供来自于下动脉至食管、气管及颈前肌群的分支。
1.3 甲状腺下极区域计划性分离和IPGs策略性保护技术 术中切口和体位与常规甲状腺开放手术相同。切开颈部白线后,先分离甲状腺与颈前肌群和颈鞘间的间隙,依次初步显露分离胸腺上角、胸腺甲状腺韧带、喉返神经、下动脉主干等结构,以下动脉和胸甲韧带为引导,于“一面一带”区域定位IPGs,并观察IPGs与下动脉的关系。对于A1型IPGs,于其腹侧切开甲状腺表面被膜,紧贴甲状腺实质,将旁腺及其供血动脉自甲状腺表面一并分离。对于A2型IPGs,将IPGs连同下动脉分支和一小片甲状腺组织一并分离,对不能可靠保留血供者采用匀浆注射法[5]行自体移植。对血供来自上动脉或最下动脉的IPGs视动脉保留的可行性决定原位保留或自体移植。对于B型IPGs,完整分离胸腺上角及胸腺韧带,尽可能保留下动脉至胸腺的分支。在“一面一带”区域未能发现IPGs情况下,采用精细化被膜分离技术游离甲状腺背面。同时,应该考虑C型IPGs的可能,在后期清扫过程中应注意辨认和保护。术中尽可能显露、保护上旁腺。完成甲状腺切除后,完整分离胸腺及胸腺甲状腺韧带,进一步行下动脉主干和喉返神经的骨骼化分离,保留通向IPGs的分支,最后清除中央区淋巴脂肪组织。术中对切除的标本仔细检查,以发现误切甲状旁腺,对误切甲状旁腺者行自体移植。本研究A组中行IPGs移植18例(At组),B组中行IPGs移植8例(Bt组)。
1.4 观察指标 术后第1天的PTH和血钙水平;术后低PTH(低于8 pg/ml)发生率[8];永久性甲状旁腺功能减退发生率。永久性甲状旁腺功能减退定义为:术后6个月,仍有以下任何一种情况者:PTH低于正常参考值,血钙低于正常参考值,需要使用维生素D或钙剂以缓解低钙症状。

2 结果
2.1 A组和B组患者的一般资料比较 A组的年龄和女性患者比例高于B组,B组中央区淋巴结转移患者的比例高于A组,差异有统计学意义(P<0.05),两组患者的其他临床特征差异无统计学意义,见表1。
表1 A组和B组患者的一般资料比较
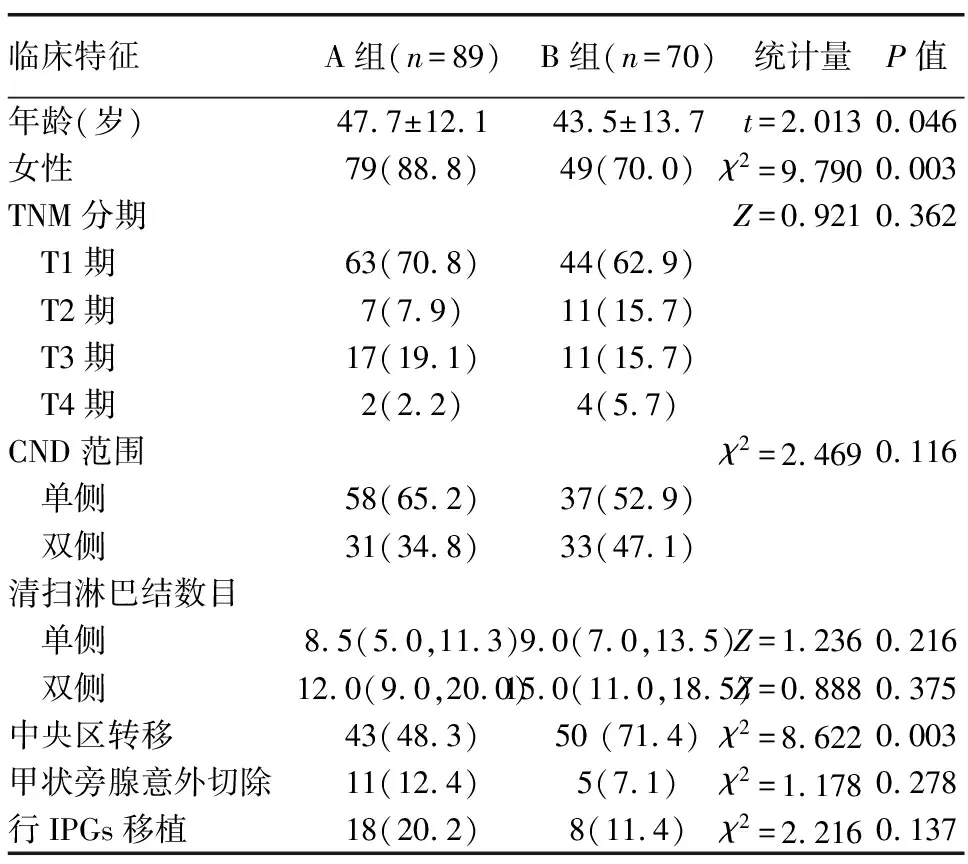
临床特征A组(n=89)B组(n=70)统计量P值年龄(岁)47.7±12.143.5±13.7t=2.0130.046女性79(88.8)49(70.0)χ2=9.7900.003TNM分期Z=0.9210.362 T1期63(70.8)44(62.9) T2期7(7.9)11(15.7) T3期17(19.1)11(15.7) T4期2(2.2)4(5.7)CND范围χ2=2.4690.116 单侧58(65.2)37(52.9) 双侧31(34.8)33(47.1)清扫淋巴结数目 单侧8.5(5.0,11.3)9.0(7.0,13.5)Z=1.2360.216 双侧12.0(9.0,20.0)15.0(11.0,18.5)Z=0.8880.375中央区转移43(48.3)50 (71.4)χ2=8.6220.003甲状旁腺意外切除11(12.4)5(7.1)χ2=1.1780.278行IPGs移植18(20.2)8(11.4)χ2=2.2160.137
2.2 A组和B组低PTH发生率和永久性甲状旁腺功能减退发生率比较 术后第1天,B组低PTH发生率低于A组[7.1%(5/70)vs. 22.5%(20/89),χ2=6.95,P<0.05]。两组共有134例随访超过6个月,A组68例,B组66例,两组永久性甲状旁腺功能减退发生率差异无统计学意义[8.8%(6/68)vs. 1.5%(1/66),P=0.115]。
2.3 A组和B组患者术前、术后PTH和血钙水平比较 两组术前的血PTH和血钙水平差异无统计学意义;B组术后第1天的PTH和血钙水平均高于A组,差异有统计学意义,见表2。
表2 A组和B组患者术前、术后PTH和血钙水平比较

指标A组(n=89)B组(n=70)统计量P值 术前PTH43.40(34.90,58.75)41.50(31.47,57.02)Z=0.9720.331 术后PTH18.80(8.85,28.50)28.85(21.15,40.78)Z=3.3860.001 术前血钙2.31±0.102.32±0.12t=0.5910.556 术后血钙2.00±0.152.05±0.14t=2.1760.031
注:PTH单位为pg/ml;血钙单位为mmol/L
2.4 At组和Bt组患者低PTH发生率和永久性甲状旁腺功能减退发生率比较 术后第1天,At组和Bt组患者低PTH发生率差异无统计学意义[22.2%(4/18)vs. 25%(2/8),P=1.000]。At组和Bt两组永久性甲状旁腺功能减退发生率差异无统计学意义[7.7%(1/13)vs. 0%(0/8),P=1.000]。
2.5 At组和Bt组术前、术后血PTH和血钙水平比较 两组术前、术后的血PTH和血钙水平差异均无统计学意义,见表3。
表3 At组和Bt组术前术后血PTH和血钙水平比较

指标At组(n=18)Bt组(n=8)统计量P值 术前PTH45.00(35.43,58.13)39.15(27.95,43.85)Z=1.0840.279 术后PTH15.40(6.85,24.58)15.85(8.10,18.63)Z=0.4170.677 术前血钙2.32±0.112.34±0.09t=0.3800.708 术后血钙1.95±0.141.96±0.10t=0.0770.939
注:PTH单位为pg/ml;血钙单位为mmol/L
3 讨论
本研究结果显示B组较A组术后第1天的血PTH和血钙水平显著升高,且B组术后低PTH发生率也显著低于A组。提示基于IPGs分型的甲状腺下极区域计划性分离和IPGs策略性保护在中央区清扫过程中有效保护了IPGs的功能。近年来多个研究表明术后低PTH水平与暂时性和永久性甲状旁腺功能减退密切相关[9-11]。笔者既往研究发现术后第1天PTH水平低于8 pg/ml与永久性甲状旁腺功能减退发生关系密切[8]。但是在行IPGs移植的At和Bt组中,尽管大部分患者仅移植1枚IPGs,但两组间各项观察指标均无显著差异。因此可以认为A、B组间观察指标的差异主要是因为新方法对IGPs的有效保护。由于IPGs的分布和血供都比较复杂,目前在CND过程中如何保护IPGs存在争议。有学者主张行IPGs自体移植,认为这样有利于对中央区淋巴结进行彻底清扫,并可以防止永久性甲状旁腺功能减退发生[6]。但也有研究显示移植甲状旁腺不能有效避免永久性甲状旁腺功能减退,反而增加暂时性甲状旁腺功能减退的发生率[12]。笔者认为CND过程中能否实现IPGs术中定位和血运保护是决定能否原位保留IPGs的决定因素,甲状旁腺移植是对误切和血运受损甲状旁腺的补充手段。
上个世纪初,Halsted等[13]即对甲状旁腺血供进行了观察,认为甲状旁腺血供主要来自甲状腺下动脉分支,从解剖学角度提出离断甲状腺下动脉分支应该紧贴甲状腺表面进行,以保护甲状旁腺血供。上世纪70年代,Thompson等[7]详细描述了精细化被膜分离技术,即甲状腺切除应该在甲状腺下动脉和甲状腺之间的间隙进行分离,紧贴甲状腺表面离断甲状腺下动脉的分支,以减少对甲状旁腺及其血供的损伤。CND要清扫气管旁、气管前及喉前淋巴结,甲状旁腺及其血供的显露是彻底清扫和甲状旁腺保护的前提,因此,精细化被膜分离不足以解决CND过程中甲状旁腺保护问题。IPGs主要分布于甲状腺下极背面和下极的下方,手术中对甲状腺下极区域合理、有序分离可以减少手术对IPGs及其血供的损害。“一面一带”概念反映了IPGs与甲状腺和胸腺的相对位置,A、B型IPGs占了IPGs的93%,是甲状腺下极区域计划性分离的解剖学基础,与尸体解剖研究结果相似[14-15]。通过对甲状腺下极区域的计划性分离,实现下动脉主要分支、胸腺及胸腺甲状腺韧带的保留和IPGs定位,针对不同类型IPGs采取不同的策略性保护措施。A2型IPGs的供血下动脉分支比较细且常常紧贴甲状腺下极表面或位于甲状腺表面的沟槽中,甚至位于甲状腺实质内,原位保留比较困难。保留A2型IPGs附着处的少许甲状腺组织和分离后认真再次评估其血供是否完好很有必要。当然,对不能确切保留血供的A2型IPGs,积极进行自体移植是明智之选。A1型和B型甲状旁腺的供血下动脉分支通常较粗大,在下动脉和甲状腺之间的间隙进行分离,可以保护IPGs血供,这一点与精细化被膜分离技术的要求一致。当然,静脉回流对IPGs正常循环也很重要,笔者体会术中根据IPGs部位,因地制宜地保留静脉也是对IPGs保护的重要环节。
甲状腺手术中对甲状旁腺的保护一直是甲状腺外科医师关注的焦点之一。朱精强等[5]根据甲状旁腺和甲状腺间的解剖关系对甲状旁腺进行分型,以评估术中甲状旁腺原位保留的难易程度,结果发现移植IPGs可以防止永久性甲状旁腺功能减退,减少中央区淋巴结的复发。笔者认为IPGs的血供特点是决定其能否原位保留的重要因素,A1和B型IPGs较其他类型IPGs更容易原位保留;且大部分IPGs和中央区淋巴结处于不同解剖层面,CND过程中下动脉主干通常被骨骼化分离,并不影响清扫的彻底性。Cui等[16]根据甲状腺切除后甲状旁腺血供状态对其进行分型,并对不同分型采取相应策略进行保护也取得很好的效果。Wang等[17]提出了“胸腺-下血管-下甲状旁腺平面”的概念,术中保留这个层面有助于保护IPGs的功能,和笔者对B型旁腺的保护方法类似。Park等[18]根据甲状旁腺的血供特点对甲状旁腺进行分类,并采取相应技巧进行保护,大大改善了甲状腺全切术后对甲状旁腺功能的损害,体现了术中保护甲状旁腺血供的重要性。总之,越来越多的证据证明术中常规显露甲状旁腺,并根据旁腺的位置和血供特点采取相应措施,可以更好的保护甲状旁腺的功能。
综上所述,基于IPGs的分型对甲状腺下极区域进行计划性分离,增加术中对IPGs的辨识和血供保留,可以更好的保留IPGs,大大降低术后短期和远期甲状旁腺功能减退的发生率。

