热应激对睾丸钙/钙调蛋白依赖性蛋白激酶Ⅱ表达的影响
吴 震,朱文祥,刘洪茂,穆柯瀚,姬艳丽
近年来,关于高温与男性生殖健康之间的关系日益受到生殖医学领域的普遍关注。一些研究[1]已证实精子的发生、男性不育与阴囊温度有关。课题组前期研究[2-3]也发现热应激处理(43 ℃、15 min)后能够明显引起小鼠睾丸组织病理学损伤,诱导睾丸生殖细胞凋亡,但目前热处理诱导睾丸生殖细胞凋亡的确切机制仍不清楚。
钙/钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)是多种组织类型中广泛分布的多功能丝氨酸/苏氨酸激酶,是细胞内信号传导系统的一个重要构成部分。研究[4]表明,CaMKⅡ在激活状态下与细胞凋亡有着密切联系。现主要研究阴囊短暂、轻度热应激对睾丸CaMKⅡ表达的影响,为进一步探讨CaMKⅡ在急性热应激诱导睾丸损伤中的作用及阐明热应激对男性生殖损伤的机理提供参考依据。
1 材料与方法
1.1 实验动物健康清洁级ICR小鼠(6~8周龄,♂,28~35 g),购自安徽省实验动物中心,小鼠饲养在实验室温度为20~25 ℃、湿度为(50±5)%、昼夜各12 h的动物房内。实验期间,小鼠自由摄食和饮水。实验动物合格证号为SCXK(皖)2011-002。实验研究符合《中华人民共和国实验动物管理条例》中的要求和规定。
1.2 化学试剂RT和PCR试剂盒购自美国Promega公司;聚偏二氟乙烯(PVDF)膜购自美国Millipore公司;化学发光增强检测试剂盒购自美国Pierce公司;β-肌动蛋白(β-actin)抗体购自北京博奥森科技有限公司;磷酸化钙/钙调蛋白依赖性蛋白激酶Ⅱ(phosphor-calcium/calmodulin-dependent protein kinaseⅡ,p-CaMKⅡ)、ERK1/2、p-ERK1/2 抗体购自美国CST公司;其他生化试剂购自美国Sigma公司。
1.3 动物处理按照参考文献[2]的处理方式,对小鼠进行热应激处理。将24只成年ICR雄性小鼠随机分为4组(每组6只,分别为对照组、热应激0.5 h组、热应激2 h组和热应激6 h组)。将热处理组小鼠身体下1/3部位置于43 ℃恒温水浴中15 min,在热处理后0.5、2、6 h后进行剖杀。将对照组小鼠身体下1/3部位置于22 ℃恒温水浴中15 min,于6 h后剖杀取睾丸组织。采用Western blot技术分析各组睾丸p-CaMKⅡ、p-ERK1/2、 ERK1/2、β-actin蛋白表达水平。将对照组、热应激2 h组和热应激6 h组睾丸进行HE染色,采用免疫组织化学方法观察p-CaMKⅡ 蛋白的表达水平。
1.4 睾丸组织切片取对照组、热应激2 h组和热应激6 h组一侧完整包膜未破损的睾丸,置于4%MDF(含有30%甲醛、15%乙醇、5%冰乙酸和50%三蒸水)固定24 h,然后经无水乙醇脱水、二甲苯透明、石蜡包埋、5 μm连续切片、HE染色、光学树脂封片,在光学显微镜下观察睾丸组织病理学变化并拍照。
1.5 TUNEL每组选取睾丸石蜡切片各3张,按照参考文献[3]进行TUNEL及酶标记反应,DAB显色处理后采用苏木素复染,于光镜下观察细胞凋亡情况。
1.6Westernblot按照参考文献[2]进行电泳、转膜,采用5% 脱脂牛奶温封闭后的PVDF膜分别用一抗[β-actin(1 ∶2 000)、p-CaMKⅡ(1 ∶2 000) 、ERK1/2(1 ∶5 000)、p-ERK1/2(1 ∶5 000)]4 ℃孵育过夜,之后用抗小鼠或抗兔IgG(β-actin:1 ∶40 000、p-CaMKⅡ:1 ∶40 000 、ERK1/2:1 ∶40 000、p-ERK1/2:1 ∶40 000)于摇床上室温孵育1.5 h,采用化学发光试剂盒检测各组蛋白的表达。Western blot结果分析:采用tanon4.2凝胶成像系统将目的蛋白的表达水平用内参β-actin标化,将对照组标化后的比值定为1。
1.7 免疫组织化学检测p-CaMKⅡ表达应用免疫组化PV-6000通用二步法检测睾丸中p-CaMKⅡ的表达情况。检测修复抗原、血清封闭后的睾丸病理切片采用一抗p-CaMKⅡ 4 ℃孵育过夜,之后采用相应二抗处理、DAB显色、苏木素复染。在显微镜下观察p-CaMKⅡ的分布及表达情况。
2 结果
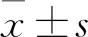
2.1 热应激对睾丸组织病理的影响单次、短暂、轻度阴囊热应激所诱导的睾丸损伤非常显著,热应激处理2 h后小鼠睾丸生殖细胞细胞核固缩,并在热应激处理6 h后病理改变加重,表现为小鼠睾丸生精小管间隙增大,生精小管内细胞排列紊乱,胞浆空泡化显著,发生细胞核固缩的细胞增多(图1B、1C)。阴囊热应激能够明显诱导小鼠睾丸生殖细胞凋亡,其中主要表现为精原细胞和初级精母细胞的凋亡(图2B、2C)。
2.2 热应激对p-CaMKⅡ蛋白表达的影响采用免疫组化PV-6000通用二步法技术分析睾丸p-CaMKⅡ蛋白的表达,结果显示:与对照组相比,热应激后2 h、6 h组睾丸中p-CaMKⅡ(T286)蛋白的表达水平均显著升高。Western blot研究结果表明,热应激处理能够明显增加睾丸CaMKⅡ 蛋白的磷酸化(F=22.21,P<0.05)(图3),与免疫组化结果相一致(图4)。
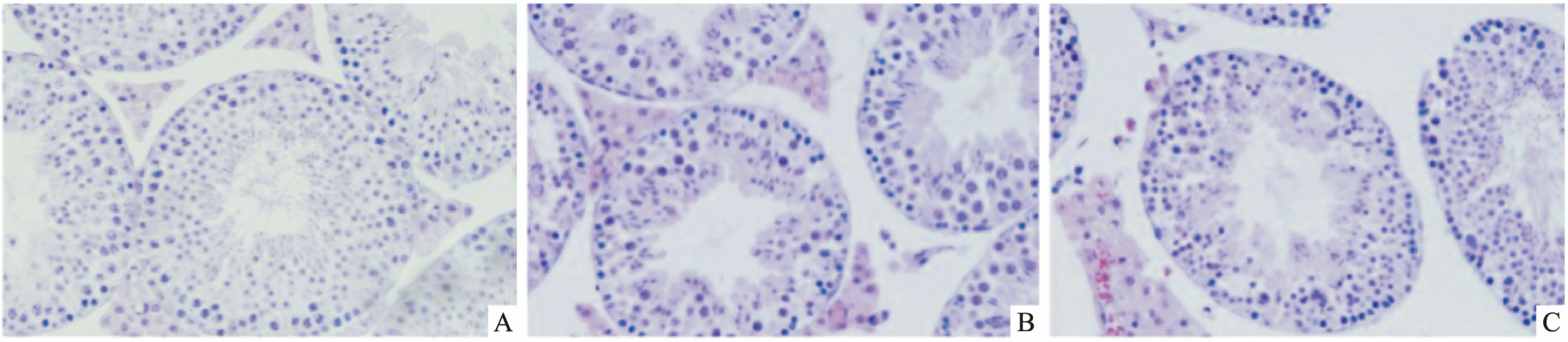
图1 热应激对睾丸病理的影响 HE染色×200A:对照组;B:热应激2 h组;C:热应激6 h组
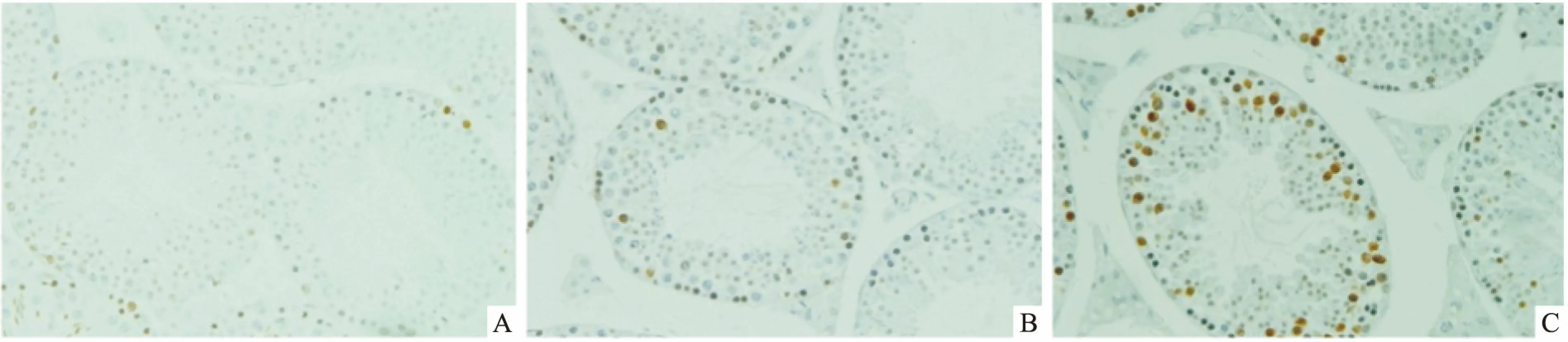
图2 热应激对睾丸生殖细胞凋亡的影响 DAB染色×200A:对照组;B:热应激2 h组;C:热应激6 h组
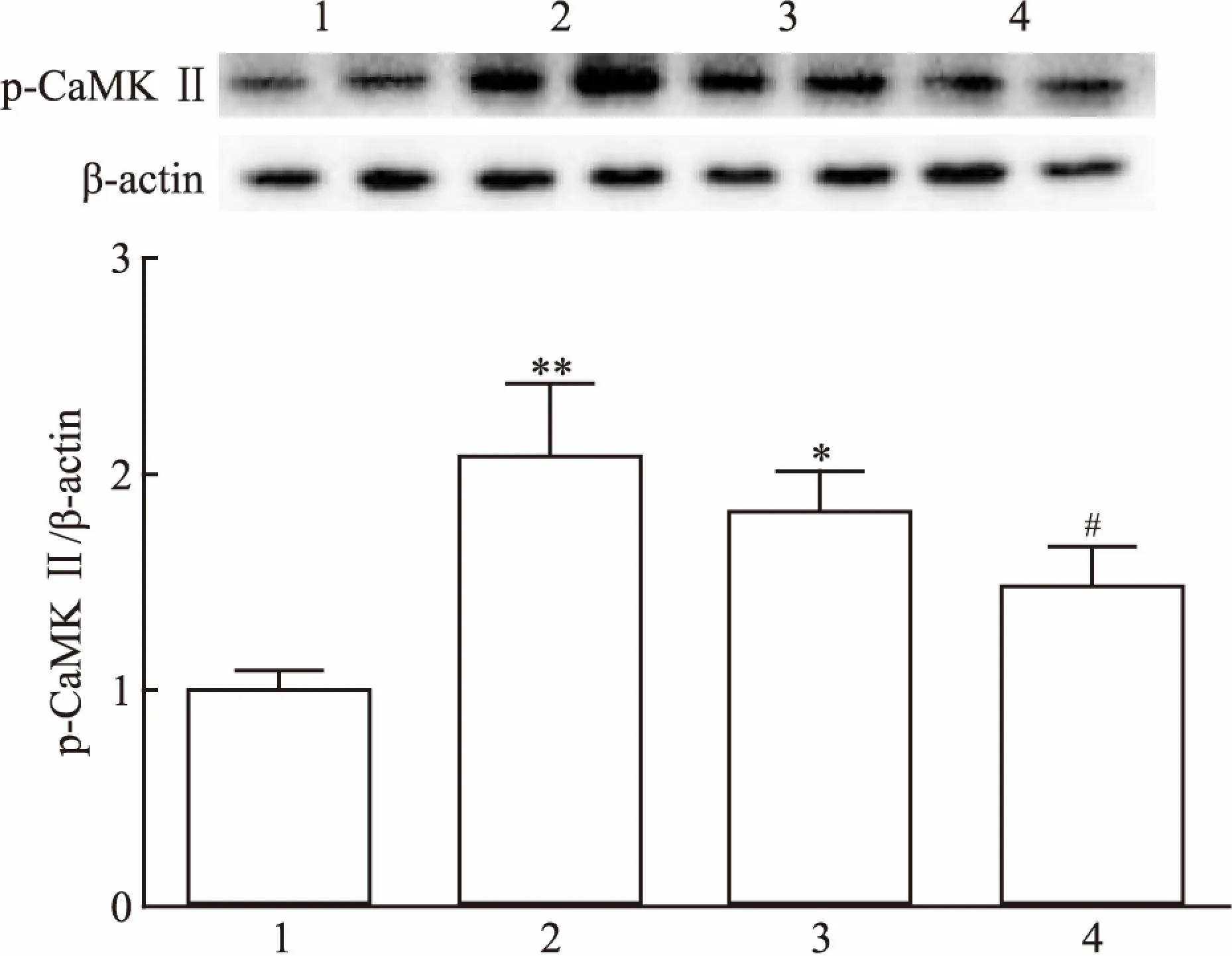
图3 热应激对睾丸p-CaMKⅡ蛋白表达的影响
1:对照组;2:热应激0.5 h组;3:热应激2 h组4:热应激6 h组;与对照组比较:*P<0.05,**P<0.01;与热应激2 h组比较:#P<0.05
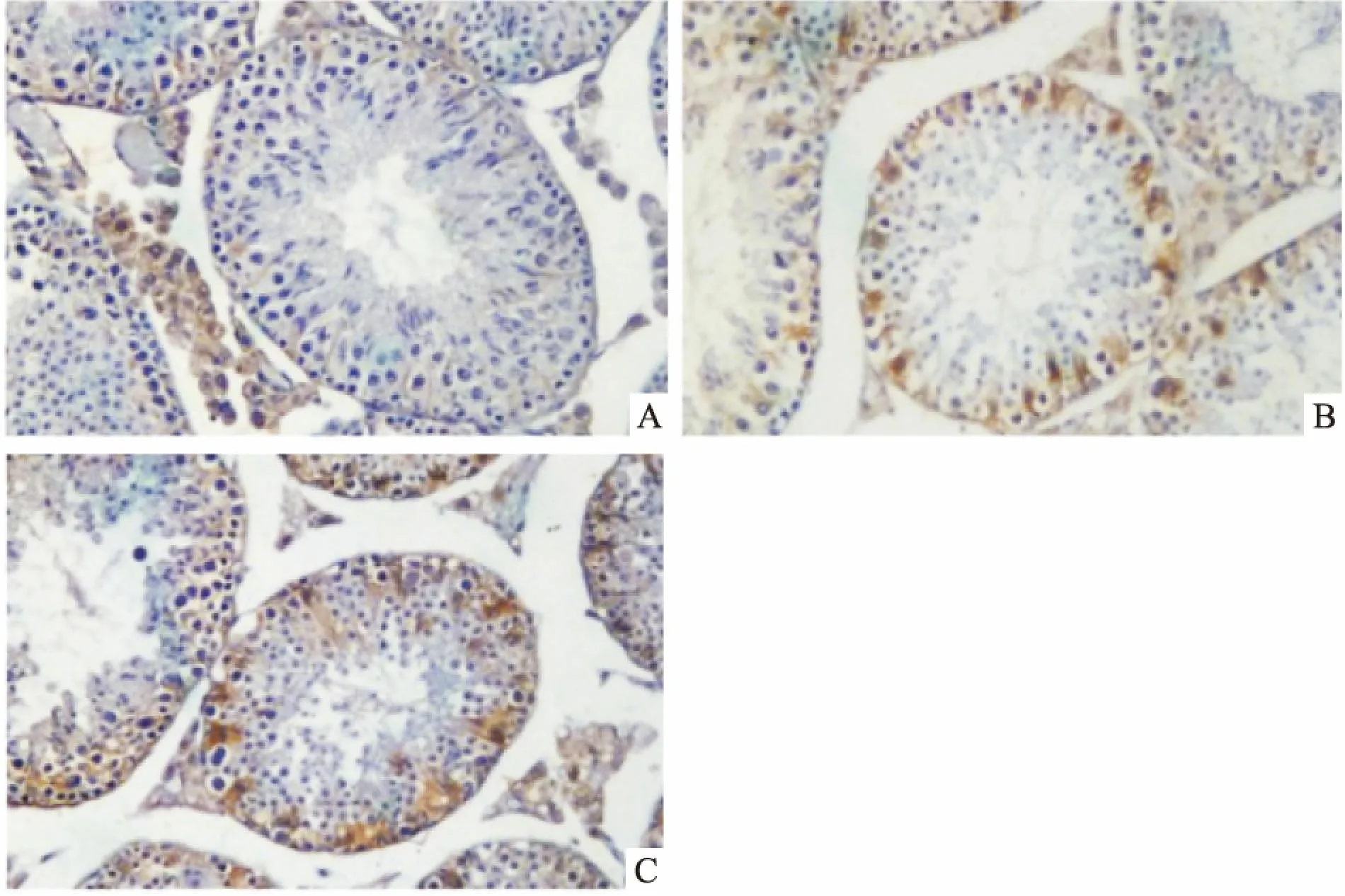
图4 热应激对睾丸p-CaMKⅡ的分布表达的影响PV二步法×100
A:对照组;B:热应激2 h组;C:热应激6 h组
2.3 热应激对p-ERK1/2蛋白表达的影响细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)存在于睾丸支持细胞及各级生精细胞中,对精子发生与成熟具有重要作用。本研究表明,热应激能够激活ERK,表现为热应激组小鼠睾丸组织p-ERK1/2蛋白(Thr202/Tyr204)的表达水平明显高于对照组,差异有统计学意义(F=29.06,P<0.01)(图5)。
3 讨论
睾丸具有高度增殖能力,对温度特别敏感,较高的阴囊温度会损害精子发生。阴囊过热引起的睾丸生殖细胞凋亡是男(雄)性不育的主要原因之一。研究证明,单次热处理能引起睾丸组织发生内质网应激[5-6],热应激主要通过线粒体信号通路诱导睾丸生殖细胞凋亡[7],而CaMKⅡ蛋白在线粒体信号通路引起的细胞凋亡中发挥重要作用。然而,目前关于CaMKⅡ蛋白在热应激诱导的睾丸生殖细胞凋亡中是否发挥作用尚不清楚。
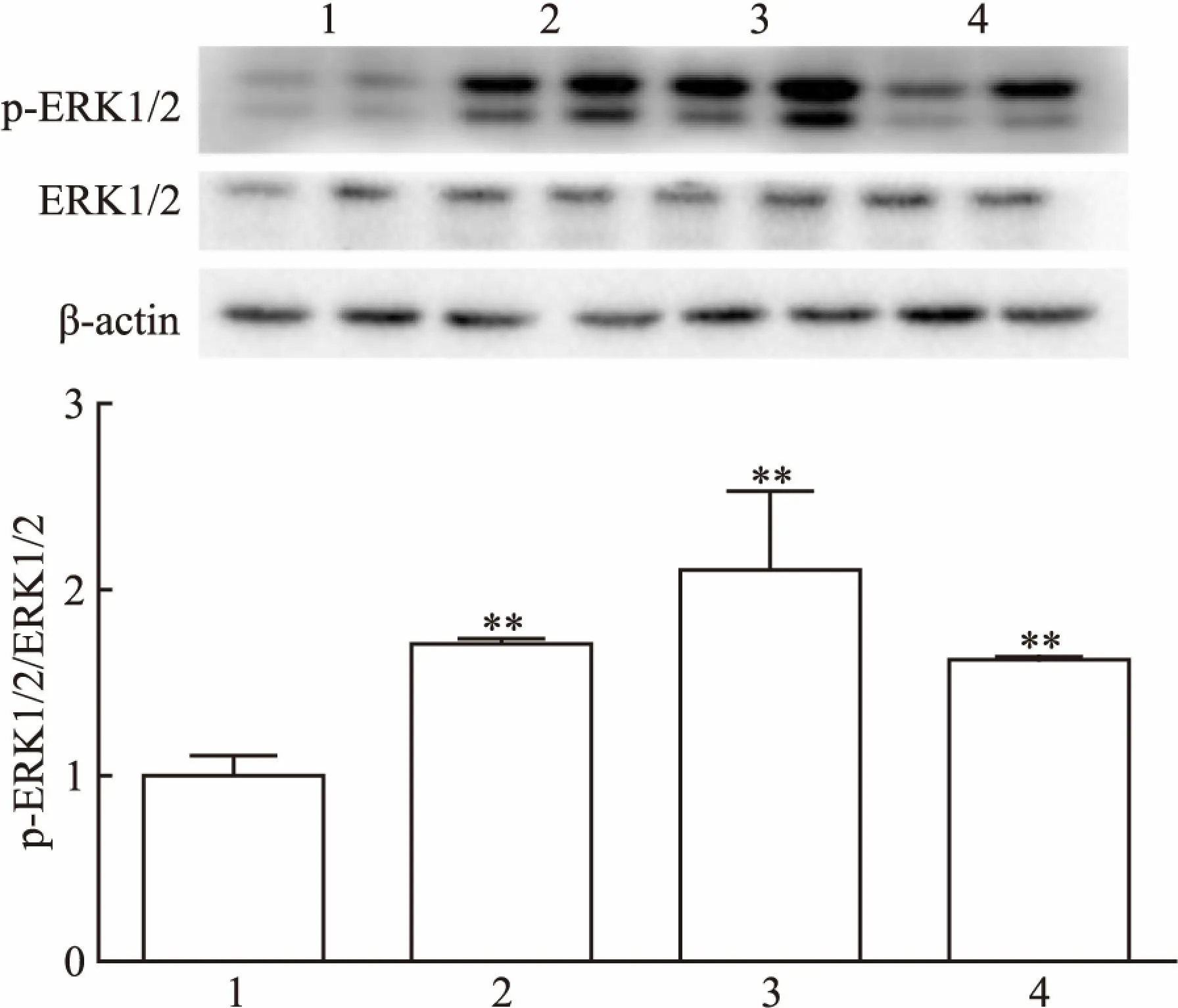
图5 热应激对睾丸p-ERK1/2蛋白表达的影响
1:对照组;2:热应激0.5 h组;3:热应激2 h组4:热应激6 h组;与对照组比较:**P<0.01
CaMKⅡ具有四种亚型(α、β、δ和γ),其中α亚基主要分布在前脑,与记忆功能有关[8],β亚基具有维持突触正常的结构和功能的作用[9],δ亚基主要存在于心脏中,与相关心脏疾病有关[10]。CaMKⅡ在睾丸中主要存在于早期精母细胞的生精小管最外层[11]。在静息条件下,CaMKⅡ保持在非活性状态,在应激状态下,通过影响下游受体进而破坏细胞内钙离子的稳态。一旦激活,CaMKⅡ即使在没有Ca2+/CaM结合的情况下,也可通过苏氨酸287的自磷酸化维持激活状态[12]。
相关文献[13]表明,抑制CaM和CaMKⅡ可降低线粒体信号通路相关凋亡蛋白的表达,提示CaMKⅡ可能通过线粒体通路引起细胞凋亡。此外,有研究[14]表明抑制CaMKⅡ能够缓解内质网应激和氧化损伤,提高线粒体的完整性和膜电位。CaMKⅡ阻断剂KN93、AIP均能够减弱毒胡萝卜素诱导的内质网应激,同时还能够抑制ERS诱导的细胞死亡,提示CaMKⅡ在内质网应激介导的细胞死亡中具有重要作用[15]。本课题研究结果也表明,与对照组相比,热应激处理能显著诱导小鼠睾丸中p-CaMKⅡ蛋白的表达。提示p-CaMKⅡ在轻度热应激引起的小鼠睾丸生殖细胞凋亡中发挥重要作用。对小鼠进行热应激处理后,可通过诱导小鼠睾丸中p-CaMKⅡ蛋白的表达,进而对小鼠睾丸组织造成病理损伤,造成小鼠睾丸生殖细胞凋亡的发生。对于阴囊温度对雄性生殖健康影响的研究具有一定意义。
CaMKⅡ不仅是一个CaM效应器,而且能够感知、整合和传导细胞Ca2+和Ca2+-CaM信号。一些病理状态下如肿瘤转移、神经系统疾病和男性不孕,Ras-ERK信号通路被激活,同样也能够检测到CaMKⅡ的改变,CaMKⅡ的过度表达可增强肌浆网Ca2+的释放,也增强了线粒体Ca2+的摄取,从而导致细胞死亡。本研究也发现热应激能显著诱导小鼠睾丸中p-ERK1/2蛋白的表达,提示CaMKⅡ可能通过CaM-CaMKⅡ和ERK1/2信号通路导致线粒体的功能障碍,并进一步导致生殖细胞凋亡。

