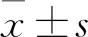
LGR5启动子甲基化在胃癌中的表达
陈晓雨,朱耀东,喻 鑫,刘 弋,于东风
2018年全球范围内新增了100万名胃癌患者,而且胃癌在恶性肿瘤中有着第五的发病率和第三的致死率,高致死率主要是晚期诊断所致[1],为治愈带来了巨大的困难,因此寻找胃癌新的肿瘤标志物及治疗靶点成为了当今的热点问题。富含亮氨酸的重复序列G蛋白偶联受体5(leucine-rich repetitive G protein-coupled receptor 5 , LGR5)是癌症干细胞(cancer stem cell,CSC)肿瘤标志物之一,在胃癌的发生发展中起着重要作用[2],然而LGR5表达调控的潜在机制仍不明确。研究[3]表明胞嘧啶-磷酸-鸟嘌呤(CpG)岛在不同基因启动子区域的高(低)甲基化,可能是多种癌症中肿瘤发生的主要原因。Su et al[3]发现在结直肠癌中LGR5启动子的甲基化控制LGR5的表达影响肿瘤的进展,该研究探讨胃癌中是否存在类似的机制。
1 材料与方法
1.1 病例资料选取安徽医科大学第一附属医院高新院区开诊半年内的胃癌手术病例26份,胃癌确诊依据该院病理科提供的术前术后病理报告。将26份病例纳入随访,随访时间12个月。肿瘤分期采用TNM分期法。纳入患者术前未接受新辅助放化疗,也没有合并其他恶性肿瘤。经安徽医科大学第一附属医院伦理委员会批准,受试者知情同意并签署知情同意书。
1.2 材料和试剂新鲜胃癌组织、癌旁组织、正常组织;EZ DNA甲基化金试剂盒(美国加利福利亚ZYMO公司);TIANGEN凝胶萃取装备(北京TIANGEN公司);10×反应缓冲液及HotStartTaq聚合酶(大连TaKaRa公司)。
1.3 方法
1.3.1提取基因组DNA 采用标准苯酚-氯仿萃取法,从胃癌、癌旁、正常组织中提取基因组DNA。
1.3.2亚硫酸盐修饰 利用EZ DNA甲基化试剂盒对提取后的基因组DNA进行亚硫酸氢盐修饰,将基因组DNA未被甲基化修饰的胞嘧啶(C)转化为尿嘧啶(U)。
1.3.3样本目标片段多重PCR反应 以亚硫酸氢盐处理过的DNA为模板,使用优化后的多重聚合酶链式反应(PCR)引物,以处理后的样品基因组为模板,进行多重PCR扩增。经质控后,将以同一个样品基因组DNA为模板的所有多重PCR引物的扩增产物混合,并确保每个位点引物扩增产物的量相当。引物序列(5’-3’)F:GGTTTTYGGAGTAGTTTTGGTTGT,R:ATAAAACCRAACRAAAAATACCTAAAAA。
1.3.4样本添加特异性标签序列 利用带有Index序列的引物,通过PCR扩增向文库末端引入和Illumina平台兼容的特异性标签序列。反应采用11个循环数的PCR程序,尽可能降低PCR的倾向性。
1.3.5定量后上机测序 将所有样品Index PCR扩增产物等量混合,并经割胶回收获得最终的Methyl Target测序文库,文库的片段长度分布经Agilent 2100 生物分析仪验证。文库摩尔浓度精确定量后,最终于IlluminaHiseq平台,以2×150 bp的双端测序模式进行高通量测序,获得数据。
2 结果
2.1 一般情况本次研究中共纳入26份胃癌病例,其中男女比为9:4,肿瘤位于贲门胃底胃体部与幽门部的病例数基本相等,III~IV期患者占38.46%,分化好的胃癌仅占30.77%,癌胚抗原(CEA)阳性的患者也仅占26.92%,其中19.23%的患者1年内发现肿瘤的复发。见表1。
2.2 LGR5在胃癌标本不同位置的甲基化测定并计算胃癌组织、癌旁组织、正常组织扩增子中不同位点LGR5启动子CpG位点的甲基化水平(甲基化水平=该位点甲基化的reads数目/该位点总的reads数目),结果每组胃癌组织中每个LGR5测量位点甲基化水平明显降低,其中1例见图1,测定位点数为15。另外以扩增子为单位,分析胃癌组织、癌旁组织、正常组织中LGR5启动子CpG位点的单倍型,结果亦得出每组胃癌组织中LGR5甲基化水平明显降低。见图2。注:单倍型类型,假设扩增子序列(5’-3’)为:ATCATXGATCXGCTAXGCTTTAXG CCTAT,X可为c(甲基化修饰)或t(未甲基化修饰),其中一条测序的read为:ATCATCGATCTGCTACGCTTTATGCCTAT,则该read对应的扩增子甲基化单倍型为:CTCT。
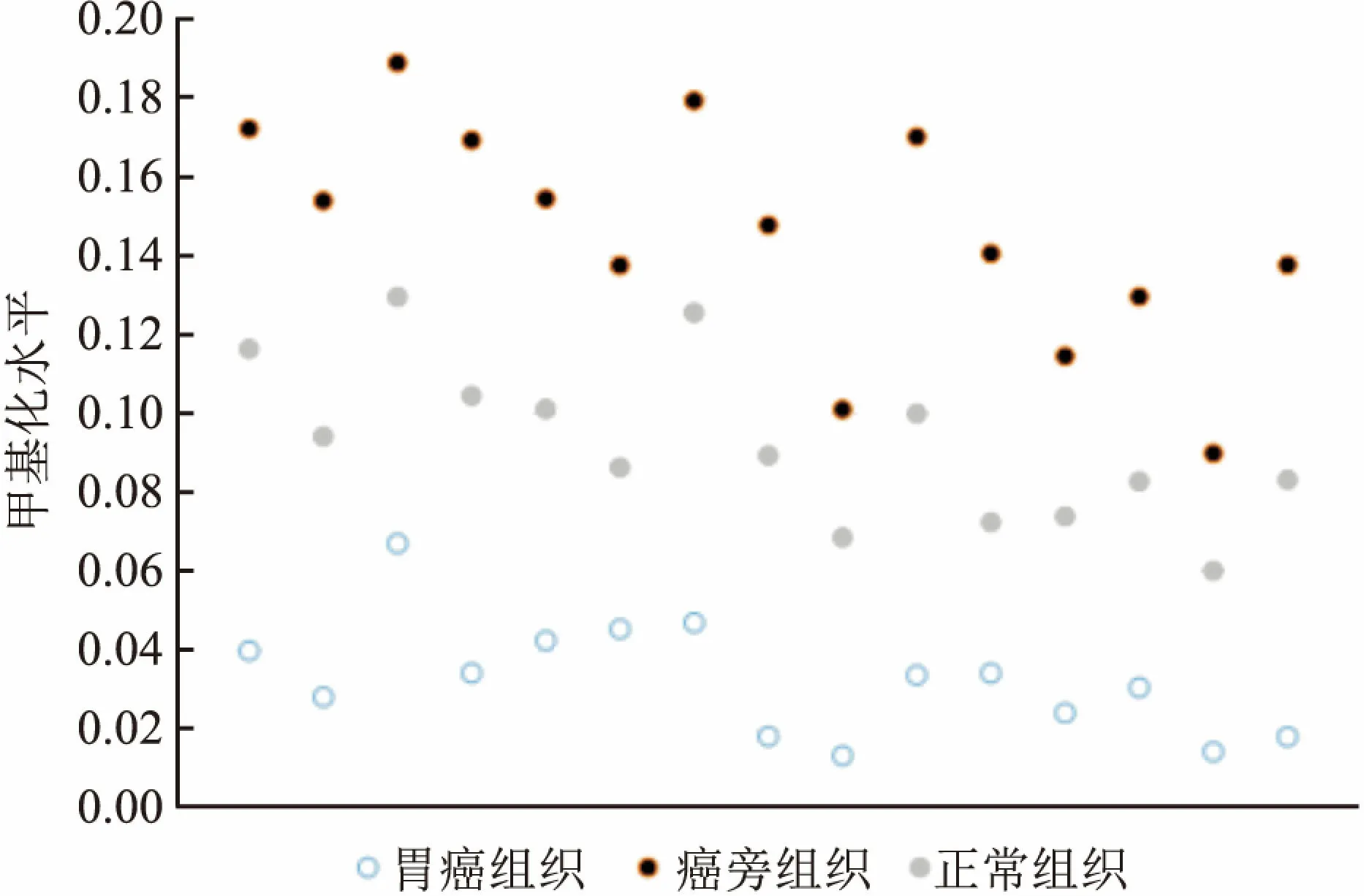
图1 LGR5在不同组织中的甲基化水平
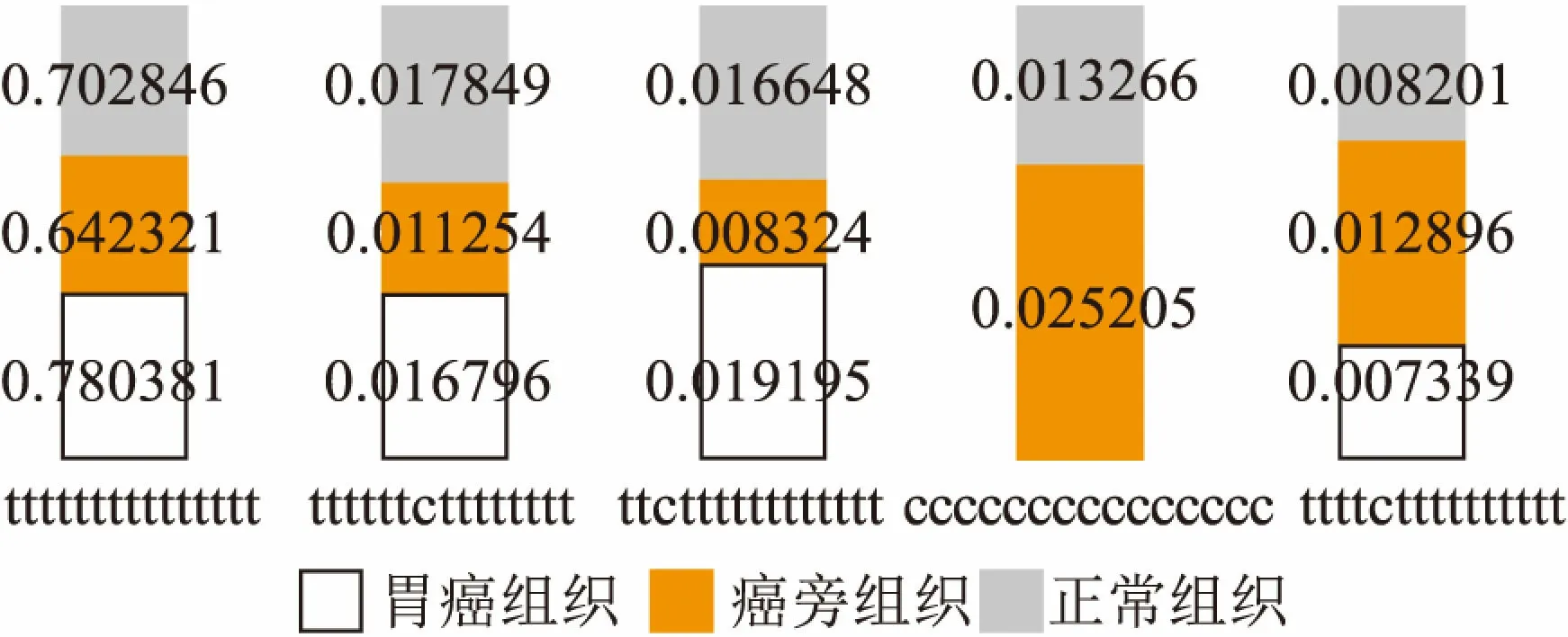
图2 不同组织中LGR5启动子CpG位点的单倍型
2.3 LGR5甲基化与胃癌临床病理参数关系测定胃癌组织的LGR5启动子区域CpG岛甲基化水平,LGR5的甲基化水平较高预示着病理分期早、浸润深度浅、肿瘤小、无淋巴转移、1年内复发率低,见表1。
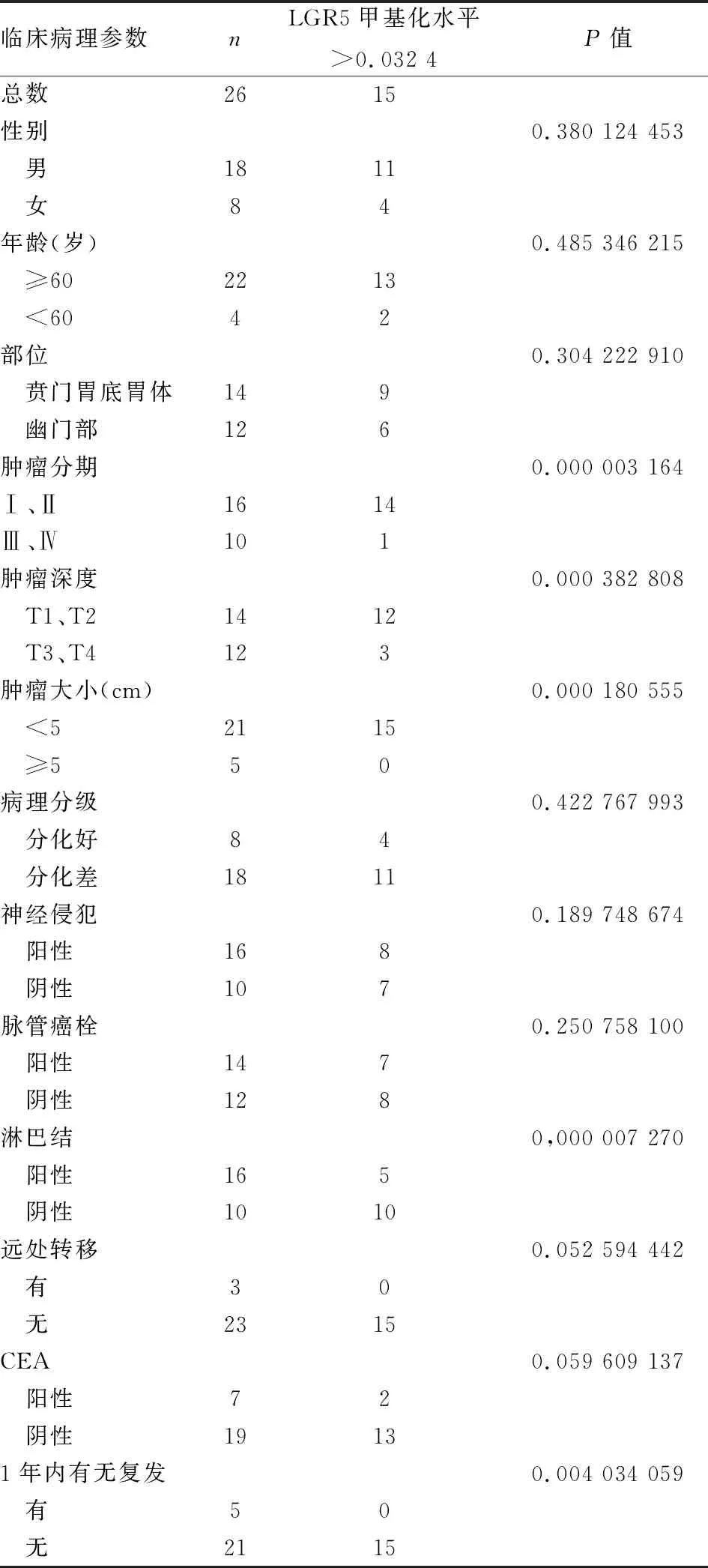
表1 LGR5甲基化与胃癌临床病理参数关系
3 讨论
癌症起源于多种遗传和表观遗传学变化的累积,受影响器官中的干细胞最有可能是癌症的起源细胞,因为它们能够自我更新并在多细胞分裂后长时间存活[4]。 CSC是一部分起源于未调控的干细胞或去分化的祖细胞并具有自我更新能力的细胞,同时拥有干细胞和上皮间充质转换特征[5]。一系列的证据表明CSC负责肿瘤的发生、发展、维持、侵袭、转移、再生、耐药[3],对于胃癌干细胞现已证实的标记物有分化抗体群(cluster of differentiation,CD)44、CD24、CD133、LGR5、结合转录因子4、上皮细胞粘附分子、乙醛脱氢酶1等[2]。
先前有研究[6-7]表明,LGR5在胃癌中表达增高,并与TNM分期与淋巴转移相关,可作为胃癌侵袭、预后、抗幽门螺杆菌治疗疗效评估的指标。LGR5+细胞是胃癌的起源细胞,胃主细胞表达LGR5,并定植在腺体基底部,可作为上皮损伤后的储备干细胞[4]。LGR5可激活WNT/β-连环蛋白通路,β-连环蛋白在细胞核中积累,调控多种靶基因的表达,影响胃癌的发生发展[8]。目前针对结直肠癌以及卵巢上皮癌的研究得出LGR5启动子CpG岛甲基化程度与肿瘤的发生、相关病理参数、良好的预后负相关[4,9]。在此,该文探究LGR5启动子CpG岛甲基化水平在胃癌中是否有相似的关系。
目前测定DNA甲基化仍多通过传统方法,如甲基化特异PCR和亚硫酸氢盐测序法的方法实现,通量小,且无法准确计算位点/区域的甲基化水平。该研究利用多重PCR和Methyl Target技术,实现对多个特定CpG岛同时捕获测序,并凭借高深度测序数据,能够准确计算每个CpG位点的甲基化水平,准确性高,灵活性强。通过对26组标本进行测序并与相关临床资料进行统计分析,得出LGR5的甲基化水平与胃癌病理分期、浸润深度、肿瘤大小、淋巴转移、1年内复发呈负相关。以此推断LGR5启动子区域CpG岛甲基化水平下降导致LGR5表达增强,下调了CSC的分化、促进了胃癌的生长、转移、再生。与以往关于LGR5在胃癌CSC表达的研究结果[7,10-11]基本一致。既往研究[10]表明分化较差、弥漫性、肠型及有远处转移的胃癌组织中LGR5表达较高,与该研究的结果不相符,可能是纳入样本量较少,造成了偏倚。并且在临床中有部分IV期患者放弃手术治疗,也可能导致了误差。另外,临床上认为CEA对于胃癌的诊断并没有特异性,仅作为判断预后和治疗效果的参考指标,而该研究结果亦显示LGR5启动子区域CpG岛甲基化水平与患者血清CEA水平并没有表现出相关性。
上文提到LGR5与WNT/β-连环蛋白通路密切相关,在胃癌中WNT信号通路的活动水平增强[7],结合该研究结果,可能是LGR5启动子甲基化水平降低所致。LGR5的表达与胃癌血管形成正相关,与表达在小鼠胚胎的肿瘤坏死因子受体超家族成员负相关,与“叉头”蛋白O1负相关,与“刺猬”基因/锌子转录因子2信号通路负相关,与锌指蛋白3负相关,与哺乳动物雷帕霉素靶蛋白正相关,与R-脊椎蛋白正相关,与双肾上腺皮质激素样激酶1正相关,与重组人Nanog同源框假基因8正相关,与Notch信号通路正相关[5,7,9-12]。但这些因子或信号通路与LGR5甲基化的关系还未阐明,具有较好的研究前景。然而,DNA甲基化并不是调节CSC的唯一分子机制,组蛋白修饰、mircoRNA、染色质重塑等也可能在癌变中发挥作用[3]。
抗LGR5抗体缀合物及一些中药如胃痞消与胃癌组织中LGR5的表达存在一定的相关性[13-14]。需要进一步研究这些药物及新的药物与LGR5甲基化的关系,为临床药物治疗及新药上市提供依据。
综上,胃癌是我国最常见的消化道恶性肿瘤之一,该研究用定量的方法计算出LGR5在胃癌组织中的甲基化水平明显降低,而且LGR5的甲基化水平与胃癌病理分期、浸润深度、肿瘤大小、淋巴转移、1年内复发相关。但是本次结果需要更大的样本量进一步证实,而且与WNT/β-连环蛋白通路及其它相关因子的关系还有待探究,以此为胃癌的治疗提供依据及新的方向。

