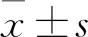
鼠源pEGFP-C1-TMEM88真核表达质粒的构建及其功能研究
李良云,潘林鑫,杨俊发,胡 爽,张 濛,李 俊,徐 涛
跨膜蛋白88(transmembrane protein 88,TMEM88)发现于非洲爪蟾蜍胚胎细胞的细胞膜上,是一种潜在的2型跨膜型蛋白,在人类干细胞的蛋白质分化和胚胎发育中起关键作用。研究[1]表明,非小细胞肺癌组织和多种上皮恶性肿瘤中均有TMEM88高表达现象,并且主要定位于大多数癌症组织的细胞质和肺癌细胞株中。而炎症在癌症的发展和进展中具有重要的作用,在调节免疫细胞在肿瘤微环境的进出中扮演关键角色,在抗肿瘤免疫中扮演重要角色。肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白细胞介素6 (interleukin-6,IL-6)作为研究炎症的代表性细胞因子,可以提高免疫功能,增强抗肿瘤免疫力[2]。课题组前期研究[3]表明在肝脏炎症纤维化的模型中,TMEM88可以改善在Ⅰ型胶原1 和α-平滑肌肌动蛋白水平上转化生长因子-β1诱导的肝星状细胞的活化和增殖[3]。为进一步研究TMEM88对炎症因子分泌的影响,课题组将通过构建TMEM88的真核质粒,研究其在RAW264.7细胞中炎症因子(TNF-α、IL-6)的表达及其对细胞增殖和凋亡的影响。
1 材料与方法
1.1 材料实验材料 RAW264.7细胞株(中国科学院上海生命科学院);ELISA(TNF-α、IL-6)试剂盒(武汉基因美公司);Annexin V-FITC细胞凋亡检测试剂盒(上海贝博生物公司);TMEM88抗体(美国SANTA CRUZ 公司);ECL化学发光试剂盒(美国Thermo scientific公司);细胞培养瓶、细胞培养板 (美国Corning Costar公司);TRIzol Reagent RNA 提取试剂(美国Invitrogen公司); PVDF膜(北京索莱宝科技有限公司);脱脂牛奶(上海光明公司);DMEM培养基;胎牛血清(美国Gibco公司); Hind III、Kpn I内切酶、DL2000 DNA Marker、Lambda DNA Marker、T4连接酶、质粒抽提试剂盒(美国Axygen公司)。
1.2 方法
1.2.1构建质粒 在小鼠正常肝细胞株(alpha mouse liver 12,AML-12)中提取RNA,逆转录后的cDNA于-20 ℃ 保存。使用前,将引物(上海生工公司设计)取出适量稀释到10 μmol/L,其余作为储备液。采用常规PCR扩增技术,反应体系:5×PrimeSTAR Buffer、dNTP Mix(2.5 mmol/L)、上下游引物(10 μmol/L)、DNA、PrimeSTAR、高纯水。取出5 μl PCR产物进行12%的琼脂糖凝胶电泳,纯化回收,并用Hind III、Kpn I双酶切PCR产物和pEGFP-C1载体(分别置于紫外分析仪下观察结果,使用AxyPrep DNA 凝胶回收试剂盒进行PCR产物TMEM88于0.5 ml的离心管中混匀,37 ℃水浴4~6 h)。先对酶切回收的载体进行克隆碱性磷酸酶处理,再进行粘性末端连接,然后进行连接产物的转化、挑菌、摇菌、质粒小抽,酶切鉴定后,送至上海生工公司鉴定测序。
1.2.2转染pEGFP-C1-TMEM88质粒 6孔板中培养RAW264.7细胞,待长至60%时,弃去培养基,PBS清洗3次。在1.5 ml EP管中,A液:200 μl的Opti-MEM加pEGFP-C1-TMEM88真核表达质粒1 μg;B液:200 μl的 Opti-MEM加LipofectamineTM2000脂质体4 μl,将AB液混匀静置20 min后加入细胞中,再用Opti-MEM补至2 ml。转染6 h后,更换含血清培养基继续培养48 h后提取蛋白。
1.2.3Western blot实验 弃去6孔板中的培养基,PBS清洗3遍,每孔用蛋白裂解液(RIPA裂解液:PMSF为100 ∶1)200 μl于冰上裂解细胞30 min,提取蛋白。利用Thermo NanoDrop 2000分光光度计检测蛋白浓度。SDS-PAGE电泳,在恒流200 mA条件下湿转60 min,5%牛奶中封闭3 h,孵育一抗β-actin、TMEM88过夜,室温孵育二抗1 h,显影试剂盒ECL 中A液与B液1 ∶1混合后,即可显影拍照。
1.2.4MTT测细胞增殖 将RAW264.7细胞以每孔5 000的数量接种至96孔培养板中,待细胞长至70 %时开始转染。每孔转染约70 ng pEGFP-C1-TMEM88质粒,6 h后更换培养基。再培养48 h后每孔加入20 μl MTT,4 h后,用5 ml注射器弃去培养基,每孔加入150 μl DMSO,充分裂解10 min后,测定吸光度,计算细胞存活率。
1.2.5流式细胞术检测细胞凋亡 将RAW264.7细胞接种至6孔板中,分别转染对照组空载体和pEGFP-C1-TMEM88质粒。48 h后收集细胞上清液,PBS清洗3次,胰酶消化细胞并收集于15 ml离心管中。每组用400 μl Binding Buffer重悬细胞,并加入5 μl Annexin V染液,避光孵育15 min,然后加入10 μl PI,避光孵育5 min,流式仪器检测细胞凋亡率,观察并记录。
1.2.6ELISA 检测炎症因子 将RAW264.7细胞接种至6孔板中,分别转染对照组空载体和pEGFP-C1-TMEM88质粒。每孔转染1 μg的pEGFP-C1-TMEM88质粒,6 h后换成含血清的培养基,48 h后收集细胞上清。用ELISA试剂盒检测细胞上清液中炎症细胞因子IL-6、TNF-α的表达。
1.2.7实验分组 正常组(N组):不经任何处理的正常细胞分组;对照组(Control组):转染空载体pEGFP-C1的对照组;TMEM88组:转染pEGFP-C1-TMEM88质粒的过表达组。
2 结果
2.1 pEGFP-C1-TMEM88真核表达质粒构建成功在小鼠肝细胞AML-12中提取RNA,逆转录后PCR扩增TMEM88的编码序列(coding sequence,CDS),利用Hind III、Kpn I双酶切扩增产物和pEGFP-C1载体,并用T4 DNA连接酶连接两产物。将其转化到感受态大肠杆菌TG1,用抽提试剂盒提取质粒。酶切鉴定(Hind III、Kpn I双酶切)结果显示,重组质粒酶切后得到两条亮带,一条大小约4 700 bp,大小与pEGFP-C1的酶切产物基本一致,另一条大小约480 bp,大小与TMEM88的PCR产物基本一致,表明pEGFP-C1-TMEM88质粒连接成功,将阳性克隆送至上海生工公司鉴定测序,pEGFP-C1-TMEM88质粒成功构建,见图1。

图1 重组质粒 pEGFP-C1-TMEM88 的酶切鉴定
M1:DL2000 DNA Marker; M2:Lambda DNA Marker;1:TMEM88的PCR产物;2:pEGFP-C1-TMEM88的酶切鉴定;3:pEGFP-C1的酶切鉴定
2.2 pEGFP-C1-TMEM88真核表达质粒的表达将pEGFP-C1-TMEM88表达质粒转染至RAW264.7细胞中,利用Western blot检测其蛋白表达情况。结果显示,过表达质粒组的TMEM88的蛋白表达量明显高于Control组(F=134.64,P<0.01);当用TMEM88抗体免疫印迹时,过表达TMEM88组分别在约17 ku(内源性TMEM88)和44 ku(GFP-TMEM88过表达,即27 ku + 17 ku)显现蛋白印迹,而Control组仅在约17 ku(内源性TMEM88)的显现蛋白印迹,表明pEGFP-C1-TMEM88能够成功表达,见图2。

图2 重组质粒pEGFP-C1-TMEM88的蛋白表达
A:Western blot检测重组质粒pEGFP-C1-TMEM88的蛋白表达;B:TMEM88蛋白表达图;与Control组比较:**P<0.01
2.3 TMEM88对RAW264.7细胞增殖的影响MTT检测将pEGFP-C1-TMEM88表达质粒转染至RAW264.7细胞后的细胞增殖情况。结果显示48 h后N组和Control组的细胞增殖率分别为(0.95±0.05)和(0.94±0.06),过表达TMEM88组的细胞增殖率为(0.71±0.04),显著低于N组和Control组(F=21.55,P<0.01),见图3。
2.4 TMEM88对RAW264.7细胞凋亡的影响将生长对数期的RAW.264.7细胞中转染pEGFP-C1-TMEM88质粒,48 h后用凋亡试剂盒在流式仪上检测细胞凋亡率。结果显示,N组的细胞凋亡率为(6.72±0.92)%,Control组的细胞凋亡率为(7.78±1.67)%,过表达TMEM88组的细胞凋亡率为(11.52±1.43)%,显著高于Control组 (F=10.07,P<0.05),结果显示,过表达TMEM88后,能够促进RAW.264.7细胞的凋亡,见图4A、4B。
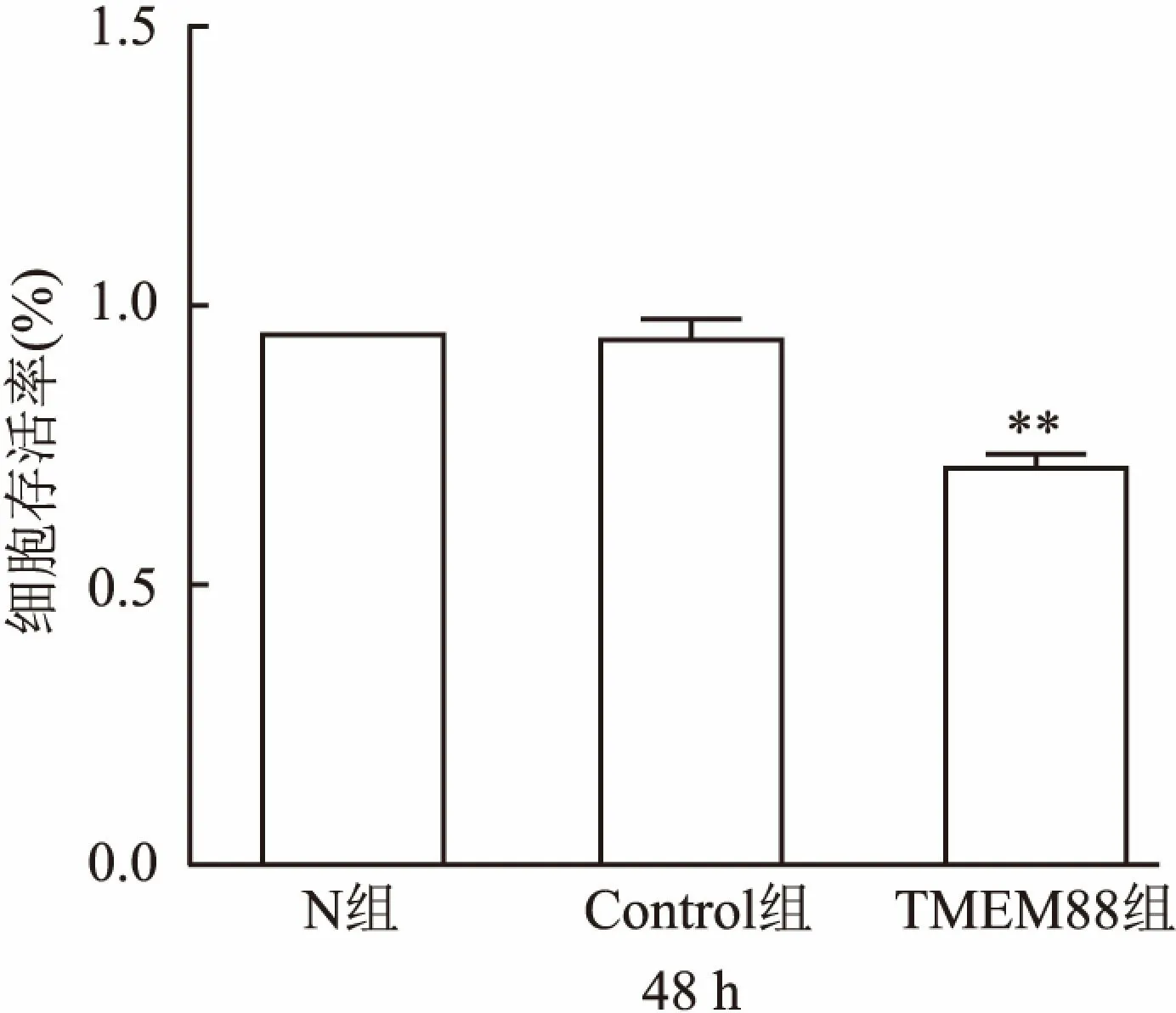
图3 重组质粒pEGFP-C1-TMEM88对RAW264.7细胞增殖影响
与Control组比较:**P<0.01
2.5 TMEM88在RAW264.7细胞中对炎症因子分泌的影响在RAW264.7细胞中转染pEGFP-C1-TMEM88质粒,ELISA检测细胞上清液中IL-6、TNF-α炎症因子的表达。转染后的过表达组中的IL-6表达较Control组升高 (F=18.78,P<0.05);TNF-α的表达较Control 组升高 (F=22.77,P<0.05),表明在RAW264.7细胞中,TMEM88促进炎症因子IL-6、TNF-α的表达。见图5。
3 讨论
TMEM88是一种定位在17号染色体,分子量约为17 ku的双跨膜蛋白,其CDS序列长度为477 bp,由159个氨基酸残基组成的编码[4-5]。通过抑制Wnt/β-连环蛋白经典通路[6],抑制细胞增殖,促进细胞凋亡,从而抑制肿瘤的形成等[7]。而肿瘤又与炎症密切相关[2],所以课题组探究在RAW264.7细胞中,TMEM88对炎症因子IL-6、TNF-α表达及其对细胞增殖凋亡的影响。RAW264.7细胞是研究病原菌感染吞噬、自噬、黏附后递呈抗原的常用细胞株[8],具有很强的黏附和吞噬抗原的能力,其中主要研究的炎症细胞因子有IL-6、TNF-α[9]。TNF-α可由单核巨噬细胞、中性粒细胞、脂肪组织、肝细胞、Kupffer细胞等多种组织和细胞分泌。体内IL-6可由免疫细胞、内皮细胞、脂肪细胞、肝细胞分泌[10]。综上,IL-6和TNF-α与炎症的发生发展有关。大量实验表明抑制这些炎症因子的分泌有助于炎症的治疗[11]。
课题组前期构建了人源pEGFP-C2-TMEM88真核表达质粒,研究了其对肝癌细胞增殖和凋亡的影响,并已发表[7]。在此基础上为了深入了解TMEM88的功能,该研究构建了鼠源pEGFP-C1-TMEM88的真核表达质粒,质粒构建酶切图和Western blot结果显示质粒成功构建和表达,接下来研究TMEM88对细胞增殖的影响。MTT结果显示48 h后, N组的细胞增殖率为(0.95±0.05);Control 组的细胞增殖率为(0.94±0.06);过表达TMEM88组的细胞增殖率为(0.71±0.04),显著低于N组(F=21.55,P<0.01)。结果表明,过表达TMEM88能够明显抑制RAW264.7细胞的增殖。细胞凋亡检测结果显示:N组的细胞凋亡率为(6.72±0.92)%,Control组的细胞凋亡率为(7.78±1.67)%,过表达TMEM88组的细胞凋亡率 (11.52±1.43) %,显著高于Control组(F=10.07,P<0.05),过表达pEGFP-C1-TMEM88后的细胞凋亡率显著高于N组。表明过表达TMEM88能够显著促进RAW.264.7的凋亡。ELISA结果显示:过表达TMEM88后,IL-6、TNF-α的表达升高。表明TMEM88促进炎症因子IL-6和TNF-α的表达。据文献[12]显示,TNF-α和IL-6有明显的肝脏毒性,可引起肝细胞坏死,造成肝功能损伤。因为IL-6和TNF-α二者均能激活T淋巴细胞、B淋巴细胞,单核巨噬细胞和自然杀伤细胞与肝细胞膜受体发生免疫应答反应,造成肝细胞坏死。因此研究IL-6和TNF-α的表达对今后研究TMEM88在肝脏上炎症的表达奠定了基础。该研究结果表明TMEM88在RAW264.7细胞的增殖和凋亡中起关键作用,抑制细胞的增殖并促进细胞的凋亡,且对炎症具有一定的促进作用。这为今后炎症的治疗打下了坚实的基础,课题组将继续深入探讨TMEM88与炎症的关系及机制。
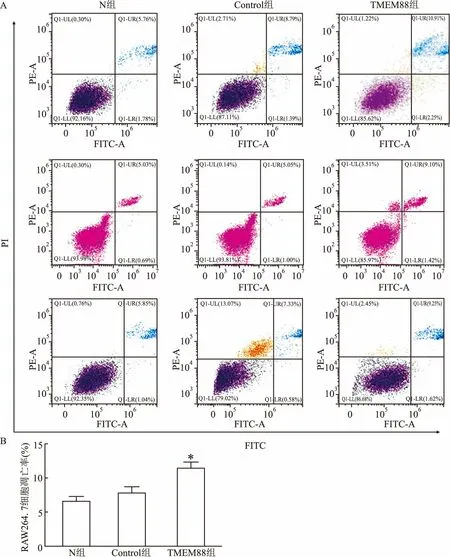
图4 重组质粒pEGFP-C1-TMEM88对RAW264.7细胞凋亡的影响 A:过表达TMEM88流式细胞术检测结果;B:细胞凋亡率柱状图;与Control组比较:*P<0.05
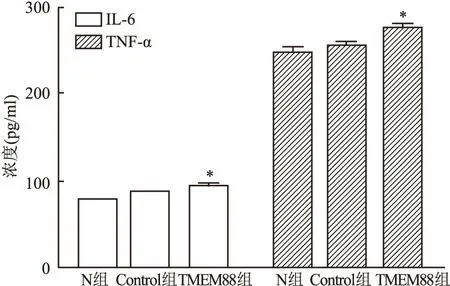
图5 重组质粒pEGFP-C1-TMEM88转染后 ELISA检测炎症因子IL-6和TNF-α的表达 与Control组比较:*P<0.05

