TIMP1基因对肺炎链球菌诱导的肺泡上皮细胞HEPApiC凋亡的影响及机制研究
常大芸 刘学工 李宁华 王晓丽 戴蕾莲 王晓辉 王义涛
肺炎是指由微生物(细菌,病毒或真菌)、物理和化学因素、免疫损伤、过敏或药物等引起的下呼吸道、肺泡和肺间质的炎症。细菌性肺炎是最常见的肺炎形式之一,也是最常见的传染病之一[1]。许多类型的细菌可能引起细菌性肺炎,包括肺炎链球菌、肺炎克雷伯菌、流感嗜血杆菌和铜绿假单胞菌等。肺炎链球菌是引起肺炎的最常见原因,而这种病理在5岁以下及65岁以上的患者中更为严重。在婴儿和老年人中,细菌性肺炎仍然是致命的肺病[2-3]。因此,更好地了解肺炎的发病机制可能有助于制定有效的治疗策略。基质金属蛋白酶抑制剂1(tissue inhibitor of metalloproteinase 1,TIMP1)基因属于TIMPs家族成员之一,其主要功能是抑制基质金属蛋白酶的活性,促进细胞外基质的沉积,并抑制其降解[4]。近年来研究发现,TIMP1在呼吸系统炎症性疾病中发挥重要作用。如王爱华等[5]人报道,在支气管哮喘小鼠组织中TIMP-1异常表达;余霓雯等[6]研究指出,TIMP-1参与慢性阻塞性肺疾病(简称慢阻肺)的进展;但TIMP-1在肺炎中的研究相对较少。近期研究发现[7],TIMP-1在婴幼儿重症肺炎外周血血清中呈高表达,提示TIMP-1的表达量可能作为判断肺炎的预后指标。然而,关于TIMP-1在细菌性肺炎中的作用机制尚不十分清楚。因此本实验以肺炎链球菌干预肺泡上皮细胞HEPApiC模拟细菌性肺炎体外模型,探究TIMP-1基因对肺炎链球菌诱导的HEPApiC细胞凋亡的影响及机制,以期为细菌性肺炎治疗提供新的思路。
资料与方法
一、材料
人肺泡上皮细胞HEPApiC、肺炎链球菌R6(美国ATCC细胞库);胎牛血清、DMEM培养基(美国Gibco公司);胰蛋白酶(杭州四季青生物工程材料有限公司);Trizol试剂、脂质体Lipofectamine 2000转染试剂(美国Invitrogen公司);逆转录试剂盒(大连宝生物工程有限公司);SYBR Premix Ex Taq mix检测试剂盒(日本TaKaRa公司);CCK-8试剂、RIPA细胞裂解液(上海碧云天生物技术研究所);Annexin Ⅴ-FITC凋亡检测试剂盒(南京凯基生物有限公司);BCA蛋白检测试剂盒(武汉云克隆动物有限公司);ECL化学发光检测试剂盒(上海爱必信生物科技有限公司);TIMP1 siRNA及对照siRNA control(上海吉玛制药有限公司);TIMP1 抗体、Bcl-2抗体、Bax抗体及二抗(美国Abcam公司);TNF-α、IL-1β和IL-6 ELISA检测试剂盒(南京建成生物工程研究所)。
二、细胞培养
人肺泡上皮细胞HEPApiC培养在高糖DMEM培养基中,其中含有10%胎牛血清,放置在5%CO2、37℃恒温培养箱中,细胞贴壁生长,待细胞汇合度达80%以上时,使用0.25%胰蛋白酶消化细胞,按照1∶3比例进行传代培养,对数生长期的HEPApiC细胞用于实验。
三、细胞处理和分组
对数生长期的HEPApiC细胞接种到6孔板中,置37℃培养箱继续培养,将HEPApiC细胞分为4组,空白对照组、感染组、阴性对照组和干扰组。其中空白对照组是未做任何处理的HEPApiC细胞;感染组是HEPApiC细胞生长汇合度达90%时加入1×108个/mL的肺炎链球菌R6进行感染;阴性对照组是HEPApiC细胞生长汇合度达50%时以Lipofectamine 2000转染试剂转染siRNA control,转染48 h后加入1×108个/mL的肺炎链球菌R6进行感染;转染组是HEPApiC细胞生长汇合度达50%时以Lipofectamine 2000转染试剂转染TIMP1 siRNA,转染48 h后加入1×108个/mL的肺炎链球菌R6进行感染。转染具体操作步骤严格按照转染试剂说明书进行。
四、QPCR检测
各组HEPApiC细胞干预48 h后,分别收集各组细胞,根据Trizol试剂使用说明书提取各组HEPApiC细胞中总RNA,测定RNA的纯度和浓度,使用逆转录试剂盒将RNA逆转录成cDNA,并使用SYBR Premix Ex Taq mix检测试剂盒,以cDNA为模板进行QPCR检测。以β-actin为内参,采用2-ΔΔCt法计算各组HEPApiC细胞中TIMP1 mRNA相对表达水平。
五、Western blot检测
分别收集处理48 h后各组HEPApiC细胞,分别加入RIPA裂解液在冰上提取细胞中总蛋白。采用BCA法测定蛋白浓度,取等量蛋白样品行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,待蛋白分离后切断电源,将蛋白转印至硝酸纤维素膜上,将膜放置在5%脱脂奶粉的封闭液中室温封阻2 h。TBST洗膜后分别加入相应一抗(TIMP1一抗为1∶500稀释、Bcl-2一抗为1∶800稀释、Bax一抗为1∶800稀释),4 ℃杂交过夜,TBST洗膜后再加入1∶2000稀释的二抗,室温杂交2 h,TBST洗膜后加入ECL化学发光液,显影、定影,经成像系统扫描,采用Quantity One软件分析条带灰度值,以GAPDH为内参,以目的蛋白条带灰度值/GAPDH蛋白条带灰度值表示目的蛋白相对表达水平。
六、CCK-8法检测
将HEPApiC细胞以3×103个/孔接种到96孔板中,放置在37℃培养箱继续培养,根据上述1.3方法分组和处理,分别在24、48、72 h采用CCK-8法检测细胞活力,简言之,在各个时间点向每孔细胞中加入10 μL CCK-8溶液,37℃继续孵育4 h,使用酶标仪测定570 nm波长处光密度值(A值),计算细胞活力(%)=实验组A值/对照组A值×100%。
七、流式细胞术检测
各组HEPApiC细胞处理48 h,采用0.25胰蛋白酶消化细胞,离心并收集。使用预冷的PBS洗涤细胞2次,向细胞中加入100 μL 1×Binding Buffer悬浮细胞,依次向细胞悬液中加入Annexin Ⅴ-FITC和PI各5 μL,轻轻混匀,室温下避光反应15 min,再向细胞悬液中加入400 μL 1×Binding Buffer,随即上流式细胞仪进行检测。
八、ELISA检测
分别处理48 h的各组HEPApiC细胞上清液,分别采用TNF-α、IL-1β和IL-6 ELISA检测试剂盒测定上清中TNF-α、IL-1β和IL-6的含量,具体操作步骤参照ELISA检测试剂盒说明书。
九、统计学分析
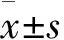
结 果
一、各组HEPApiC细胞中TIMP1的表达水平
QPCR和Western blot检测结果显示,肺炎链球菌感染后HEPApiC细胞中TIMP1 mRNA和蛋白表达水平明显高于空白对照组(P<0.05);转染TIMP1 siRNA后HEPApiC细胞中TIMP1 mRNA和蛋白表达水平显著低于阴性对照组和感染组(P<0.05);感染组和阴性对照组相比较,细胞中TIMP1 mRNA和蛋白表达水平差异不显著(P>0.05)(见图1、表1)。

图1 Western blot检测各组HEPApiC细胞中TIMP1蛋白表达情况

表1 各组HEPApiC细胞中TIMP1 mRNA和蛋白表达水平比较
注:与空白对照组比,*P<0.05;与感染组比,&P<0.05;与阴性对照组比,#P<0.05
二、敲低TIMP1基因表达对HEPApiC细胞活力的影响
CCK-8检测结果显示,肺炎链球菌感染后HEPApiC细胞活力明显低于空白对照组(P<0.05);敲低TIMP1后HEPApiC细胞活力高于阴性对照组和感染组(P<0.05);而感染组和阴性对照组相比较,细胞活力差异不显著(P>0.05)(见表2)。
三、敲低TIMP1基因表达对HEPApiC细胞凋亡的影响
流式细胞仪检测结果显示,肺炎链球菌感染后HEPApiC细胞凋亡率明显高于空白对照组(P<0.05);敲低TIMP1后HEPApiC细胞凋亡率明显低于阴性对照组和感染组(P<0.05);而感染组和阴性对照组相比较,细胞凋亡率差异不显著(P>0.05)(见图2、表3)。
四、敲低TIMP1基因表达对HEPApiC细胞中Bcl-2和Bax蛋白表达的影响
Western blot检测结果显示,肺炎链球菌感染后HEPApiC细胞中Bcl-2蛋白表达水平明显低于空白对照组(P<0.05),Bax蛋白表达水平明显高于空白对照组(P<0.05);敲低TIMP1后HEPApiC细胞中Bcl-2蛋白表达水平明显高于阴性对照组和感染组(P<0.05),Bax蛋白表达水平明显低于阴性对照组和感染组(P<0.05);而感染组和阴性对照组相比较,细胞中Bcl-2和Bax蛋白表达水平差异不显著(P>0.05)(见图3、表4)。

表2 CCK-8检测各组HEPApiC细胞活力
注:与空白对照组比,*P<0.05;与感染组比,&P<0.05;与阴性对照组比,#P<0.05

图2 流式细胞术检测各组HEPApiC细胞凋亡情况

表3 各组HEPApiC细胞凋亡率比较
注:与空白对照组比,*P<0.05;与感染组比,&P<0.05;与阴性对照组比,#P<0.05

图3 Western blot检测各组HEPApiC细胞中Bcl-2和Bax蛋白表达水平

表4 各组HEPApiC细胞中Bcl-2和Bax蛋白水平比较
注:与空白对照组比,*P<0.05;与感染组比,&P<0.05;与阴性对照组比,#P<0.05
五、敲低TIMP1基因表达对炎症因子表达的影响
ELISA检测结果显示,肺炎链球菌感染后HEPApiC细胞培养上清液中TNF-α、IL-1β和IL-6含量明显高于空白对照组(P<0.05);敲低TIMP1后HEPApiC细胞上清液中TNF-α、IL-1β和IL-6含量明显低于阴性对照组和感染组(P<0.05);而感染组和阴性对照组相比较,细胞上清液中TNF-α、IL-1β和IL-6含量差异不显著(P>0.05)(见表5)。

表5 ELISA检测各组细胞上清液中TNF-α、IL-1β和IL-6含量
注:与空白对照组比,*P<0.05;与感染组比,&P<0.05;与阴性对照组比,#P<0.05
讨 论
根据世界卫生组织的统计数据,肺炎每年造成约160万人死亡,已成为全世界主要公共卫生问题[8]。估计有90%的肺炎相关死亡发生在发展中国家,革兰氏阳性菌如肺炎链球菌引起的肺炎占所有重症肺炎病例的很大一部分[9-10]。肺炎发病机制目前尚不完全清楚,多项研究发现肺泡上皮细胞作为肺组织肺泡屏障功能的细胞与肺炎的发生和发展密切相关[11-12]。研究表明,TIMP-1基因在调节机体生长发育及生理病理等过程均发挥重要功能。最近Mammen等人的结果显示,TIMP-1缺乏导致小鼠哮喘表型,表现出气道高反应性,增强嗜酸性粒细胞炎症和T辅助细胞2型细胞因子基因和蛋白质表达卵清蛋白致敏;从TIMP-1敲除小鼠过敏性哮喘模型分离的肺组织中检测发现炎症因子的表达显著增加[13]。Wu等研究显示,IL-33可通过诱导MMP-9和TIMP-1之间的失衡来调节细胞外基质的沉积并促进肺纤维化过程[14]。Wills报道指出,在TIMP-1表达低的非小细胞肺癌患者,使用异丙肾上腺素联合贝伐单抗具有良好的抗肿瘤活性[15]。近期Jia等人通过鉴定来自健康对照的外周血样品与患有细菌性肺炎的患者之间的差异表达的基因发现,TIMP-1等五个关键基因在革兰氏阳性细菌引起的肺炎患者外周血中表达上调,提示TIMP-1等基因可能与细菌性肺炎的发病密切相关[16]。然而关于其在肺炎中的作用及其机制的研究仍然较少,本实验发现,在肺炎链球菌诱导的肺泡上皮HEPApiC细胞中TIMP-1 mRNA和蛋白表达量明显升高,提示TIMP-1的过表达可能参与肺炎的发生。本研究通过在HEPApiC细胞中转染TIMP-1 siRNA,探究敲低TIMP-1对肺炎链球菌诱导的HEPApiC细胞凋亡的影响及可能的分子机制。
研究显示,肺泡上皮细胞凋亡在肺炎发生和发展中发挥关键性作用。Shi等研究显示,肺炎支原体通过激活外部死亡受体途径,促进肺泡上皮细胞的凋亡来影响儿童肺炎的发展[17]。Suliman的研究暗示肺炎损伤的AT2细胞中的线粒体质量控制活化促进肺泡上皮细胞存活,抑制细胞凋亡以支持肺泡功能[18]。本实验结果发现,肺炎链球菌能够抑制HEPApiC细胞活力,而敲低TIMP-1能够上调HEPApiC细胞活力。且肺炎链球菌能够促进HEPApiC细胞凋亡,而敲低TIMP-1能够部分逆转肺炎链球菌诱导的HEPApiC细胞凋亡。Western blot检测结果显示,肺炎链球菌诱导的HEPApiC细胞中促凋亡蛋白Bax的表达水平明显升高,抑凋亡蛋白Bcl-2的表达水平明显降低,而敲低TIMP-1能够下调Bax的表达,上调Bcl-2的表达。提示,敲低TIMP-1可能通过上调Bcl-2的表达和下调Bax的表达阻碍肺炎链球菌诱导的HEPApiC细胞凋亡。炎症反应的激活是导致肺炎发生的重要因素之一,而炎症因子的大量合成和分泌,势必导致炎症级联反应最终引发组织器官受损[19-20]。TNF-α的过度表达能够引起炎症反应的失控加重组织损伤,严重时可导致全身性炎症反应[21]。IL-1β主要由活化的单核巨噬细胞产生,能够诱导巨噬细胞炎症蛋白等多种炎症因子的合成和分泌[22]。IL-6是一种主要由淋巴细胞和单核巨噬细胞分泌的促炎因子,其可直接参与炎症反应及组织损伤[23]。以往研究显示,在肺炎组织中,TNF-α、IL-1β和IL-6等炎症因子的表达显著升高[24-25]。本实验结果表明,肺炎链球菌处理HEPApiC细胞后,上清液中TNF-α、IL-1β和IL-6的含量显著升高,而敲低TIMP-1能够减少TNF-α、IL-1β和IL-6的含量。提示TIMP-1可能通过抑制肺炎链球菌诱导的炎症反应降低细胞凋亡来阻碍肺炎的发生和发展。
综上,敲低肺泡上皮HEPApiC细胞中TIMP1基因表达,能够抑制肺炎链球菌诱导的细胞凋亡,其作用机制可能通过抑制肺炎链球菌诱导炎症反应来实现,但TIMP1在肺炎中的具体作用机制仍需深入探讨。本实验为进一步研究细菌性肺炎的发病机制奠定一定的基础,为靶向TIMP1治疗细菌性肺炎提供理论依据。

