巨噬细胞条件性Atg5基因敲除小鼠的构建及鉴定
黄小荣,黄衍恒,叶霖,杨陈,汤济鑫,安宁,刘建兴,刘华锋
(广东医科大学附属医院肾病研究所,湛江市慢性肾脏病防控重点实验室,湛江 524001)
巨噬细胞属于单核吞噬细胞家族成员,既在固有免疫中起重要作用,也可通过招募其他免疫细胞如淋巴细胞产生适应性免疫反应,进而在机体免疫反应、组织损伤和修复中起关键作用[1]。根据表型和功能不同,巨噬细胞可分为不同的亚类,一般可分为经典活化型M1促炎巨噬细胞(M1)和替代活化型M2抗炎巨噬细胞(M2)。M1可大量分泌TNF-α、IL-1β、IL-6、IL-23、活性氧簇(ROS)等促炎细胞因子;而M2则可分泌IL-4、IL-13、IL-10、TGF-β1等炎症抑制因子,及成纤维细胞生长因子及血小板衍生因子等促纤维化因子[2-3]。几乎所有类型的急性肾损伤和进行性慢性肾脏病都可在肾小球及肾间质中检测到巨噬细胞浸润[4],且根据肾脏微环境变化,巨噬细胞可在促炎表型和抗炎促纤维化表型之间进行转化[5],从而在肾小管-间质损伤、修复和纤维化各阶段中发挥着不同作用[4, 6-8],显著影响肾小管-间质损伤的最终转归。
近年来,自噬通路在肾小管-间质损伤进程中的作用越来越受关注;而目前对自噬的研究主要集中在TECs上[9-10],免疫细胞自噬在肾脏疾病的作用研究尚涉及甚少。现研究认为,自噬可影响免疫细胞的增殖、凋亡、迁徙、分化、活化以及炎症因子分泌[11]。有研究表明在眼色素层炎[12]、高脂饮食诱导肥胖小鼠[13]、半乳糖胺联合LPS诱导的急性肝损伤[14]等诸多炎症模型中,特异性阻断巨噬细胞自噬通路,可引起巨噬细胞炎症体降解受阻而分泌大量炎症因子IL-1阻和IL-18,加剧疾病相关器官的炎症反应及损伤严重程度[12]。因此巨噬细胞自噬很可能参与调节机体炎症免疫反应,影响疾病进展。然而在肾脏疾病发生发展过程中,自噬如何调节巨噬细胞功能,进而影响肾脏疾病进展尚未知晓。
ATG5是自噬通路中的关键蛋白,对于自噬泡形成及降解是必不可少的[15]。ATG12-ATG/ ATG16复合物通过参与LC3-PE偶联途径或直接与膜结合两种方式形成自噬体膜[16];并且ATG5可通过与自噬体膜上的TECRP结合,促进自噬体与溶酶体融合[17-18],形成自噬溶酶体,最终降解其所包裹的内容物。敲低或敲除ATG5可导致自噬下调或完全抑制,表明ATG5在自噬通路中起关键作用[19]。因此,巨噬细胞条件性Atg5基因敲除小鼠模型的构建,为在动物水平上研究巨噬细胞自噬在肾脏疾病发生发展中的作用是可行且非常必要的。在本实验中我们将探讨最佳繁殖方案、繁育小鼠基因型鉴定及Atg5敲除效果分析,为研究巨噬细胞自噬在肾脏疾病发病机制中的作用提供实验材料。
1 材料与方法
1.1 材料
1.1.1 实验动物
4月龄SPF级C57BL/6J-Atg5em2(flox)/SMOC小鼠共6只,雌雄各3只;LysM-Cre JAX stock No. 004781小鼠共4只,雌雄各2只,体重20 ~25 g,购于上海南方模式生物科技股份有限公司【SCXK(泸)2017-0010】,饲养于广东医科大学实验动物中心【SYXK(粤)2015-0147】。所有小鼠饲养于12 h/12 h光照/黑暗条件下,自由采食和饮水,所有操作均符合实验动物伦理学要求(GDY1801016)。
1.1.2 试剂与仪器
Premix Tag 2.0 plus(TaKaRa,日本);BIOWEST AGAROSE,Gel red核酸凝胶染料(联硕科技有限公司,中国);TAE缓冲液(广州锐科生物有限公司,中国);雷帕霉素(Sigma,美国),氯喹(Sigma,美国),anti-LC3 II antibody(Sigma,美国);anti-SQSTM1/p62 antibody(MBL,日本);anti-Atg5 antibody,辣根酶标记山羊抗兔IgG(Abcam,英国);anti-GAPDH antibody(上海碧云天生物技术有限公司,中国)。
凝胶电泳仪(Bio-Rad,美国);Azure biosystems c500双激光近红外成像分析仪(Azure biosystems,美国);ProFlexTM3 x 32-well PCR System(Applied Biosystems,美国)。
1.2 方法
1.2.1 小鼠尾部组织基因组DNA的提取、扩增及鉴定
(1) DNA提取:采用碱裂解法提取鼠尾组织基因组DNA。待新生小鼠达3~4周龄打耳标后,剪取小鼠鼠尾约3 mm,置于1.5 mL EP管中;加入50 mmol/L NaOH溶液90 μL,置恒温水浴锅中95℃加热30 min。待EP管冷却后,加入1 mol/L Tris溶液(pH 8.0)10 μL充分震荡混匀,以12 000 r/min离心2 min。取上清置于新1.5 mL EP管中,-20℃保存。
(2) PCR扩增:Flox基因的上游引物:5′-TTCAGTGTACCCTGTGTATTGG-3′,下游引物:5′-GGGAAACAGTTGTGTTCTTTGT-3′和Cre基因的上游引物:5′-CTTGGGCTGCCAGAATTTCTC-3′,下游引物:5′-CCCAGAAATGCCAGATTACG-3′,5′-TTACAG TCGGCCAGGCTGAC-3′;反应体系25 μL;扩增程序为94℃预变性2 min,94℃变性30 s,62℃退火30 s,72℃延伸1 min,35个循环,72℃延伸5 min。
(3) PCR产物鉴定:PCR产物使用1.5%(质量浓度)琼脂糖凝胶电泳,采用凝胶成像分析系统观察分析条带位置。琼脂糖凝胶上的PCR条带出现与Flox基因、Cre基因PCR产物大小一致的条带为阳性结果,否则为阴性结果。
1.2.2 巨噬细胞Atg5基因敲除效果验证
将已进行基因型鉴定的小鼠,进行敲除效果鉴定。待小鼠8周龄后,取Atg5+/+小鼠及Atg5-/-小鼠骨髓细胞,使用M-CSF刺激7 d,诱导为成熟巨噬细胞,提取其RNA及蛋白质。将提取的RNA逆转录为cDNA后,进行PCR扩增,上游引物序列:5′-TTCAGTGTACCCTGTG TATTGG-3′,下游引物序列:5′-GGGAAACAGTTGTGTTCTTTGT-3′,然后将PCR产物送天一辉远生物科技有限公司进行测序。
用RIPA裂解液提取巨噬细胞蛋白,BCA法测定蛋白含量;按每孔30 μg总蛋白上样,行SDS-PAGE电泳,电泳完成后将蛋白转移至0.22 μm PVDF膜上;20 mL含5%BSA封闭液室温封闭1 h;分别加入1× PBST稀释的抗ATG5多克隆抗体(1∶1000)、抗LC3多克隆抗体(1∶1000)、抗P62多克隆抗体(1∶1000)和抗GAPDH单克隆抗体(1∶1000),4℃孵育过夜;20 mL 1×PBST缓冲液中洗膜3次,每次5 min;加入1×PBST缓冲液稀释的二抗辣根酶标记山羊抗兔IgG (1∶1000),置摇床室温孵育1 h;20 mL 1×PBST缓冲液中洗膜3次,每次5 min;在Azure biosystems c500双激光近红外成像分析仪曝光成像。通过检测自噬相关蛋白(如LC3 II、p62等),观察雷帕霉素(Rapamycin,10 μmol/L)及氯喹(Chloroquine,10 μmol/L)刺激24 h后,是否能够激活/抑制Atg5-/-小鼠巨噬细胞自噬,进一步确定Atg5-/-小鼠巨噬细胞自噬功能缺陷。
2 结果
2.1 小鼠的繁殖情况
为挑选出最佳繁殖方案,我们在得到F2代小鼠后,采用了2种配种方式进行繁殖(图1);结果为若按F2a得到实验小鼠(Atg5flox/floxCre+/-或Atg5flox/floxCre-/-)共5只,占50%(5/10),若按F2b得到实验小鼠(Atg5flox/floxCre+/-或Atg5flox/floxCre-/-)共3只,占25%(3/12);以上两种繁育方案的分离比例均符合基本孟德尔遗传定律,表明巨噬细胞条件性敲除Atg5基因后对小鼠繁殖能力无明显影响,且F2代采用F2a繁殖方式,获得巨噬细胞条件性敲除Atg5基因小鼠及对照小鼠的效率更高。
2.2 小鼠基因型鉴定结果
将鼠尾组织基因组DNA进行扩增后电泳,结果见图2。其中小鼠Flox基因型鉴定结果见图2A,其中1为Flox/Flox纯合小鼠(469 bp),2、3和5为Flox/- 杂合子(469 bp和411 bp),4为野生型(411 bp)。Cre基因型鉴定结果见图2B,其中1、2、4、5为Cre+/-(700 bp和350 bp),3和6为Cre-/-(350 bp)。
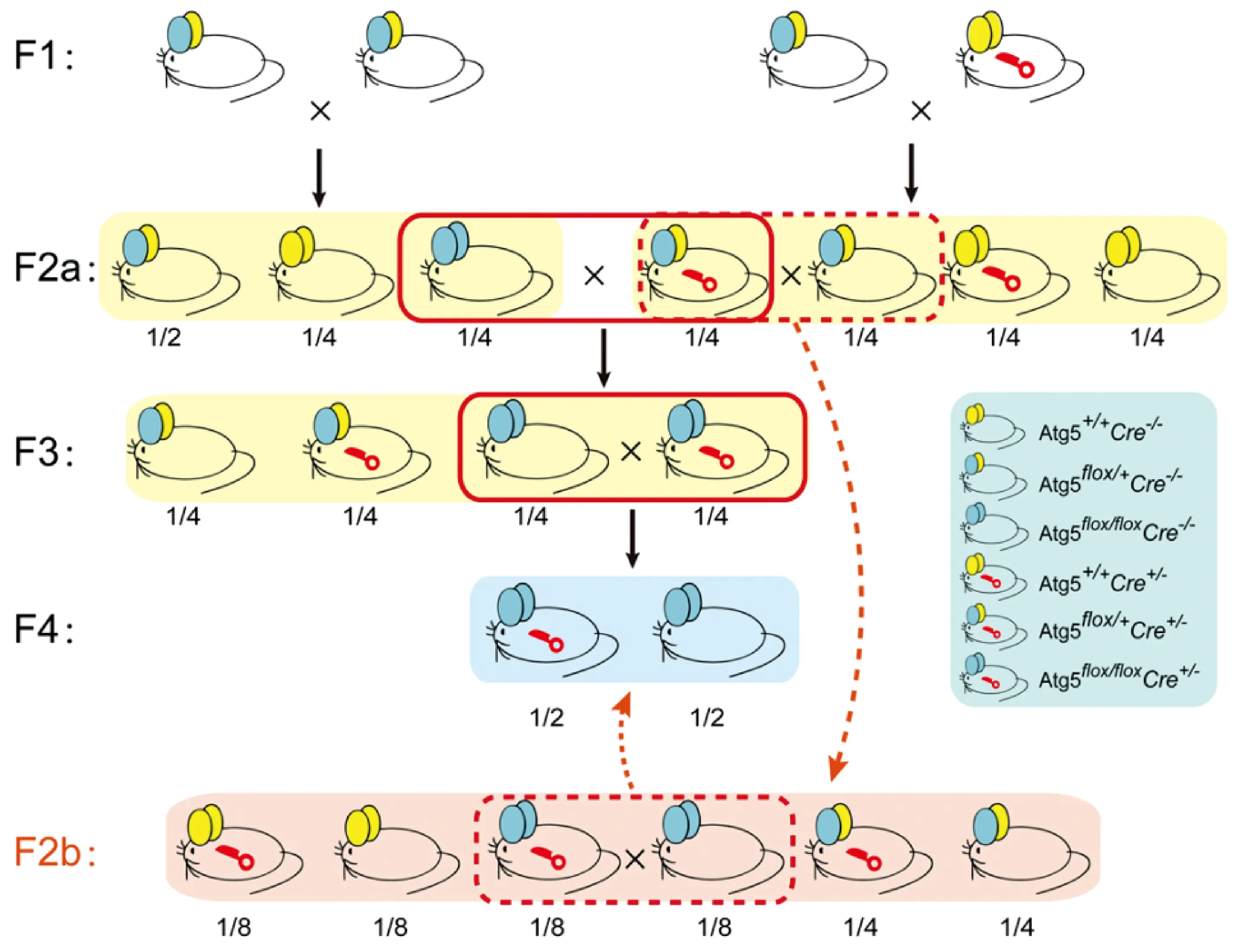
注:“→”为F2a繁殖方式,“--→”为F2b繁殖方式。图1 小鼠繁殖方案Note. “→”is the propagation mode of F2a and “--→”is the propagation mode of F2b.Figure 1 Mice breeding program
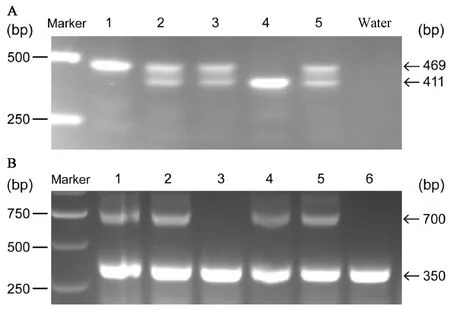
注:A为小鼠Flox基因型鉴定结果,其中1为Flox/Flox纯合小鼠,2、3和5为Flox/- 杂合子,4为野生型。B为Cre基因型鉴定结果,其中1、2、4、5为Cre+/-,3和6为Cre-/-。图2 部分小鼠基因型PCR鉴定Note: A shows the identification results of Flox genotype in mice, in which 1 is Flox/Flox homozygous mouse, 2, 3 and 5 are Flox/- heterozygotes, and 4 is wild type. B shows the identification result of Cre genotype in mice, in which 1, 2, 4, 5 were Cre+/-, and 3 and 6 were Cre-/-.Figure 2 Results of genotype identification of some mice by PCR
2.3 Atg5基因敲除效果鉴定
分别提取Atg5-/-小鼠和Atg5+/+小鼠骨髓细胞,诱导成巨噬细胞;
(1)基因水平敲除效果鉴定:提取该骨髓来源的巨噬细胞RNA,逆转录为cDNA后,使用特异性引物进行PCR扩增,将PCR产物进行测序,结果显示Atg5-/-小鼠编码区Exon3(约128 bp)被敲除(图3A-D)。
(2)蛋白水平敲除效果鉴定:提取两组小鼠骨髓来源巨噬细胞蛋白进行Western blotting检测,结果显示:与Atg5+/+小鼠相比,Atg5-/-小鼠 ATG5 蛋白表达水平明显减少(图3E);且Atg5-/-小鼠巨噬细胞内p62明显增多,而LC3II明显减少(图3F),提示Atg5-/-小鼠巨噬细胞内自噬水平低下。
(3)功能水平敲除效果鉴定:使用雷帕霉素(Rap)诱导自噬后,Atg5-/-小鼠巨噬细胞自噬不能恢复到正常基础水平,提示Atg5-/-小鼠巨噬细胞自噬缺陷;综上,巨噬细胞条件性Atg5基因敲除小鼠构建成功。
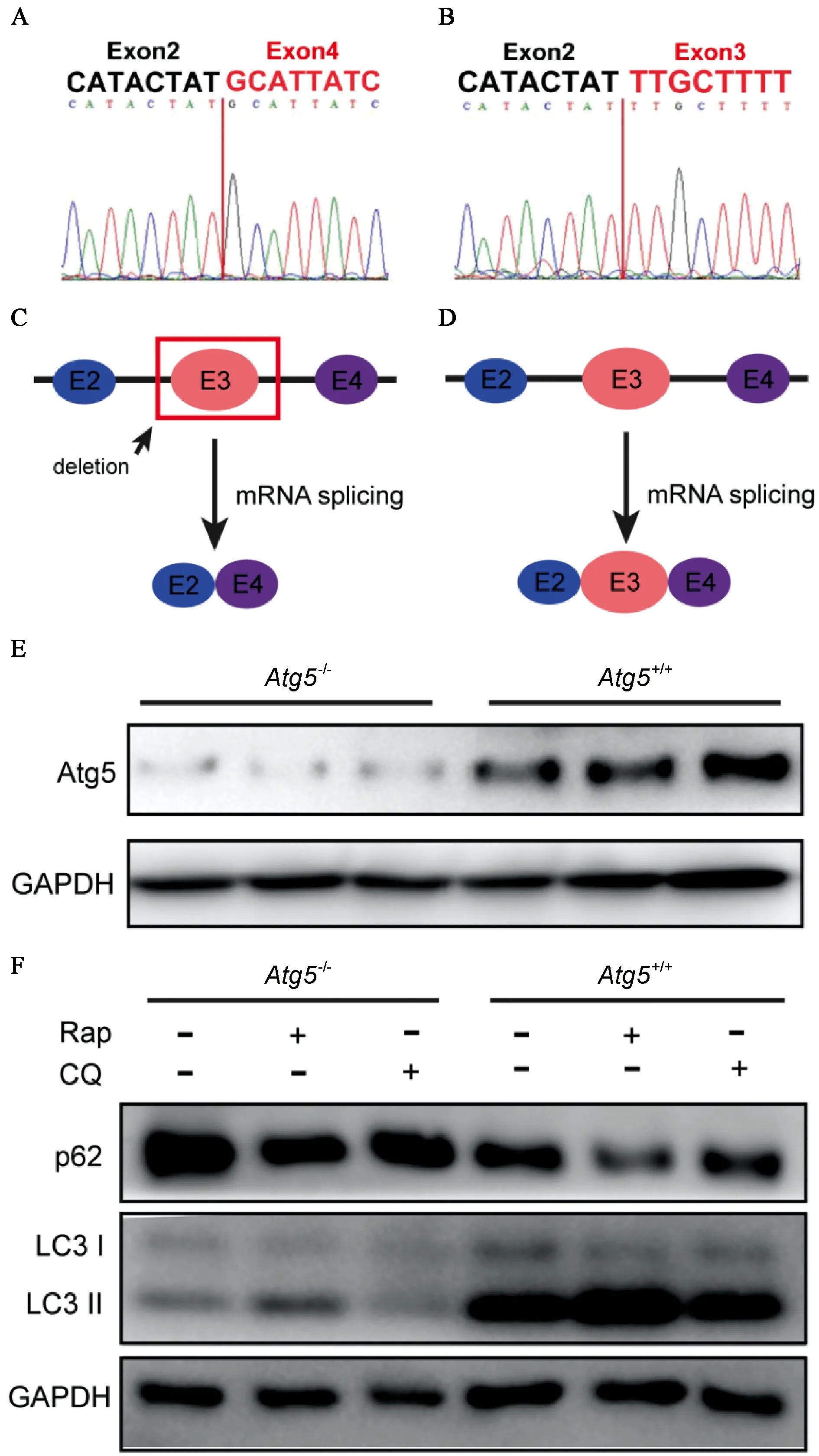
注:A、B分别为Atg5-/-(实验组小鼠)和Atg5+/+(对照组小鼠)骨髓来源巨噬细胞Atg5 mRNA逆转录为cDNA的测序结果。C、D为两组小鼠Atg5 mRNA改变示意图。E为两组小鼠骨髓来源巨噬细胞ATG5蛋白表达情况。F为使用雷帕霉素(Rap)和氯喹(CQ)调控自噬后,两组小鼠骨髓来源巨噬细胞对该调控的反应情况。图3 Atg5基因敲除效果鉴定Note. A and B are the sequencing results of Atg5-/- (experimental group) and Atg5+/+ (control group), respectively. C and D show the changes of Atg5 mRNA in mice of the two groups. E shows the expression of ATG5 protein in mouse bone marrow derived macrophages in the two groups. F shows the response of bone marrow derived macrophages of mice in the two groups to the regulation of autophagy by rapamycin (Rap) and chloroquine (CQ).Figure 3 Identification of the efficiency of gene Atg5 knockout
3 讨论
基因敲除技术是利用一定的生物技术手段,使特定的目的基因缺失或者失活,从而排除其他因素对实验结果的干扰,使实验结果变得更可靠和直观。基因敲除包括全身性基因敲除及条件性基因敲除两种方法,其中全身性基因敲除是指在小鼠所有组织细胞中,将靶基因敲除掉,从而使靶基因的表达缺失。本文所提及的基因条件性敲除是利用Cre-Loxp重组系统,将Cre基因插入特定的启动子序列后面,即可人为地控制Cre基因在某些细胞谱系或者在机体发育的特定时间段亦或在外源性药物诱导下表达,表达的CRE蛋白识别特定的 DNA 序列 (如 Loxp 位点),并进行Loxp 位点之间的靶基因剪切,从而实现目的基因在特定细胞类型中功能性缺失[20]。本研究中,我们选用了条件性Atg5基因敲除方案,一方面是出于实验目的的考虑,另一方面也是为了避免全身性敲除Atg5基因导致小鼠胚胎期死亡或出生期死亡的劣势[21],我们引入的LysM-Cre小鼠是将CrecDNA靶向插入其内源性M溶菌酶基因座,从而使CRE重组酶特异性表达在包括巨噬细胞在内的髓样细胞中。
由于巨噬细胞具有高度异质性,而且其基因表达谱和单核细胞、粒细胞及树突状细胞之间有很大的重叠[22];因此,一个完全针对巨噬细胞的转基因Cre小鼠在本质上是不存在的。目前靶向巨噬细胞的Cre小鼠主要是基于单核细胞/巨噬细胞标志物,如LysM、CSF1R、CD11b和CX3CR1等。其中Csf1r-Cre小鼠可用于研究巨噬细胞发育的命运图谱分析,虽然该转基因小鼠巨噬细胞基因敲除效率较高,但特异性很低,因Csf1r-Cre可表达于所有白细胞[23]。CD11b-Cre小鼠对巨噬细胞基因敲除效率较低,而且CD11b-Cre不仅表达在单核细胞和巨噬细胞,在中性粒细胞和树突状细胞也具有一定的活性。Cx3cr1-Cre小鼠主要针对单核/巨噬细胞和树突细胞,对中性粒细胞的影响较小,但其在脾巨噬细胞以及外周血单核细胞基因的敲除效率相对较低[24]。虽然LysM也在大多数粒细胞和少数CD11c+树突状细胞中表达,但LysM-Cre小鼠对成熟巨噬细胞基因的敲除效率非常高[20]。因此,即使LysM-Cre小鼠对组织常驻巨噬细胞基因的敲除效率不高[24],但其仍是研究巨噬细胞最常用的工具鼠。
为了研究自噬生物学功能,目前几种自噬相关基因缺失小鼠已被报道构建成功,包括Atg5-/-、Atg7-/-和Beclin1-/-小鼠[21, 25-26];其中BECLIN 1通过与VPS34结合,调控吞噬泡的形成及成熟;而ATG5是自噬通路的上游蛋白,启动自噬体形成,并与ATG12和ATG16结合,促进LC3与PE结合,使LC3沉积在自噬体膜上;ATG7是ATG12与ATG5结合所必需的一种类似E1的酶[19]。因此,敲除Atg5、Atg7或者Beclin1都可以达到自噬抑制的作用。然而Beclin1在细胞凋亡途径起到重要的作用,而且Beclin1+/-突变小鼠发生自发性肿瘤的几率较高[26],所以Beclin1并不是研究自噬的特异基因。虽然有研究表明Atg5或Atg7缺失小鼠的细胞仍然可以形成自噬体/自噬溶酶体,并在受到一定应激时可进行自噬介导的蛋白降解[27],但由于ATG5不仅参与自噬泡形成,而且通过与TECRP结合,促进自噬体与溶酶体的融合[19],所以Atg5-/-小鼠仍是目前用于研究自噬相关功能最常用的小鼠。
基因敲除小鼠的靶基因敲除后可能影响小鼠生殖功能[28],我们实验结果表明巨噬细胞条件性敲除Atg5后并不影响小鼠的生殖能力;在本实验中,我们探讨总结了最佳繁育方案,该繁殖方案可在较短时间、较高概率获得实验所需基因型小鼠,为后续研究巨噬细胞自噬在肾脏疾病发病机制中的作用提供小鼠数量保障。
基因型鉴定是进行基因敲除小鼠繁育保种的重要环节[29]。本研究采用碱裂解法提取鼠尾组织基因组DNA,参照上海南方模式生物科技股份有限公司提供的引物序列,通过普通的PCR扩增凝胶电泳成功鉴定巨噬细胞条件性Atg5基因敲除小鼠的基因型;与用DNA提取试剂盒提取基因组DNA相比,两种方法的检测结果一致,但碱裂解法耗时更短、费用更低(结果未展示),说明该方法可以作为检测巨噬细胞条件性Atg5基因敲除小鼠的基因型的一种快速可靠方法。
综上,本研究成功建立了巨噬细胞条件性Atg5基因敲除小鼠模型且能正常繁殖。该小鼠模型为研究巨噬细胞自噬(Atg5)在肾脏疾病发病机制中的作用机制提供了可靠的体内实验模型。

